Mutantes de proteínas no estructurales de VHC y usos de los mismos.
Un polipeptido aislado que comprende la secuencia deaminoacidos de la SEC ID Nº 2,
4 o 6, en el que el polipeptido comprende un epitopo conformacional de NS3.
Tipo: Patente Internacional (Tratado de Cooperación de Patentes). Resumen de patente/invención. Número de Solicitud: PCT/US2005/030325.
Solicitante: NOVARTIS VACCINES AND DIAGNOSTICS, INC..
Nacionalidad solicitante: Estados Unidos de América.
Dirección: INTELLECTUAL PROPERTY - R440 P.O. BOX 8097 EMERYVILLE, CA 94662-8097 ESTADOS UNIDOS DE AMERICA.
Inventor/es: CHIEN, DAVID, Y., COIT,DORIS, MEDINA-SELBY,ANGELICA, HU,Celine Yuan-Hwei, LIN,Sansan.
Fecha de Publicación: .
Clasificación Internacional de Patentes:
- C07K14/18 QUIMICA; METALURGIA. › C07 QUIMICA ORGANICA. › C07K PEPTIDOS (péptidos que contienen β -anillos lactamas C07D; ipéptidos cíclicos que no tienen en su molécula ningún otro enlace peptídico más que los que forman su ciclo, p. ej. piperazina diones-2,5, C07D; alcaloides del cornezuelo del centeno de tipo péptido cíclico C07D 519/02; proteínas monocelulares, enzimas C12N; procedimientos de obtención de péptidos por ingeniería genética C12N 15/00). › C07K 14/00 Péptidos con más de 20 aminoácidos; Gastrinas; Somatostatinas; Melanotropinas; Sus derivados. › Togaviridae, p. ej. Flavivirus, virus de la peste, virus de la fiebre amarilla, virus de la hepatitis C, virus de la encefalitis japonesa.
- G01N33/576 FISICA. › G01 METROLOGIA; ENSAYOS. › G01N INVESTIGACION O ANALISIS DE MATERIALES POR DETERMINACION DE SUS PROPIEDADES QUIMICAS O FISICAS (procedimientos de medida, de investigación o de análisis diferentes de los ensayos inmunológicos, en los que intervienen enzimas o microorganismos C12M, C12Q). › G01N 33/00 Investigación o análisis de materiales por métodos específicos no cubiertos por los grupos G01N 1/00 - G01N 31/00. › para la hepatitis.
PDF original: ES-2377978_T3.pdf
Fragmento de la descripción:
Mutantes de proteinas no estructurales del VHC y usos de los mismos Campo de la técnica La presente revelacion se refiere a, en general, construcciones del virus de la hepatitis C (VHC) y a procedimientos de uso de los mismos. Mas particularmente, la invencion se refiere a proteinas inmunogenicas e inmunorreactivas del VHC con dominios modificados de la NS3 proteasa, de modo que se inhibe la actividad proteolitica de la molecula NS3. Las proteinas modificadas conservan los epitopos conformaciones y, por tanto, son utiles en inmunoensayos para el diagnostico de la infeccion por VHC, asi como para estimular la respuesta inmunitaria frente al VHC.
10 Antecedentes de la invención
El virus de la hepatitis C (VHC) es la causa principal de la hepatitis parenteral (NANBH) , que se transmite, principalmente, mediante transfusiones de sangre y e intercambio de fluidos corporales. El virus esta presente en el 0, 4-2, 0% de la poblacion general de EE.UU. La hepatitis cronica se desarrolla en aproximadamente un 50% de las infecciones y, de estas, aproximadamente el 20% de los individuos infectados desarrolla cirrosis hepatica que, en ocasiones, conduce a carcinoma hepatocelular. En consecuencia, el estudio y control de la enfermedad es de importancia medica.
Houghton y col. Identificaron y caracterizaron por primera vez el VHC, como cassa de NANBH. Se conoce la secuencia genomica viral del VHC, como lo son los procedimientos para obtener la secuencia. Vease, por ejemplo, las publicaciones internacionales nº W0 89/04669 W0 90/11089 y W0 90/14436. El VHC tiene genoma de ARN
monocatenario de 9, 5 kb de sentido positivo y es miembro de la familia Flaviridae de virus. Sobre la base del analisis filogenetico se han identificado al menos seis genotipos distintos aunque relacionados del VHC (Simmonds y col., J. Gen. Virol. (1993) 74:2391-2399) . El virus codifica una unica poliproteina que tiene mas de 3000 residuos de aminoacidos (Choo y col., Science (1989) 244:359-362; Choo y col., Proc. Natl. Acad. Sci. USA (1 991) 88:24512455; Han y col., Proc. Natl. Acad. Sci. USA (1991) 88:1711-1715) . La poliproteina se procesa al mismo tiempo y despues de la traduccion en proteinas tanto estructurales como no estructurales (NE) .
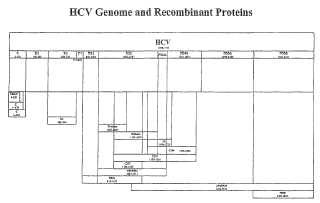
En particular, como se muestra en la Figura 1, en el genoma del VHC se codifican varias proteinas. El orden y la nomenclatura de los productos de la escision de la poliproteina del VHC es el siguiente: NH2-C-E1-E2-P7-NS2-NS3-NS4a-NS4b-NS5a-NS5b-C00H. La escision inicial de la poliproteina esta catalizada por las proteasas del huesped, que liberan tres pos ibles proteinas estructurales compuestas por la proteina N-terminal de la nucl eocapside (denominada "del nucleo" y dos glicoproteinas de la cubierta, "E1" (tambien conocida como E) y "E2" (tambien conocida como E2/NS1) , asi como proteinas no estructurales (NS) que contienen las enzimas virales. Las regiones NS se denominan NS2, NS3, NS4, NS4a, NS4b, NS5a y NS5b. NS2 es una proteina integral de la membrana que posee actividad proteolitica. NS2, sola o en combinacion con NS3, escinde el enlace scissile NS2-NS3 que, a su vez, genera el extremo NS3 N y libera una poliproteina grande que incluye las actividades serina proteasa y ARN
helicasa. La proteasa NS3 sirve para procesar el resto de la poliproteina. En concreto, la proteina NS3 del VHC es una proteina de 630 aminoacidos que contiene tres dominios funcionales. El dominio de tipo serin a proteasa se localiza en el extremo amino, mientras que la actividad helicasa y NTPasa estan en el extremo carboxi. La serina proteasa de NS3 es responsable de la escision en la union de NS3/4a, NS4a/b, NS4b/5a y NS5a/b.
Se ha descrito una serie de polipeptidos generales y especificos utiles como reactivos inmunologicos y diagnosticos 40 para el VHC, derivado de la poliproteina del VHC. Vease, por ejemplo, Houghton y col., publicacion europea nº
318.216 y 388.232; Choo y col., Science (1989) 244:359-362; Kno y col., Science (1989) 244:362-364; Houghton y col., Hepatology (1991) 14:381-388; Chien y col., Proc. Natl. Acad. Sci. USA (1992) 89:10011-10015; Chien y col., J. Gastroent. Hepatol. (1993) 8:533-39; Chien y col., publicacion internacional Nº W0 93/00365; Chien, D.Y., publicacion internacional Nº W0 94/01778. Estas publicaciones proporcionan una extensa informacion basica sobre 45 el VHC en general, asi como sobre la fabricacion y usos de los reactivos inmunologicos del polipeptido del VHC.
Procedimientos sensibles y especificos para la deteccion selectiva y la identificacion de portadores de VHC y de sangre o productos sanguineos contaminados por el VHC proporcionarian un importante avance en medicina. La hepatitis postransfusional (HPT) se produce en aproximadamente el 10 % de los pacientes transfundidos y el VHC ha sido responsable de hasta el 90 % de estos casos. Los cuidados del paciente, asi como la prevencion y la 50 transmision del VHC por sangr e y productos sanguineos o mediante contacto personal intimo requieren herramientas diagnosticas y pronosticas. De acuerdo con esto, se han desarrollado varios ensayos para el serodiagnostico de la infeccion por VHC. Vease, por ejemplo, Choo y col., Science (1989) 244:359-362; Kuo y col., Science (1989) 244:362-364; Choo y col., Br. Med. Bull. ( 1990) 46: Vease, Ebeling y col., Lancet (1990) 335:982983; van der Poel y col., Lancet (1990) 335:558-560; van der Poel y col., Lancet (1991) 337:317-319; Chien, D.Y., 55 publicacion internacional Nº W0 94/01778; Valenzuela y col., publicacion internacional Nº W 0 97/44469; y Kashiwakuma y col., patente de EE.UU. nº 5.871.904.
La patente de EE.UU. nº 6.632.601 describe inmunoensayos usando epitopos c onformacionales NS3/4a en combinacion con antigenos de fusion de multiples epitopos (MEFA) . Los ensayos proporcionan procedimientos 2 sensibles y fiables para detectar la seroconversion temprana del VHC. NS3/4a, expresada en levaduras y purificada en condiciones no desnaturalizantes, tal como se describe en la patente de EE.UU. nº 6.632.601, contiene las funciones de proteasa y helicasa. Dado que la NS3/4a purificada de este modo conserva la conformacion nativa, se ha d escubierto qu e es ma s sensib le q ue los a ntigenos c20 0 o c 33c e n la d eteccion de a nticuerpos de seroconversion temprana. En los ensayos de anticuerpos con NS3/4a yMEFA 7.1 como antigenos, se detectaron anticuerpos de seroconversion 2-14 dias antes que los ensayos para VHC comercializados en la actualidad. No obstante, la proteina NS3/4 sufre autohidrolisis y escinde el MEFA 7.1 debido a la actividad de NS3 proteasa.
Las publicaciones internacionales nº W0 04/00547 yW0 01/38360 describen proteinas del VHC que incluyen dominios mutados de NS3 proteasa con menor actividad proteolitica. No obstante, sigue existiendo la necesidad de herramientas diagnosticas y pronosticas sensibles y precisas con el fin de proporcionar una adecuada atencion al paciente, ademas de para prevenir la transmision del VHC mediante sangre y productos hemoderivados o mediante contacto personal estrec ho. Los documentos W 0 01/ 38360 y W 0 200 4/005473 divu lgan p olipeptidos que comprenden un dominio de proteasa NS3 de VHC, en el que la actividad proteasa del dominio esta inhibida, asi como soportes de inmunoensayo que comprenden los polipeptidos. El documento W0 2004/005473 tambien divulga sustituciones de aminoacidos correspondientes a His-1083, Asp-1105 y/o Ser-1165, incluida la sustitucion de Ala por el aminoacido correspondiente a Ser-1165. El documento W0 01/96870 divulga un epitopo conformacional de NS3/4a que difiere de la secuencia nativa en las posiciones de aminoacidos 1428 y 1429 de la secuencia de longitud completa delVHC-1 en que la Thr que normalmente esta en la posicion 1428 ha mutado a Proy la Ser que normalmente esta en la posicion 1429 ha mutado a Ile. Este epitopo se usa en inmunoensayos para el diagnostico del VHC.
Sumario de la invención
La presente invencion se basa, en parte, en el descubrimiento de que el uso de los polipeptidos NS3 del VHC con dominios proteasa modificados proporciona reactivos mejores los para detectar infeccion por VHC. Los polipeptidos NS3 modificados conservan los epitopos conformacionalesy, por tanto, inmunorreactividad, al tiempo que eliminan la actividad proteasa. Dado que los polipeptidos NS3 estan modificados para eliminar la actividad proteasa, son especialmente utiles con otros polipeptidos del VHC que conservan sitios de escision proteolitica de NS· que, de otro modo, se escindirian proteoliticameente mediante una proteasa NS3 funcional. Por tanto, los polipeptidos de NS3 modificados el pueden usarse solos o en combinacion con otros reactivos del VHC y, en particular, con antigenos... [Seguir leyendo]
Reivindicaciones:
1. Un polipeptido aislado que comprende la secuencia deaminoacidos de la SEC ID Nº 2, 4 o 6, en el que el polipeptido comprende un epitopo conformacional de NS3.
2. Um soport e solid o p ara i nmunoensayo que c omprende un polipeptido d e la r eivindicacion 1 q ue re acciona especificamente con anticuerpos anti-VHC presentes en una muestra biologica de un individuo infectado por VHC.
3. El soporte solido de inmunoensayo de la reivindicacion 2, en el que el soporte solido comprende ademas un antigeno de fusion de multiples epitopos unido al soporte, en el que dicho polipeptido y/o dicho antigeno de fusion de multiples epitopos reacciona especificamente con anticuerpos anti-VHC presentes en una muestra biologica de un individuo infectado por VHC.
4. El soporte solido del inmunoensayo de la reivindicacion 3, en el que dichol antigeno de fusion de multiples epitopos c omprende l a sec uencia d e am inoacidos re presentada en l a SEC ID Nº 10 o una s ecuencia de aminoacidos con una identidad de secuencia de al menos 80 % que reacciona especificamente con anticuerpos anti-VHC presentes en una muestra biologica de un individuo infectado por VHC.
5. Un procedimiento de detectar infeccion por el virus de la hepatitis C (VHC) en una muestra biologica, en el que dicho procedimiento comprende:
(a) pro porcionar u n so porte soli do par a i nmunoensayo de acuerdo c on c ualquiera de c ualquiera de las reivindicaciones 2-4;
(b) combin ar una mu estra biol ogica con dicho so porte solid o en c ondiciones q ue permita n que l os anticuerpos anti-VHC, cuando estan presentes en la muestra biologica, se unan a dicho polipeptido y/o dicho antigeno de fusion de multiples epitopos para formar un primer complejo inmunitario;
(c) anadir al soporte solido de la etapa (b) en condiciones formadoras de complejo dicho anticuerpo marcado de forma que se pueda detectar, en el que el anticuerpo marcado reacciona con dicho complejo inmunitario;
(d) detectar un segundo complejo inmunitario formado entre el anticuerpo marcado de forma que se pueda detectar y el primer complejo inmunitario, si existe, como indicacion de infeccion por VHC en la muestra biologica.
6. Un kit de ensayo para inmunodiagnostico que comprende el soporte solido para inmunoensayo de cualquiera de las reivindicaciones 2-4 e instrucciones para realizar el ensayo inmunodiagnostico.
7. Un polinucleotido que comprende una secuencia codificadora para el polipeptido de la reivindicacion 1.
8. Un vector recombinante que comprende:
(a) un polinucleotido de acuerdo con la reivindicacion 7;
(b) y elementos control unidos operablemente a dichopolinucleotido de modo que la secuenciacodificadora se pueda transcribir y traducir en una celula huesped.
9. Una celula huesped transformada con el vector recombinante de la reivindicacion 8.
10. Un procedimiento para producir un polipeptido recombinante, que comprende:
(a) proporcionar una poblacion de celulas huesped de acuerdo con la reivindicacion 9; y
(b) cultivar dicha poblacion de celulas en condiciones mediante las cuales se expresa el polipeptido codificado por la secuencia codificadora presente en dicho vector recombinante.
11. Un procedimiento para producir un soporte solido para inmunoensayo, que comprende:
(a) proporcionar un soporte solido; y
(b) unir al soporte solido al menos un polipeptido de acuerdo con la reivindicacion 1.
12. El procedimiento de la reivindicacion 11, que comprende ademas unir al soporte solido en una posicion pequena un antigeno de fusion de multiples epitopos.
Patentes similares o relacionadas:
Procedimiento de pretratamiento para la detección rápida del antígeno central del VHC, del 8 de Abril de 2020, de F. HOFFMANN-LA ROCHE AG: Un procedimiento para detectar un polipéptido central de un virus de la hepatitis C (VHC) en una muestra de un sujeto que comprende (a) poner en contacto dicha muestra […]
Composiciones y métodos para detectar pegivirus humano 2 (HPGV-2), del 2 de Octubre de 2019, de ABBOTT LABORATORIES: Un método de detección de infección por Pegivirus 2 humano (HPgV-2) en un sujeto que comprende: a) poner en contacto una muestra de un sujeto que […]
Procedimientos de purificación de un virus producido in vitro y ensayo de eliminación del virus, del 14 de Mayo de 2019, de GRIFOLS, S.A: Procedimiento de purificación de un virus no envuelto o pseudoenvuelto propagado en un cultivo celular, comprendiendo el procedimiento una etapa de tratar una muestra que comprende […]
Ensayo multiplex para Hepatitis B, del 3 de Mayo de 2019, de BIO-RAD LABORATORIES, INC.: Un kit que comprende: (a) un primer receptáculo que comprende: (i) perlas que se conjugan con antígeno de superficie de Hepatitis B (HBsAg) de humano y marcador […]
Detección cuantitativa de anti-HBc para predecir el efecto terapéutico de pacientes con hepatitis B crónica, del 9 de Enero de 2019, de Xiamen University: Un procedimiento para predecir un efecto terapéutico antes de que un paciente con hepatitis B crónica acepte un tratamiento contra el virus de la hepatitis B, que comprende […]
Método de predicción de anemia en tratamientos con antivirales de acción directa, del 6 de Septiembre de 2018, de SERVICIO ANDALUZ DE SALUD: Método de predicción de anemia en tratamientos con antivirales de acción directa. La presente invención se refiere a un método basado en un modelo de […]
Método para analizar el antígeno s del virus de la hepatitis B, del 16 de Agosto de 2017, de ADVANCED LIFE SCIENCE INSTITUTE, INC.: Un método para analizar antígeno de superficie del virus de la hepatitis B (HBs), caracterizado por que usa como sondas de captura al menos una […]
Método no invasivo para evaluar la progresión de la fibrosis hepática, del 2 de Agosto de 2017, de UNIVERSITE D'ANGERS: Un método para evaluar la progresión de la fibrosis hepática en un individuo, en el que dicho método es no invasivo, lo que significa que no se toma ningún tejido […]