Método mejorado para la prevención de la contaminación cruzada en tecnologías de amplificación de ácidos nucleicos.
Método para disminuir la contaminación cruzada durante la amplificación mediante la reacción en cadenade la polimerasa (PCR) de un ácido nucleico,
que comprende las etapas de:
a. proporcionar una muestra de solución que contiene dicho ácido nucleico;
b. amplificar dicho ácido nucleico en presencia de un enzima que posee actividad ADN glicosilasapara generar ADN con al menos un sitio abásico;
c. proporcionar al menos un reactivo que facilite la degradación del ADN abásico, siendo dichoreactivo una poliamina;
d. incubar dicha solución muestra en condiciones adecuadas para provocar la degradación de dichoADN con al menos un sitio abásico.
Tipo: Patente Europea. Resumen de patente/invención. Número de Solicitud: E09008229.
Solicitante: F. HOFFMANN-LA ROCHE AG.
Nacionalidad solicitante: Suiza.
Dirección: GRENZACHERSTRASSE 124 4070 BASEL SUIZA.
Inventor/es: GUPTA, AMAR, WILL, STEPHEN GORDON, Bohenzky,Roy, Montiel,Janine.
Fecha de Publicación: .
Clasificación Internacional de Patentes:
- C12N9/24 QUIMICA; METALURGIA. › C12 BIOQUIMICA; CERVEZA; BEBIDAS ALCOHOLICAS; VINO; VINAGRE; MICROBIOLOGIA; ENZIMOLOGIA; TECNICAS DE MUTACION O DE GENETICA. › C12N MICROORGANISMOS O ENZIMAS; COMPOSICIONES QUE LOS CONTIENEN; PROPAGACION, CULTIVO O CONSERVACION DE MICROORGANISMOS; TECNICAS DE MUTACION O DE INGENIERIA GENETICA; MEDIOS DE CULTIVO (medios para ensayos microbiológicos C12Q 1/00). › C12N 9/00 Enzimas, p. ej. ligasas (6.); Proenzimas; Composiciones que las contienen (preparaciones para la limpieza de los dientes que contienen enzimas A61K 8/66, A61Q 11/00; preparaciones de uso médico que contienen enzimas A61K 38/43; composiciones detergentes que contienen enzimas C11D ); Procesos para preparar, activar, inhibir, separar o purificar enzimas. › actúan sobre compuestos glicosílicos (3.2).
- C12Q1/68 C12 […] › C12Q PROCESOS DE MEDIDA, INVESTIGACION O ANALISIS EN LOS QUE INTERVIENEN ENZIMAS, ÁCIDOS NUCLEICOS O MICROORGANISMOS (ensayos inmunológicos G01N 33/53 ); COMPOSICIONES O PAPELES REACTIVOS PARA ESTE FIN; PROCESOS PARA PREPARAR ESTAS COMPOSICIONES; PROCESOS DE CONTROL SENSIBLES A LAS CONDICIONES DEL MEDIO EN LOS PROCESOS MICROBIOLOGICOS O ENZIMOLOGICOS. › C12Q 1/00 Procesos de medida, investigación o análisis en los que intervienen enzimas, ácidos nucleicos o microorganismos (aparatos de medida, investigación o análisis con medios de medida o detección de las condiciones del medio, p. ej. contadores de colonias, C12M 1/34 ); Composiciones para este fin; Procesos para preparar estas composiciones. › en los que intervienen ácidos nucleicos.
PDF original: ES-2386023_T3.pdf
Fragmento de la descripción:
Metodo mejorado para la prevencion de la contaminacion cruzada en tecnologias de amplificacion de acidos nucleicos SECTOR TECNICO DE LA INVENCION La presente invencion se refiere de forma general a metodos de amplificacion de acidos nucleicos y de forma mas especifica, al control de la contaminacion cruzada durante la amplificacion de acidos nucleicos. ANTECEDENTES DE LA INVENCION La reaccion en cadena de la polimerasa (PCR) permite la amplificacion especifica de una cantidad tan pequefa como una (nica copia de una secuencia de acido nucleico diana. La alta sensibilidad y especificidad de la PCR han demostrado ser muy valiosas en el sector del diagnostico, del analisis forense y en otras aplicaciones en las que debe detectarse una pequefa cantidad de un ac ido nucleico diana. Desafortunadamente, la misma elevada sensibilidad de los ensayos de PCR los hace vulnerables a la contaminacion y a resultados positivos falsos. En el sector forense y en el cribado de enfermedades (como por ejemplo la determinacion de VIH) , los resultados positivos falsos pueden tener consecuencias devastadoras. El origen mas frecuente de resultados positivos falsos es la denominada "contaminacion cruzada", en la que un producto de PCR (amplicon) de un ensayo anterior contamina los ensayos de PCR siguientes. El contaminante puede ser transmitido por un tecnico, un instrumento o incluso por aerosoles. En una muestra "negativa", en la que el acido nucleico diana esta ausente, el contaminante genera un resultado positivo falso. En una muestra "positiva", en la que el acido nucleico diana esta presente, el contaminante es amplificado conjuntamente con la diana verdadera. Dicha amplificacion conjunta puede distorsionar el resultado de un ensayo cuantitativo, en el que debe determinarse la cantidad exacta de la diana verdadera. Una forma popular y efectiva de evitar la contaminacion cruzada supone la utilizacion de uracilo-ADN glicosilasas, especificamente UNG (EC 3.2.2.3) . Estos enzimas reconocen los uracilos presentes en el ADN de cadena (nica o doble y escinden el enlace N-glicosidico entre la base uracilo y la desoxirribosa, dejando un sitio sin base (abasico) . Ver, por ejemplo, la Patente n° 6.713.294. Ademas, las bases uracilo se escinden especificamente por uracilo-ADN glicosilasas generando sitios apirimidinicos susceptibles de la piperidina en la generacion de fragmentos de ADN escindidos (ver, por ejemplo, WO 02/090536 y WO 97/12061) . Las uracilo-ADN glicosilasas, abreviadas como "UDG"
o "UNG" incluyen la UNG1 mitocondrial, la UNG2 nuclear, la SMUG1 (uracilo-ADN glicosilasa selectiva de cadena (nica) , TDG (desajuste de timina ADN glicosilasa) , MBD4 (uracilo-ADN glicosilasa con un dominio de union de metilo) y otros enzimas eucariotas y procariotas (ver Krokan H.E. y otros "Uracil in DNA - occurrence, consequences and repair" ("Uracilo en el ADN - presencia, consecuencias y reparacion") , Oncogene (2002) 21:8935-9232) . Las uracilo-ADN glicosilasas son enzimas de reparacion del ADN que evitan, entre otras cosas, las mutaciones de transicion de G a A provocadas por la desaminacion de la citosina en uracilo. Si la citosina (C) es desaminada en uracilo (U) y el ADN se somete a replicacion, se incorpora una A opuesta al U, mientras que previamente habia una G opuesta a la C. Si la base uracilo es eliminada por la glicosilasa antes de la replicacion, el sitio abasico es reparado mediante una via de r eparacion del ADN con parche corto o l argo, que incluye las actividades endonucleasa y ADN polimerasa. Ademas de la reparacion de los dafos producidos en el ADN, la actividad ADN glicosilasa juega un papel en las mutaciones somaticas, incluyendo el cambio de clase de inmunoglobulinas y la hipermutacion somatica durante la maduracion de la afinidad de los anticuerpos. Ver Bransteitter R. y otros "First AID (Activation-induced cytidine deaminase) is needed to produce high affinity isotype-switched antibodies" ("En primer lugar se necesita la AID ("citidin desaminasa inducida por activacion) para producir anticuerpos de alta afinidad con cambio de isotipo") , J. Bio. Chem. (2007) 281:16833-16836. La preparacion de uracilo-N-AND-glicosilasa (UNG) optimizada para el control de la contaminacion cruzada en las reacciones de amplificacion se ha dado a conocer, por ejemplo, en la Patente U.S. n° 6.187.575. Tambien se ha descrito la utilizacion de UNG para evitar la contaminacion cruzada, ver Longo y otros "Use of uracil DNA glycosylase to control carr y -over contamination in polymerase chain reaction" ("Utilizacion de la uracilo ADN glicosilasa para controlar la contaminacion cruzada en l a reaccion en cadena de l a polimerasa") (1990) Gene, 93:125-128. El metodo del estado de la tecnica para controlar o disminuir el riesgo de contaminacion cruzada utilizando la UNG se describe en las patentes U.S. n° 6.287.823, 6.518.026 y la publicacion U.S. n° 2003/0077637, y en combinacion con la produccion de moleculas de acido nucleico sintetizadas in Vitro descrita en EP 1 041 159 y EP 1 038 974. En general, el metodo incluye dos etapas. En primer lugar, los ensayos de PCR deben incluir dUTP, de manera que los amplicones, que son potenciales contaminantes en la contaminacion cruzada, contienen uracilo. El metodo supone sustituir por dUTP algunos o todos los dTTP de la reaccion de amplificacion. Alternativamente (o adicionalmente) , pueden incorporarse uno o mas uracilos en los cebadores de amplificacion. Debe tenerse en cuenta, sin embargo, que s i un uracilo del cebador esta demasiado cerca del extremo 5', el metodo es menos eficiente para evitar su amplificacion subsiguiente. La utilizacion de dUTP no interfiere con los ensayos de PCR. Tras la generacion de un amplicon que contiene uracilo, este puede detectarse y analizarse mediante metodos estandar a pesar de la presencia de uracilo en lugar de timina.
A continuacion, se afade uracilo-N-ADN glicosilasa a la PCR subsiguiente. Convenientemente, UNG es activo en una mezcla de reaccion estandar que contiene todos los componentes de la PCR. Esto permite la adicion de UNG a reacciones de PCR ya montadas o incluso en la mezcla maestra de PCR. Previamente al inicio del ciclado termico, la mezcla de reaccion se incuba a una temperatura optima para la actividad UNG en el contexto de la mezcla maestra de PCR (aproximadamente 50°C) o dentro de un intervalo de temperaturas en el que la UNG es activa. Si existen contaminantes que contienen uracilo de una reaccion anterior, la UNG escindira el uracilo, dejando un sitio abasico. Se sabe que el ADN abasico es labil a temperaturas elevadas bajo condiciones de pH elevado. Cuando se inicia el ciclado termico, dicho ADN es degradado. La temperatura elevada tambien inhibe el enzima UNG, permitiendo la generacion de nuevos amplicones de ADN que contienen uracilo.
Tras el tratamiento con la UNG, el ADN abasico deber ser escindido eficientemente en los sitios abasicos. Si no se escinde, el ADN abasico act (a como molde para la polimerasa en la amplificacion subsiguiente. Por ejemplo, se sabe que la Taq ADN polimerasa omite los sitios abasicos incorporando una adenosina en el sitio opuesto a la base ausente. Una sola omision por parte de la polimerasa genera un moldeperfecto para la amplificacionsubsiguiente (ver Sikorsky, J.A. y otros, "DNA damage reduces Taq polymerase fidelityand PCR amplification efficiency" ("Los desperfectos en el ADN reducenla fidelidad y eficiencia en la amplificacion de la PCR de la polimerasa Taq") , Biochem. Biophys. Res. Commun. (2007) 355:431-437 o Kobayashi, A. y otros "Novel PCR-mediated mutagenesis employing DNA containing a natural abasic site as a template and translesional Taq DNA polymerase" ("Mutagenesis mediante PCR novedosa utilizando como molde ADN que contiene sitios naturales abasicos y Taq ADN polimerasa trans-lesional") , J. Biotech. (2005) 116:227-232) . Por lo tanto, la capacidad de escindir eficientemente el ADN en los sitios abasicos es esencial para el exito global del metodo basado en UNG para evitar la contaminacion cruzada.
RESUMEN DE LA INVENCION
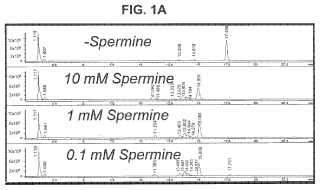
La pr esente i nvencion incluye un m etodo de co ntrol m ejorado de l a co ntaminacion cr uzada ut ilizando A DN glicosilasa. Los inventores han determinado que el factor limitante en la eliminacion exitosa del contaminante de la contaminacion cruzada es la degradacion eficiente del ADN abasico. La opinion aceptada es que la etapa limitante es la digestion enzimatica para generar ADN abasico. Se consideraba que la etapa subsiguiente de degradacion no enzimatica del ADN abasico era sencilla, eficiente y sin necesidad de mejoras. Los esfuerzos previos para mejorar los metodos de co ntrol de l a c ontaminacion s e h an c entrado e n l a adi cion d e mas enzima glicosilasa para incrementar los tiempos de incubacion. Los inventores han descubierto que al contrario de la opinion aceptada,... [Seguir leyendo]
Reivindicaciones:
1. Metodo para disminuir la contaminacion cruzada durante la amplificacion mediante la reaccion en cadena de la polimerasa (PCR) de un acido nucleico, que comprende las etapas de:
a. proporcionar una muestra de solucion que contiene dicho acido nucleico;
b. amplificar dicho acido nucleico en presencia de un enzima que posee actividad ADN glicosilasa para generar ADN con al menos un sitio abasico;
c. proporcionar al menos un reactivo que facilite la degradacion del ADN abasico, siendo dicho reactivo una poliamina;
d. incubar dicha solucion muestra en condiciones adecuadas para provocar la degradacion de dicho ADN con al menos un sitio abasico
2. Metodo, seg (n la reivindicacion 1, en el que dicha actividad glicosilasa es la actividad uracilo-N-ADN glicosilasa.
3. Metodo, seg (n la reivindicacion 1, en el que dicha poliamina en una poliamina intercaladora.
4. Metodo, seg (n la reivindicacion 1, en el que dicha poliamina se selecciona del grupo formado por espermidina, espermina, trietilentetramina y trimetilendiamina.
5. Mezcla de reaccion para evitar la contaminacion cruzada durante la amplificacion mediante la reaccion en cadena de la polimerasa (PCR) de un acido nucleico, que comprende:
reactivos (tiles para la amplificacion de acidos nucleicos, incluyendo dichos reactivos uno o m as oligonucleotidos cebadores, una polimerasa de acidos nucleicos, tampones, sales y nucleosidos trifosfato incluyendo dATP, dCTP, dGTP y uno o mas entre dTTP y dUTP, un reactivo adecuado para generar ADN con al menos un sitio abasico y un reactivo que facilita la degradacion del ADN abasico, poseyendo dicho reactivo adecuado para generar ADN con al menos un sitio abasico actividad uracilo-N-ADN glicosilasa y dicho reactivo que facilita la degradacion del ADN abasico una poliamina.
6. Mezcla de reaccion seg (n la reivindicacion 5, en la que dicho reactivo adecuado, para generar ADN con al menos un sitio abasico, es un enzima.
7. Kit para llevar a cabo un metodo de prevencion de la contaminacion cruzada durante la amplificacion mediante la reaccion en cadena de la polimerasa (PCR) de un acido nucleico, que comprende:
a. un reactivo que posee actividad ADN glicosilasa,
b. un reactivo capaz de degradar el ADN abasico, siendo dicho reactivo una poliamina, y
c. reactivo (tiles para amplificar acidos nucleicos, incluyendo dichos reactivos (tiles para amplificar acidos nucleicos uno o mas oligonucleotidos cebadores, una polimerasa de acidos nucleicos, tampones, sales, y nucleosidos trifosfato incluyendo dATP, dCTP, dGTP y uno o mas entre dTTP y dUTP.
Patentes similares o relacionadas:
Método para analizar ácido nucleico molde, método para analizar sustancia objetivo, kit de análisis para ácido nucleico molde o sustancia objetivo y analizador para ácido nucleico molde o sustancia objetivo, del 29 de Julio de 2020, de Kabushiki Kaisha DNAFORM: Un método para analizar un ácido nucleico molde, que comprende las etapas de: fraccionar una muestra que comprende un ácido nucleico molde […]
MÉTODOS PARA EL DIAGNÓSTICO DE ENFERMOS ATÓPICOS SENSIBLES A COMPONENTES ALERGÉNICOS DEL POLEN DE OLEA EUROPAEA (OLIVO), del 23 de Julio de 2020, de SERVICIO ANDALUZ DE SALUD: Biomarcadores y método para el diagnostico, estratificación, seguimiento y pronostico de la evolución de la enfermedad alérgica a polen del olivo, kit […]
Detección de interacciones proteína a proteína, del 15 de Julio de 2020, de THE GOVERNING COUNCIL OF THE UNIVERSITY OF TORONTO: Un método para medir cuantitativamente la fuerza y la afinidad de una interacción entre una primera proteína de membrana o parte de la misma y una […]
Secuenciación dirigida y filtrado de UID, del 15 de Julio de 2020, de F. HOFFMANN-LA ROCHE AG: Un procedimiento para generar una biblioteca de polinucleótidos que comprende: (a) generar una primera secuencia del complemento (CS) de un polinucleótido diana a partir […]
Métodos para la recopilación, estabilización y conservación de muestras, del 8 de Julio de 2020, de Drawbridge Health, Inc: Un método para estabilizar uno o más componentes biológicos de una muestra biológica de un sujeto, comprendiendo el método obtener un […]
Evento de maíz DP-004114-3 y métodos para la detección del mismo, del 1 de Julio de 2020, de PIONEER HI-BRED INTERNATIONAL, INC.: Un amplicón que consiste en la secuencia de ácido nucleico de la SEQ ID NO: 32 o el complemento de longitud completa del mismo.
Composiciones para modular la expresión de SOD-1, del 24 de Junio de 2020, de Biogen MA Inc: Un compuesto antisentido según la siguiente fórmula: mCes Aeo Ges Geo Aes Tds Ads mCds Ads Tds Tds Tds mCds Tds Ads mCeo Aes Geo mCes Te (secuencia […]
Aislamiento de ácidos nucleicos, del 24 de Junio de 2020, de REVOLUGEN LIMITED: Un método de aislamiento de ácidos nucleicos que comprenden ADN de material biológico, comprendiendo el método las etapas que consisten en: (i) efectuar un lisado […]