"Procedimiento para isomerizar c-22 iodovinilderivados por fotoisomerización".
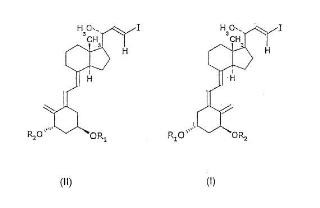
Procedimiento para isomerizar compuestos de estructura general (II) a compuestos de estructura general (1),
donde R1 y R2 representan hidrogeno o un grupo protector de hidroxilo, que comprende una fotoisomerización del compuesto de estructura general (II) con una lámpara UV, con un volumen de reacción comprendido entre 50 ml y 500 ml, a una temperatura comprendida entre -15ºC y 45ºC, y con unos tiempos de reacción comprendidos entre 0,5 minutos y 20 minutos.
Tipo: Patente de Invención. Resumen de patente/invención. Número de Solicitud: P201031980.
Solicitante: LABORATORIOS VIÑAS, S.A..
Nacionalidad solicitante: España.
Inventor/es: BUXADE VIÑAS,ANTONIO, CONCHILLO TERUEL,ANTONIO, MOLA SOLER,CARLOS.
Fecha de Publicación: .
Clasificación Internacional de Patentes:
- C07B55/00 QUIMICA; METALURGIA. › C07 QUIMICA ORGANICA. › C07B PROCESOS GENERALES DE QUIMICA ORGANICA; SUS APARATOS (preparación de ésteres de ácidos carboxílicos por telomerización C07C 67/47; procesos para la preparación de compuestos macromoleculares, p.ej. telomerzación C08F, C08G). › Racemización; Inversión completa o parcial.
- C07C401/00 C07 […] › C07C COMPUESTOS ACICLICOS O CARBOCICLICOS (compuestos macromoleculares C08; producción de compuestos orgánicos por electrolisiso electroforesis C25B 3/00, C25B 7/00). › Productos de irradiación del colesterol o de sus derivados; Derivados de la vitamina D, 9,10-seco ciclopenta[a]fenantreno o sus análogos obtenidos por preparación química sin irradiación.
Fragmento de la descripción:
Procedimiento para isomerizar c-22 iodovinilderivados por fotoisomerización.
Campo de la Técnica La presente invención se refiere a un procedimiento mejorado para la obtención de derivados de (5Z, 7E, 22E) -23Iodo-9, 10-secocola-5, 7, 10 (19) , 22-trieno (I) a partir de los correspondientes derivados de (5E, 7E, 22E) -23-Iodo-9, 10secocola-5, 7, 10 (19) , 22-trieno (II) , mediante un proceso fotoquímico en “microbatch”.
Estado de la Técnica
Los C-22 Iodovinilderivados (I y II) son intermedios muy útiles en la síntesis de importantes medicamentos para el tratamiento de la psoriasis, tales como el Tacalcitol (IIIa) y el Calcipotriol (IVa) ; como se describe en el documento ES P200302806.
Tacalcitol (IIIa) Calcipotriol (IVa)
Los intermedios Iodovinílicos (II) se obtienen a partir de los aductos de SO2 correspondientes (V) tal como se describe en el documento PCT/ES2004/000511, mediante una reacción de desprotección que conduce al isómero trans 5E (II) , sin apenas formación del isómero cis 5Z (I) . Como la actividad biológica y curativa se manifiesta preferentemente en los isómeros cis (5Z) , tal como puede deducirse de IIIa y de IVa, en algún punto de la ruta sintética que va de los compuestos (II) a los compuestos (III) y (IV) será necesario realizar la isomerización del doble enlace 5E al 5Z.
El punto más habitual para realizar dicha isomerización es la conversión de los compuestos de tipo (VI) o (VII) en compuestos de tipo (III) o (IV) . Los compuestos (VI) o (VII) se obtienen a partir de compuestos (II) , tal como se detalla en el documento ES P200302875 o bien, a partir de otros intermedios no halogenados como puede ser (VIII) , según el documento WO 87/00834.
No obstante, los compuestos de tipo (III) y (IV) se pueden obtener por una vía más directa, si se utilizan Iodovinilderivados de tipo (I) . En este último caso, será necesario realizar la transformación de los compuestos de tipo (II) en compuestos de tipo (I) . Una reacción fotoquímica para realizar este proceso se describe en el documento PCT/ES2004/000511, pero el rendimiento en producto isomerizado no pasa del 50%, recuperándose el 22% del producto inicial (Esquema 1) .
Esquema 1:
Reactivos:
a: " (60 ºC)
b: hv
c: t-BuLi/ Ciclopropanoaldehído d: NaBH4/CeCl3
e: hv
La reacción fotoquímica descrita en dicha patente se realiza en modo “Batch” (por lotes) , con un método que puede escalarse a lotes de mayor tamaño aumentando simplemente el volumen a irradiar y la potencia de la lámpara.
Pero los autores de la presente invención han encontrado que los rendimientos fotoquímicos de la anterior reacción decrecen con el aumento del volumen a irradiar, acabando algunas reacciones en un equilibrio fotoquímico de Isómero trans/ Isómero cis = 2/1. Estos resultados implican que una producción industrial de Iodovinilderivados cis mediante este procedimiento está muy desfavorecida.
Los autores de la presente invención consideran que los bajos rendimientos de este tipo de reacciones fotoquímicas es debido a una segunda reacción fotoquímica que se da en paralelo a la primera, que va en sentido contrario (de Cis a Trans) y es catalizada por trazas de Yodo (en Verloop, A; Koevoet, A; Havinga, E; Recl. Trav. Chim. 74, 1125 (1955) se describe una isomerización de trans-Vitamina D2 catalizada por Yodo) .
Por otra parte, al ser la reacción en “Batch” toda la masa está siendo irradiada durante todo el tiempo que dura la conversión. Si se producen trazas de I2 por degradación de los Iododerivados, entonces la luz y el I2 catalizan la conversión inversa (de Cis a Trans) y por eso, los rendimientos son moderados, siempre inferiores a los que se obtienen cuando la reacción fotoquímica se realiza con moléculas que no contienen Yodo en su estructura. Cuanta más cantidad de Iodovinilderivado se fotoisomeriza, más tiempo dura la reacción y en este caso fácilmente se producen trazas de Yodo, que a su vez catalizan la reacción contraria. De esta manera, se llega a una especie de fotoequilibrio con proporciones variables de una reacción a otra, de los dos isómeros 5Z/5E.
Y de ahí, la necesidad de disponer de un método para una producción industrial de (5Z, 7E, 22E) -23-Iodo-9, 10secocola-5, 7, 10 (19) , 22-trienos (I) con rendimientos elevados y reproducibles. Un método que permitiera realizar la fotoisomerización muy rápidamente, evitaría la formación de Yodo y sería altamente ventajoso para obtener el isómero 5Z con buenos rendimientos.
En J. Org. Chem. 2005, 70, 7558-7564 se describe un reactor para realizar reacciones fotoquímicas en continuo, para la fotocicloadición de maleimidas. Consta básicamente de un tubo de teflón enrollado alrededor del cuerpo del refrigerante de la lámpara fotoquímica. La solución a fotoisomerizar circula por el tubo de teflón impulsado por una bomba. Graduando el flujo se modula la velocidad de reacción. El sistema es de construcción extremadamente simple, pero tiene la desventaja de que el teflón tiene una transmitancia entre el 50-75% a longitudes de onda comprendidas entre 220 y 350 nm. Esto obliga a tener la espiral de teflón lo más cerca posible de la lámpara fotoquímica, sino la reacción se va ralentizando. Para esta reacción en particular, el teflón puede ayudar a que se absorban longitudes de onda indeseables para dicha reacción. Pero para la reacción objeto de la presente invención es necesario tener la máxima transmitancia alrededor de 350 nm, para poder realizar la reacción rápidamente y así evitar la formación de Yodo, que catalizaría la reacción inversa a la deseada.
En el documento WO 2007/082533 se describe una reacción fotoquímica para la conversión de derivados de tipo (VII) en derivados de tipo (IV) , empleando un fotoreactor de “Flow-throught” o “continuous flow”, el cual es útil para producciones en gran escala. La solución a fotoisomerizar circula por un cilindro que soporta en su parte central la lámpara fotoquímica con su dispositivo refrigerante. La solución circula impulsada también por una bomba y la solución fotoisomerizada se devuelve al depósito de donde ha sido aspirada por la bomba. Este sistema recirculatorio se mantiene hasta que un análisis de la solución contenida en el depósito muestre que la reacción ha terminado. Pero para la reacción objeto de la presente invención, este sistema fotoquímico tampoco es adecuado, ya que la solución se irradia varias veces, con lo que el peligro de formación de trazas de Yodo aumenta considerablemente.
De lo expuesto anteriormente, se deduce que se necesita un sistema fotoquímico que permita realizar la transformación de los Iodovinilderivados Trans (5E) (II) en los Iodovinilderivados Cis (5Z) (I) , a una velocidad suficientemente rápida para minimizar la formación de trazas de Yodo, el cual cataliza la reacción contraria.
Objeto de la presente invención La presente invención describe un procedimiento, para la fotoisomerización de (5E, 7E, 22E) -23-Iodo-9, 10-secocola5, 7, 10 (19) , 22-trienos (Trans) de estructura general (II) a sus correspondientes 5Z, 7E, 22E) -23-Iodo-9, 10-secocola5, 7, 10 (19) , 22-trienos (Cis) de estructura general (I) , donde R1 y R2 representan hidrogeno o un grupo protector de hidroxilo, caracterizado porque comprende una fotoisomerización del compuesto de estructura general (II) con una lámpara UV, con un volumen de reacción comprendido entre 50 ml y 500 ml, a una temperatura comprendida entre 15ºC y 45ºC, y con unos tiempos de reacción comprendidos entre 0, 5 minutos y 20 minutos. Este nuevo procedimiento permite obtener rendimientos superiores a los previamente descritos. Los autores de la presente invención han encontrado sorprendentemente que los isómeros 5Z de estructura general (I) pueden obtenerse con rendimientos superiores a los previamente descritos, utilizando un proceso fotoquímico en lotes muy pequeños (“Microbatch”) . De esta forma se reduce el tiempo de exposición a la radiación UV, lo que permite minimizar la reacción contraria catalizada por Yodo, aumentando los rendimientos y la pureza del producto final. Por otra parte, el sistema puede funcionar con una lámpara de UV convencional.
Preferentemente el compuesto de estructura general (II) es (5E, 7E, 22E) -23-Iodo-9, 10-secocola-5, 7, 10 (19) , 225 trieno-1a, 3º-diol y el compuesto de estructura general (I) es (5Z, 7E, 22E) -23-Iodo-9, 10-secocola-5,...
Reivindicaciones:
1. Procedimiento para isomerizar compuestos de estructura general (II) a compuestos de estructura general (I) , donde R1 y R2 representan hidrogeno o un grupo protector de hidroxilo, caracterizado porque comprende una fotoisomerización del compuesto de estructura general (II) con una lámpara UV, con un volumen de reacción comprendido entre 50 ml y 500 ml, a una temperatura comprendida entre -15ºC y 45ºC, y con unos tiempos de reacción comprendidos entre 0, 5 minutos y 20 minutos.
2. Procedimiento según la reivindicación 1, caracterizado porque el compuesto de estructura general (II) es (5E, 7E, 22E) -23-Iodo-9, 10-secocola-5, 7, 10 (19) , 22-trieno-1a, 3º-diol y porque el compuesto de estructura general (I) es (5Z, 7E, 22E) -23-Iodo-9, 10-secocola-5, 7, 10 (19) , 22-trieno-1a, 3º -diol (Ia) .
3. Procedimiento según la reivindicación 1, caracterizado porque el compuesto de estructura general (II) es (5E, 7E, 22E) -23-Iodo-1a, 3º-bis (R’, R’’, R’’’) -sililoxi) - 9, 10-secocola-5, 7, 10 (19) , 22-trieno, donde R1=R2= (R’, R’’, R’’’) -Si, donde R’, R’’ y R’’’ se seleccionan independientemente entre hidrógeno, un grupo alquilo substituido o no o un grupo aromático, substituido o no, y porque el compuesto de estructura general (I) es (5Z, 7E, 22E) -23-Iodo-1a, 3bis (R’, R’’, R’’’) - (sililoxi) -9, 10-secocola-5, 7, 10 (19) , 22-trieno.
4. Procedimiento según la reivindicación 1, caracterizado porque el compuesto de estructura general (II) es (5E, 7E, 22E) -1a, 3º-bis (R’-carboniloxi) .
2. Iodo- 9, 10-secocola-5, 7, 10 (19) , 22-trieno, donde R1=R2=R’CO) , donde R’ se selecciona entre hidrógeno, un grupo alquilo substituido o no o un grupo aromático, substituido o no, y porque el compuesto de estructura general (I) es (5Z, 7E, 22E) -1a, 3 -bis (R1-carboniloxi) -23-Iodo-9, 10-secocola-5, 7, 10 (19) , 22trieno.
– Procedimiento según la reivindicación 3 en que R’, R’’ y R’’’ se seleccionan independientemente entre hidrógeno, grupos alquilo, lineales o ramificados, con un máximo de 8 carbonos, fenilo, y grupos fenilo sustituidos con al menos uno de los sustituyentes metilo, etilo, propilo y ter-butilo.
6. Procedimiento según la reivindicación 4 en que R’ se selecciona entre hidrógeno, grupos alquilo, lineales o ramificados, con un máximo de 8 carbonos, fenilo, y grupos fenilo sustituidos con al menos uno de los sustituyentes metilo, etilo, propilo y ter-butilo.
7. Procedimiento según la reivindicación 5 en que R’=R’’= Me y R’’’=tert-Butil (Ib) .
8. Procedimiento según la reivindicación 6 en que R’=Me (Ic) .
9. Procedimiento según cualquiera de las reivindicaciones 1 a 8, caracterizado porque la fotoisomerización se hace en presencia de un fotocatalizador sensibilizador de triplete en el intervalo de 30 a 80 Kcal/mol.
– Procedimiento según la reivindicación 9, caracterizado porque dicho fotocatalizador posee una energía entre 41 y 45 Kcal/mol) .
11 – Procedimiento según la reivindicación 9, caracterizado porque el fotocatalizador se selecciona de entre el siguiente grupo: Antraceno, 9-Acetilantraceno, 9-Metilantraceno y ácido 9-Antracencarboxílico.
12. Procedimiento según cualquiera de las reivindicaciones 1 a 11, caracterizado porque se realiza en un fotoreactor que tiene un volumen entre 50 mm y 200 ml, preferentemente de 100 ml, y una lámpara entre 100 W y 200 W, preferentemente 150 W.
13. Procedimiento según cualquiera de las reivindicaciones 1 a 11, caracterizado porque se realiza en un fotoreactor que tiene un volumen entre 200 ml y 600 ml, preferentemente 500 ml y una lámpara de 500 W a 1000 W, preferentemente 700 W.
14. Procedimiento según cualquiera de las reivindicaciones 1 a 13, caracterizado porque se realiza en un fotoreactor en el cual el dispositivo refrigerante de la lámpara es de vidrio borosilicato 3.3 (DIN/ISO 3585) .
- Procedimiento según cualquiera de las reivindicaciones 1 a 14, caracterizado porque la lámpara para efectuar la isomerización es una lámpara de mercurio de media presión, dopada con Talio.
16. Procedimiento según cualquiera de las reivindicaciones 1 a 15, caracterizado porque la lámpara tiene un máximo de intensidad entre 300 y 400 nm.
17. Procedimiento según cualquiera de las reivindicaciones 1 a 16, caracterizado porque la reacción de fotoisomerización se realiza a una temperatura comprendida entre 10 ºC y 25 ºC.
18. Procedimiento según cualquiera de las reivindicaciones 1 a 17, caracterizado porque la reacción de fotoisomerización transcurre durante un tiempo comprendido entre 5 y 15 minutos.
19 – Procedimiento según cualquiera de las reivindicaciones 1 a 18, caracterizado porque dicho compuesto de estructura general (II) está diluido en un disolvente orgánico o una mezcla de disolventes orgánicos.
- Procedimiento según la reivindicación 19, caracterizado porque dicho disolvente orgánico es del grupo formado por éteres, alcoholes, hidrocarburos alifáticos, hidrocarburos aromáticos e hidrocarburos aromáticos.
21 – Procedimiento según una de las reivindicaciones 19 ó 20, caracterizado porque dicho disolvente orgánico es un disolvente del grupo formado por Metanol, Etanol, Isopropanol, tert-Butilmetileter, Tetrahidrofurano, Diclorometano, Fluorobenceno, Hexano, Heptano, Tolueno y mezclas de los anteriores.
22 – Procedimiento según cualquiera de las reivindicaciones 19 a 21, caracterizado porque la concentración de dicho compuesto de estructura general (II) en dicho disolvente está comprendida entre 0, 001 gr/ml y 0, 030 gr/ml.
23 – Procedimiento según la reivindicación 22, caracterizado porque la concentración de dicho compuesto de estructura general (II) en dicho disolvente está comprendida entre 0, 0075 y 0, 0125 gr/ml.
Patentes similares o relacionadas:
PROCEDIMIENTO PARA LA CONVERSIÓN ENANTIOMÉRICA DE INTERMEDIOS DE CALCIPOTRIOL Y USO CORRESPONDIENTE, del 29 de Junio de 2020, de LABORATORIOS VIÑAS, S.A.: Procedimiento para la conversión enantiomérica de intermedios de calcipotriol y uso correspondiente. Procedimiento para convertir un epímero […]
COMPUESTOS DERIVADOS DE LA VITAMINA D, del 11 de Mayo de 2020, de UNIVERSIDADE DE SANTIAGO DE COMPOSTELA: Compuestos derivados de la vitamina D. La presente invención se refiere a compuestos derivados de vitamina D. Más en concreto, se refiere a derivados complejos de la vitamina […]
COMPUESTOS DE LA VITAMINA D CON MARCAJE ISOTÓPICO, del 12 de Marzo de 2020, de UNIVERSIDADE DE SANTIAGO DE COMPOSTELA: Compuestos de la vitamina D con marcaje isotópico. La invención se dirige a compuestos de fórmula I caracterizados por ser derivados de las vitaminas […]
Método de fabricación de 7-deshidrocolesterol y vitamina D3, del 4 de Diciembre de 2019, de KYOWA HAKKO BIO CO., LTD: Procedimiento para producir 7-deshidrocolesterol, 7DHC, que comprende: cultivar, en un medio, un microorganismo de Labyrinthulea que produce 7DHC en el […]
Procedimiento para producir 7-deshidrocolesterol y vitamina D3, del 27 de Noviembre de 2019, de KYOWA HAKKO BIO CO., LTD: Procedimiento para producir 7-deshidrocolesterol (en adelante, "7DHC"), que comprende: cultivar, en un medio, un microorganismo de Labyrinthulea que produce 7DHC en el que […]
Compuestos de interés farmacéutico, del 15 de Noviembre de 2019, de UNIVERSIDADE DE SANTIAGO DE COMPOSTELA: Compuestos de interés farmacéutico. La presente invención se dirige compuestos de interés farmacéutico. Más en particular, se dirige a los compuestos de fórmula […]
1,25-Dihidroxivitamina D2 estabilizada y método de preparación de la misma, del 9 de Octubre de 2019, de OPKO Ireland Global Holdings, Limited: Una composición de 1,25-dihidroxivitamina D2, caracterizada por que está exenta de disolventes de éster de formiato, incluyendo que está exenta […]
 Inhibidores de SHIP y uso de los mismos, del 31 de Julio de 2019, de THE RESEARCH FOUNDATION OF THE STATE UNIVERSITY OF NEW YORK: Una composición farmacéutica que comprende:
un compuesto inhibidor de SHIP de fórmula (I), o una sal farmacéuticamente aceptable del […]
Inhibidores de SHIP y uso de los mismos, del 31 de Julio de 2019, de THE RESEARCH FOUNDATION OF THE STATE UNIVERSITY OF NEW YORK: Una composición farmacéutica que comprende:
un compuesto inhibidor de SHIP de fórmula (I), o una sal farmacéuticamente aceptable del […]