Proceso industrial para obtener intermedios aptos para la síntesis de análogos de Vitamina D.
Proceso industrial para obtener intermedios aptos para la síntesis de análogos de vitamina D caracterizado porque comprende una etapa de reducción donde la reacción de reducción se realiza de manera continúa en un microreactor.
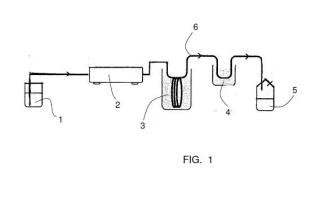
El microreactor tiene un matraz de alimentación (1), una bomba peristáltica (2), un baño termostatizado (3), un baño refrigerante (4), un reactor de recogida (5), y un tubo de politetrafluoroetileno (6).
Tipo: Patente de Invención. Resumen de patente/invención. Número de Solicitud: P201132158.
Solicitante: LABORATORIOS VIÑAS, S.A..
Nacionalidad solicitante: España.
Inventor/es: BUXADE VIÑAS,ANTONIO, CONCHILLO TERUEL,ANTONIO, MOLA SOLER,CARLOS.
Fecha de Publicación: .
Clasificación Internacional de Patentes:
- A61K31/59 NECESIDADES CORRIENTES DE LA VIDA. › A61 CIENCIAS MEDICAS O VETERINARIAS; HIGIENE. › A61K PREPARACIONES DE USO MEDICO, DENTAL O PARA EL ASEO (dispositivos o métodos especialmente concebidos para conferir a los productos farmacéuticos una forma física o de administración particular A61J 3/00; aspectos químicos o utilización de substancias químicas para, la desodorización del aire, la desinfección o la esterilización, vendas, apósitos, almohadillas absorbentes o de los artículos para su realización A61L; composiciones a base de jabón C11D). › A61K 31/00 Preparaciones medicinales que contienen ingredientes orgánicos activos. › Compuestos que contienen el sistema cíclico del 9,10-seco-ciclopenta[a]hidrofenantreno.
- C07C401/00 QUIMICA; METALURGIA. › C07 QUIMICA ORGANICA. › C07C COMPUESTOS ACICLICOS O CARBOCICLICOS (compuestos macromoleculares C08; producción de compuestos orgánicos por electrolisiso electroforesis C25B 3/00, C25B 7/00). › Productos de irradiación del colesterol o de sus derivados; Derivados de la vitamina D, 9,10-seco ciclopenta[a]fenantreno o sus análogos obtenidos por preparación química sin irradiación.
Fragmento de la descripción:
Campo de la Técnica La presente invención trata de una producción industrial de intermedios clave para la síntesis del Calcipotriol: ( (5Z, 7E, 22E, 24S) -24-ciclopropil-9, 10-secocola
5, 7, 10 (19) , 22-tetraen-1a-3º-24-triol) (I) (también denominado 20 (R) - (3´ (S) Ciclopropil-3´-hidroxiprop-1´- (E) -enil) -1 (S) , 3 (R) -dihidroxi-9, 10-secopregna5 (Z) , 7 (E) , 10 (19) -trieno) . Dicho proceso industrial incluye varias etapas, tres de las cuales se realizan en microreactores de flujo continuo.
Calcipotriol (I)
Estado de la Técnica El Calcipotriol (I) es un principio activo para el tratamiento de la psoriasis (D. M. Ashcroft et al.; Brit. Med. J.; 320, 963 (2000) . Se han desarrollado diversas síntesis para obtener el Calcipotriol, la mayoría de las cuales parten de un intermedio común: SO2-aductos de 1 (S) , 3 (R) -Bis (tert-butildimetilsililoxi-20 (S) -formil-9, 10
secopregna-5, 7 (E) , 10 (19) -triene (II) .
La síntesis reivindicada en WO 87/00834 transcurre través de la enona (III) , obtenida a partir de (II) mediante una reacción de Wittig. La posterior reducción con NaBH4/CeCl3 conducía al intermedio (IV) , que después de una fotoisomerización para dar (V) , se convertía en Calcipotriol (I) mediante desprotección de los grupos sililo.
(II) (III)
(IV) (V)
Esta línea sintética presenta varios problemas, especialmente en el escalado para una producción industrial. Por ejemplo, para solventar la baja reactividad del fosforano que reacciona con (II) y posterior eliminación del oxido de trifenilfosfina (que es el subproducto de la reacción) , se han utilizado otros reactivos de fósforo 5 como fosfonatos: WO 2005/087719 y WO 2005/095336. Otro inconveniente de esta ruta es que la reducción de la enona produce los alcoholes diastereomericos en C24, 24R y 24S, con mayor proporción del isómero 24R (24R/24S = 60/40 en caso de utilizar NaBH4 /CeCl3 ) , que es el isómero de configuración contraria a la del Calcipotriol en dicho carbono. Un problema asociado al reactivo anterior es la gran 10 cantidad de metales pesados que se generan de residuo al escalar industrialmente la síntesis. Este problema se ha solventado aumentando la proporción de isómero 24S mediante el uso de reductores quirales, por ejemplo, utilizando indanol/dietilanilinoborano (WO 2005/087719) , pero el borano que no se compleja con el indanol tiende a reducir o adicionarse a los dobles enlaces del susbtrato, 15 disminuyendo los rendimientos. Nuevamente, este problema se ha solventado protegiendo los dobles enlaces de la enona a reducir mediante la formación de los correspondientes aductos con SO2 (WO 2005/095336) , en cuyo caso se obtiene una proporción de alcoholes (IV) 24S/24R: 3/1, una vez reducido y desprotegido (VI) . Pero los reactivos quirales son caros, siendo esta cuestión importante cuando 20 se aborda una producción en gran escala, además de implicar los pasos de protección y desprotección adicionales.
(VI)
La vía sintética que se expone en ES P200302875 parte de los Iodovinilderivados (VII) , los cuales, por reacción con t-butil-litio/ciclopropanoaldehído rinden los correspondientes alcoholes 24S/24R en la proporción 1/1, siendo la proporción de isómero 24S algo inferior que en el anterior proceso, pero con la ventaja de no tener
que proteger el sistema de dobles enlaces de la molécula. El proceso anterior es escalable industrialmente, pero presenta el inconveniente de necesitarse un reactivo también caro y generador de metales pesados (CrCl3) en la síntesis de los Iodovinilderivados intermedios (VII) a partir de (II) . Además, es necesario eliminar 10 todas las trazas de iodo y/o iododerivados, pues su presencia promueve reacciones colaterales indeseables.
(VII a) (VII b)
Otra vía sintética que se expone en ES P200302875 se refiere a la reducción del
triple enlace en C-22/C-23 de los alcoholes propargílicos (VIII, IX) a los correspondientes alcoholes alílicos (IV, V) con LiALH4/MeONa o bis (2metoxietoxi) aluminiohidruro de sodio.
(VIII) (IX)
Los alcoholes propargílicos se han obtenido mediante reducción de las correspondientes cetonas con reactivos quirales ( (+) -DIP-Cl con 24S/24R: 59/23, 8 (ES P200302875) o Alpine-Borane con 24S/24R: 90/10 (Biororganic & Medical 10 Chemistr y Letters, vol 3, 1841-1844 (1993) ) . En este segundo caso, la reducción es difícilmente escalable, dada la dificultad de agitación de la masa pastosa que se forma y a la tendencia del borano formado por desproporción del Alpine-Borane a reaccionar con los dobles enlaces del substrato. Esta vía de reducción del triple enlace, bastante atractiva económicamente, tiene como principal “handicap”, a la 15 hora de escalarla industrialmente, la misma reducción del triple enlace. Una vez se ha reducido el alcohol propargílico, la reacción hay que pararla rápidamente, ya sea enfriando o añadiendo agua, ya que el reactivo tiende a producir sobrereducción de los dobles enlaces existentes. A escala de laboratorio la parada de reacción no presenta ningún problema, pero a nivel industrial es mucho más difícil y peligroso,
ya que la velocidad de enfriamiento es muy lenta y la adición de agua es peligrosa, puesto que la reacción contiene hidruros metálicos y se produce desprendimiento de hidrógeno.
Finalmente, los alcoholes alílicos con configuración trans en C-5, obtenidos por cualquiera de los procesos anteriormente descritos, se han isomerizado a los correspondientes alcoholes alílicos cis en C-5 mediante una reacción fotoquímica (Tetrahedron, vol 43, nº 20, 4609 (1987) y Biororganic & Medical Chemistr y Letters,
vol 3, 1841-1844 (1993) ) .También se ha ideado un proceso para realizar la fotoisomerización a escala industrial de estos intermedios de Vitamina D (WO 2007/082533) .
De lo expuesto anteriormente se deduce que, aunque la obtención de los intermedios de la síntesis del Calcipotriol está bien resuelta a nivel de laboratorio, aún se necesitan procesos mejorados para el escalado y posterior producción de dichos intermedios a nivel industrial, basándose en procesos más económicos y en procesos que generen menos residuos y/o menos tóxicos para el medio ambiente.
Objeto de la presente invención (VIII) (IX)
Los autores de la presente invención, durante las investigaciones para el escalado de la reducción del triple enlace de los alcoholes propargílicos (VIII y IX) según el esquema siguiente:
(IX) (V) (o bien partiendo de (VIII) para dar (IV) )
han descubierto, sorprendentemente, que la cantidad de subproductos de sobrereducción disminuye considerablemente si la reacción se realiza en un microreactor en continuo, lo que a su vez permite también realizar un escalado industrial. Con este nuevo proceso se obtienen, además, rendimientos superiores a los previamente descritos en ES P200302875, ya que es posible rebajar el alcohol propargílico remanente por debajo del 5% frente a un 12, 5% descrito y sin que aumenten las impurezas de sobrereducción.
La reacción funciona perfectamente tanto en los isomeros de la serie 5E (trans) como en los de la serie 5Z (cis) .
La reacción, básicamente se realiza en una espiral de politetrafluoroetileno (por ejemplo, el comercializado bajo el nombre de teflón®) de varios metros de longitud que se mantiene a la temperatura deseada en un baño termostático, siendo los reactivos impulsados por una bomba. El equipo puede funcionar en continuo durante 24 horas o más y permite la reducción en este tiempo de 0, 5 a 1 Kg de alcohol propargílico, según las condiciones de la reacción.
Otro punto interesante de esta invención se halla en el hecho de que uniendo al
tubo de teflón® una segunda espiral (más corta) , la cual se mantiene en un baño frío, se puede enfriar rápidamente la reacción, evitando la sobrereducción u otras reacciones colaterales.
Por otra parte, el producto ya reducido, junto con el exceso de hidruro, se recoge a la salida en una mezcla de hexano y sosa al 15% en atmósfera de nitrógeno. De esta forma se va destruyendo el hidruro en pequeñas cantidades, puesto que los flujos típicos varían entre 0, 5 y 2 ml/min, siendo este proceso mucho más seguro que cuando hay que destruir todo el hidruro de una reacción industrial en “batch”.
La reducción del triple enlace es estereoespecífica, produciéndose únicamente el isómero trans en C-22/C-23. Sin embargo, la posterior conversión de los alcoholes alílicos 5E obtenidos en los alcoholes alílicos 5Z, que son los precursores del Calcipotriol, mediante una reacción fotoquímica, produce una pequeña conversión del enlace trans de C-22/C-23...
Reivindicaciones:
- Proceso industrial para obtener intermedios aptos para la síntesis de análogos de vitamina D caracterizado porque comprende una etapa de reducción de compuestos de estructura general (VIII) y/o compuestos de estructura general (IX) , en un disolvente inerte y con un agente
(VIII) (IX)
reductor, para dar compuestos de estructura general (IV) y (V) , respectivamente, útiles como intermedios para la síntesis de análogos de Vitamina D,
(IV) (V)
donde la reacción de reducción se realiza de manera continua en un microreactor, y donde R1 y R2 pueden ser iguales o diferentes y representan Hidrogeno o un grupo protector de hidroxilos.
- Proceso según la reivindicación 1, caracterizado porque comprende una etapa de isomerización de compuestos de estructura general (X) a compuestos de estructura general (XI) , útiles como intermedios para la síntesis de análogos de Vitamina D,
(X) (XI)
caracterizado porque la reacción de isomerización se realiza de manera continua en un microfotoreactor, donde R1 y R2 pueden ser iguales o diferentes y representan Hidrogeno o un grupo protector de hidroxilos.
– Proceso según una de las reivindicaciones 1 ó 2, caracterizado porque dicho análogo de vitamina D es ( (5Z, 7E, 22E, 24S) -24-ciclopropil-9, 10-secocola5, 7, 10 (19) , 22-tetraen-1a-3 -24-triol) (I) .
- Proceso para la preparación del análogo de Vitamina D: ( (5Z, 7E, 22E, 24S) -24ciclopropil-9, 10-secocola-5, 7, 10 (19) , 22-tetraen-1a-3 -24-triol) (I) , caracterizado porque comprende los siguientes pasos:
a) una etapa de reducción según la reivindicación 1, de un compuesto de estructura general (IX) donde R1 y R2 pueden ser iguales o diferentes y representan Hidrogeno o un grupo protector de hidroxilos, para dar un compuesto de estructura general (V) ,
(IX) (V)
b) Separación de la mezcla de isómeros 24R y 24S del compuesto de estructura general (V) ,
c) Desprotección de los grupos protectores R1 y R2 para obtener un compuesto de 20 estructura general (I) .
- Proceso según las reivindicación 4, caracterizado porque los compuestos de estructura (IX) se preparan a partir de los compuestos de estructura general (XI) , donde R1 y R2 tienen los significados anteriormente expresados, por reacción con una base y Ciclopropanaldehido.
(XI)
- Proceso según la reivindicación 4, caracterizado porque los compuestos de estructura general (IX) , se preparan a partir de los compuestos de estructura general (XI) , donde R1 y R2 tienen los significados anteriormente expresados, por reacción con una base y Ciclopropil-N-metil-O-metil-hidroxilamida y posterior reducción del compuesto de estructura general (XII) , donde R1 y R2 tienen los significados anteriormente expuestos, mediante un reductor quiral o un reductor aquiral.
(XII)
- Proceso según las reivindicación 4, caracterizado porque los compuestos de estructura (VIII) se preparan a partir de los compuestos de estructura general (X) , donde R1 y R2 tienen los significados anteriormente expresados, por reacción con una base y Ciclopropanaldehido.
(X)
- Proceso según la reivindicación 4, caracterizado porque los compuestos de estructura general (VIII) , se preparan a partir de los compuestos de estructura general (X) , donde R1 y R2 tienen los significados anteriormente expresados, por reacción con una base y Ciclopropil-N-metil-O-metil-hidroxilamida y posterior reducción del compuesto de estructura general (XIII) , donde R1 y R2 tienen los significados anteriormente expuestos, mediante un reductor quiral o un reductor aquiral.
(XIII)
- Proceso según una de las reivindicaciones 6 u 8, caracterizado porque la reducción del compuesto de fórmula general (XII) se realiza con un reductor aquiral 15 en un microreactor y en continuo.
- Proceso según cualquiera de las reivindicaciones 4 a 9, caracterizado porque los compuestos de estructura general (XI) , se preparan a partir de los compuestos de estructura general (X) , donde R1 y R2 tienen los significados anteriormente expresados, mediante fotoisomerización en un microfotoreactor en continuo.
(X) (XI)
- Proceso según cualquiera de las reivindicaciones 4 a 10, caracterizado porque el reductor para obtener los compuestos de estructura general (IV) y (V) es el bis (2Metoxietoxi) aluminiohidruro de sodio.
12 - Proceso según cualquiera de las reivindicaciones 4 a 11, caracterizado porque el disolvente que se utiliza para obtener los compuestos de estructura general (IV) y
(V) es el Dioxano.
- Proceso según cualquiera de las reivindicaciones 4 a 12, caracterizado porque 20 la temperatura en que se realiza la reducción para obtener los compuestos de estructura general (IV) y (V) , está comprendida entre 65 ºC y 75 ºC.
- Proceso según cualquiera de las reivindicaciones 4 a 13, caracterizado porque dicho microreactor tiene un tubo de politetrafluoroetileno con un diámetro 25 comprendido entre 0, 5 y 2 mm.
- Proceso según la reivindicación 8, caracterizado porque el reductor es un reductor quiral, preferentemente (+) -B-Clorodiisopinocamfeilborano.
- Proceso según la reivindicación 8, caracterizado porque el reductor es un reductor aquiral, preferentemente del grupo formado por Hidruro de litio y aluminio, Bis (2-metoxietoxi) aluminiohidruro de sodio e Hidruro de diisobutilaluminio.
-Proceso según la reivindicación 10, caracterizado porque dicho microfotoreactor tiene un tubo con un diámetro comprendido entre 0, 5 y 8 mm.
- Proceso según una de las reivindicaciones 10 ó 17, caracterizado porque dicho microfotoreactor tiene un tubo y un refrigerante que son de cristal borosilicato 3.3, según la norma DIN/ISO 3585.
- Proceso según cualquiera de las reivindicaciones 10, 17 y 18, caracterizado porque la lámpara para efectuar la isomerización es una lámpara de mercurio de media presión, dopada con Talio y tiene un máximo de intensidad entre 300 y 400 nm.
- Proceso según cualquiera de las reivindicaciones 10 y 17 a 19, caracterizado porque el fotocatalizador es un fotocatalizador del grupo formado por Antraceno, 9-Acetilantraceno, 9-Metilantraceno y ácido 9-Antracencarboxílico.
- Proceso según cualquiera de las reivindicaciones 10 y 17 a 20, caracterizado porque la reacción de fotoisomerización se realiza a una temperatura comprendida entre 10 ºC y 25 ºC.
- Proceso según cualquiera de las reivindicaciones 4 a 21, caracterizado porque se utilizan compuestos en los cuales R1 y R2 representan un grupo sililo.
- Proceso según la reivindicación 22, caracterizado porque R1 y R2 representan un grupo tert-Butildimetilsililo.
- Uso de los procesos según las reivindicaciones anteriores para la manufactura industrial y en continuo de análogos de vitamina D y, preferentemente, Calcipotriol.
FIG. 1
FIG. 2
FIG. 3
Patentes similares o relacionadas:
Composición para el tratamiento de la tensión oxidativa y enfermedad cardiovascular, del 29 de Julio de 2020, de TEAM FOODS COLOMBIA S.A: Una composición de: (i) 35 a 50 por ciento en peso de un primer aceite vegetal que tiene un contenido de ácido graso saturado de 4% a 12%; (ii) 35 a 50 por ciento en […]
Terapia usando agente de repleción de la vitamina D y agente de reemplazo de la hormona de la vitamina D, del 19 de Febrero de 2020, de Opko Ireland Global Holdings, Ltd: Un medicamento que es una combinación de (i) una terapia de repleción de vitamina D, que es uno o más compuestos seleccionados de prohormonas de vitamina D y (ii) una terapia […]
Proceso mejorado para producir una cápsula de gelatina blanda que comprende bacterias probióticas viables y una cápsula de gelatina blanda que comprende bacterias probióticas viables que tienen un periodo de conservación largo, del 30 de Octubre de 2019, de Ayanda GmbH: Método para producir una cápsula de gelatina blanda que comprende bacterias probióticas no revestidas, comprendiendo el método: a) mezclar las […]
Uso de compuestos de vanadio para mantener la normoglucemia en un mamífero, del 25 de Septiembre de 2019, de CFM Pharma Holding BV: Composicion farmaceutica que comprende un compuesto o complejo de vanadio organico y/o inorganico fisiologicamente aceptable para su uso en […]
Procedimiento para la producción de pienso animal que comprende grano y extracto de Agaricus blazei, del 24 de Julio de 2019, de SSipfeed B.V: Procedimiento para producir material para pienso, que comprende a) fermentar Agaricus Blazei en 5 grano con un contenido de humedad entre el 10 y el 80% hasta el 15-50% […]
Composición oftálmica, del 3 de Julio de 2019, de DRUG DELIVERY SOLUTIONS LIMITED: Una composición oftálmica que comprende una dispersión de poliafrón, en donde la dispersión de poliafrón comprende al menos un tensioactivo […]
Material y método para tratar cavidades internas, del 29 de Mayo de 2019, de UroGen Pharma Ltd: Un material hidrófilo biocompatible de liberación sostenida que forma un hidrogel que es inyectable en una cavidad corporal que comprende una solución acuosa […]
Vitamina D3 y análogos de la misma para tratar la alopecia, del 22 de Mayo de 2019, de Berg LLC: Composición farmacéutica para administración tópica, que comprende una cantidad terapéuticamente eficaz de un compuesto de vitamina D para su uso en un método para prevenir o […]