Fosfatasa alcalina dirigida al hueso, kits y métodos de uso de la misma.
Una fosfatasa alcalina dirigida al hueso, que comprende un polipéptido que tiene la estructura:
Z-sALP-Y-espaciador-X-Wn-V,
en la que sALP consiste en los restos de aminoácidos 18-502 de SEC ID NO: 8;
en la que V está ausente, o es una secuencia de aminoácidos de al menos un aminoácido;
X está ausente, o es una secuencia de aminoácidos de al menos un aminoácido;
Y está ausente, o es una secuencia de aminoácidos de al menos un aminoácido;
Z está ausente, o es una secuencia de aminoácidos de al menos un aminoácido;
Wn es un poliaspartato o un poliglutamato, en el que n = 10 a 16; y el espaciador comprende una región de fragmento cristalizable (Fc).
Tipo: Patente Internacional (Tratado de Cooperación de Patentes). Resumen de patente/invención. Número de Solicitud: PCT/CA2008/000923.
Solicitante: Enobia Canada Limited Partnership.
Nacionalidad solicitante: Canadá.
Dirección: 2901, Rachel Street East, Suite 23 Montreal, QC H1W 4A4 CANADA.
Inventor/es: CRINE,Philippe, BOILEAU,Guy, LEMIRE,Isabelle, LOISEL,Thomas,P, LEONARD,Pierre, HEFT,Robert, LANDY,Hal.
Fecha de Publicación: .
Clasificación Internacional de Patentes:
- A61K38/46 NECESIDADES CORRIENTES DE LA VIDA. › A61 CIENCIAS MEDICAS O VETERINARIAS; HIGIENE. › A61K PREPARACIONES DE USO MEDICO, DENTAL O PARA EL ASEO (dispositivos o métodos especialmente concebidos para conferir a los productos farmacéuticos una forma física o de administración particular A61J 3/00; aspectos químicos o utilización de substancias químicas para, la desodorización del aire, la desinfección o la esterilización, vendas, apósitos, almohadillas absorbentes o de los artículos para su realización A61L; composiciones a base de jabón C11D). › A61K 38/00 Preparaciones medicinales que contienen péptidos (péptidos que contienen ciclos beta-lactama A61K 31/00; dipéptidos cíclicos que no tienen en su molécula ningún otro enlace peptídico más que los que forman su ciclo, p. ej. piperazina 2,5-dionas, A61K 31/00; péptidos basados en la ergolina A61K 31/48; que contienen compuestos macromoleculares que tienen unidades aminoácido repartidas estadísticamente A61K 31/74; preparaciones medicinales que contienen antígenos o anticuerpos A61K 39/00; preparaciones medicinales caracterizadas por los ingredientes no activos, p. ej. péptidos como soportes de fármacos, A61K 47/00). › Hidrolasas (3).
- A61P19/08 A61 […] › A61P ACTIVIDAD TERAPEUTICA ESPECIFICA DE COMPUESTOS QUIMICOS O DE PREPARACIONES MEDICINALES. › A61P 19/00 Medicamentos para el tratamiento de problemas del esqueleto. › para las enfermedades óseas, p.ej. raquitismo, enfermedad de Paget.
- C12N15/55 QUIMICA; METALURGIA. › C12 BIOQUIMICA; CERVEZA; BEBIDAS ALCOHOLICAS; VINO; VINAGRE; MICROBIOLOGIA; ENZIMOLOGIA; TECNICAS DE MUTACION O DE GENETICA. › C12N MICROORGANISMOS O ENZIMAS; COMPOSICIONES QUE LOS CONTIENEN; PROPAGACION, CULTIVO O CONSERVACION DE MICROORGANISMOS; TECNICAS DE MUTACION O DE INGENIERIA GENETICA; MEDIOS DE CULTIVO (medios para ensayos microbiológicos C12Q 1/00). › C12N 15/00 Técnicas de mutación o de ingeniería genética; ADN o ARN relacionado con la ingeniería genética, vectores, p. ej. plásmidos, o su aislamiento, su preparación o su purificación; Utilización de huéspedes para ello (mutantes o microorganismos modificados por ingeniería genética C12N 1/00, C12N 5/00, C12N 7/00; nuevas plantas en sí A01H; reproducción de plantas por técnicas de cultivo de tejidos A01H 4/00; nuevas razas animales en sí A01K 67/00; utilización de preparaciones medicinales que contienen material genético que es introducido en células del cuerpo humano para tratar enfermedades genéticas, terapia génica A61K 48/00; péptidos en general C07K). › Hidrolasas (3).
- C12N15/85 C12N 15/00 […] › para células animales.
- C12N5/10 C12N […] › C12N 5/00 Células no diferenciadas humanas, animales o vegetales, p. ej. líneas celulares; Tejidos; Su cultivo o conservación; Medios de cultivo para este fin (reproducción de plantas por técnicas de cultivo de tejidos A01H 4/00). › Células modificadas por introducción de material genético extraño, p. ej. células transformadas por virus.
- C12N9/16 C12N […] › C12N 9/00 Enzimas, p. ej. ligasas (6.); Proenzimas; Composiciones que las contienen (preparaciones para la limpieza de los dientes que contienen enzimas A61K 8/66, A61Q 11/00; preparaciones de uso médico que contienen enzimas A61K 38/43; composiciones detergentes que contienen enzimas C11D ); Procesos para preparar, activar, inhibir, separar o purificar enzimas. › actúan sobre los enlaces éster (3.1).
PDF original: ES-2380546_T3.pdf
Fragmento de la descripción:
Fosfatasa alcalina dirigida al hueso, kits y métodos de uso de la misma CAMPO DE LA INVENCIÓN
La presente invención se refiere a fosfatasa alcalina dirigida al hueso, a kits y métodos de uso de la misma.
ANTECEDENTES DE LA INVENCIÓN
La hipofosfatasia (HPP) es una forma rara heredable de raquitismo u osteomalacia (Whyte 2001) , con una incidencia tan grande como 1 por 2.500 nacimientos en menores canadienses (Greenberg, 1993) , y de 1 por 100.000 nacimientos en la población general para la forma más grave de la enfermedad. Son más prevalentes las formas más leves. Este "error congénito del metabolismo" está provocado por una mutación o mutaciones de pérdida de función en el gen (ALPL) que codifica la isozima no específica de tejidos de fosfatasa alcalina (TNALP; también conocida como ALP de tipo hepático/óseo/renal) (Weiss et al. 1988; Henthorn et al. 1992a; Henthorn et al. 1992b; Zurutuza et al. 1999; Millán 1995) . La característica bioquímica distintiva es actividad subnormal de ALP en suero (hipofosfatasemia) , que conduce a niveles sanguíneos y/o de orina elevados de tres sustratos de fosfocompuestos: pirofosfato inorgánico (PPi) , fosfoetanolamina (PEA) , y 5'-fosfato de piridoxal (PLP) (Whyte 1994) .
La HPP presenta un intervalo notable de gravedad, que oscila desde (en orden desde la más grave hasta la más leve) formas perinatales, infantil, de la niñez, del adulto, y odontohipofosfatasia, clasificada históricamente según la edad en el momento del diagnóstico (Whyte 2001) . Puede haber una ausencia casi completa de mineralización ósea in útero con alumbramiento de un mortinato, o fracturas espontáneas y enfermedad dental que aparece por primera vez en la vida adulta. La hipofosfatasia perinatal (letal) es expresada in útero, y puede ser la causa de alumbramiento de un mortinato. Algunos neonatos pueden sobrevivir varios días, pero sufren insuficiencia respiratoria aumentada, debido a la enfermedad hipoplásica y raquítica del pecho. En HPP infantil, diagnosticada antes de los 6 meses de edad, el desarrollo postnatal parece normal hasta el comienzo de una mala alimentación, una ganancia de peso inadecuada, y la aparición de raquitismo. Los rasgos radiológicos son característicos, y muestran mineralización esquelética alterada, algunas veces con desmineralización esquelética progresiva, conduciendo a fracturas de las costillas y deformidad del pecho. La hipofosfatasia de la niñez también tiene una expresión clínica muy variable. La pérdida prematura de dientes de leche resulta de aplasia, hipoplasia o displasia de cemento dental que conecta la raíz del diente con el ligamiento periodontal. El raquitismo provoca estatura corta, y las deformidades esqueléticas pueden incluir piernas arqueadas, alargamiento de las muñecas, rodillas y tobillos como resultado de metáfisis acampanada. La HPP del adulto se presenta habitualmente durante la edad intermedia, aunque frecuentemente hay una historia de raquitismo y/o pérdida prematura de dientes, seguido de una buena salud durante la adolescencia y la vida del adulto joven. Las fracturas recurrentes por estrés de metatarsianos son habituales, y la deposición de pirofosfato de calcio dihidratado provoca ataque de artritis y artropatía por pirofosfato. La odontohipofosfatasia se diagnostica cuando la única anormalidad clínica es enfermedad dental, y los estudios radiológicos incluso biopsias óseas no revelan signos de raquitismo u osteomalacia.
Las formas clínicas más graves de hipofosfatasia se heredan habitualmente como rasgos recesivos autosómicos, mostrando los padres de tales pacientes niveles subnormales de actividad de AP sérica (Whyte 2001) . Para las formas más leves de hipofosfatasia, es decir, de adulto y odontohipofosfatasia, también se ha documentado un patrón de herencia dominante autosómico (Whyte 2001) .
En el esqueleto sano, TNALP es una ectoenzima presentada sobre la superficie de la membrana plasmática de osteoblastos y condrocitos, incluyendo en las membranas de sus vesículas de la matriz (MVs) desprendidas (Ali et al. 1970; Bernard 1978) , en las que la enzima está particularmente enriquecida (Morris et al. 1992) . La deposición de hidroxiapatita durante la mineralización ósea se inicia normalmente dentro de la luz de estas MVs (Anderson et al. 2005a) . La microscopía electrónica ha demostrado que las MVs deficientes en TNALP de pacientes con HPP afectados gravemente y ratones Akp2-/- (un modelo de ratón carente de TNALP; véase más abajo) contienen cristales de hidroxiapatita, pero que la propagación de cristales extravesiculares parece retardada (Anderson 1997; Anderson 2004) . Este defecto se atribuye a la acumulación extracelular de PPi, un potente inhibidor de la calcificación (Meyer 1984) debido a deficiencia de la actividad de TNALP (Hessle et al. 2002; Harmey et al. 2004; Harmey et al. 2006) .
Cuando PPi está presente a concentraciones casi fisiológicas, en el intervalo de 0, 01-0, 1 mM, PPi tiene la capacidad para estimular la mineralización en fémures de polluelos cultivados en órganos (Anderson y Reynolds 1973) y también mediante MVs de rata aisladas (Anderson et al. 2005b) , mientras que, a concentración por encima de 1 mM, PPi inhibe la formación de fosfato cálcico mineral revistiendo los cristales de hidroxiapatita, evitando así el crecimiento de cristales minerales y la autonucleación proliferativa. De este modo, PPi tiene un doble papel fisiológico; puede funcionar como un promotor de la mineralización a concentraciones bajas, pero como un inhibidor de la mineralización a concentraciones más altas. Se ha demostrado que TNALP hidroliza el inhibidor de la mineralización PPi para facilitar la precipitación y crecimiento de mineral (Rezende et al. 1998) . Estudios recientes usando los ratones Akp2-/- han indicado que el papel principal de TNALP in vivo es restringir el tamaño del conjunto de PPi extracelular para permitir la mineralización esquelética apropiada (Hessle et al. 2002; Harmey et al. 2004) .
La gravedad de la hipofosfatasia es variable, y está modulada por la naturaleza de la mutación de TNALP. Se ha encontrado que las mutaciones sustitutivas en la vecindad de sitios activos de enzimas, la interfaz del homodímero, el dominio corona, el brazo aminoterminal y el sitio de unión de calcio afectan todos ellos a la actividad catalítica de TNALP (Zurutuza et al. 1999) . Adicionalmente, se ha demostrado que otras mutaciones sustitutivas, sin sentido, de desplazamiento del marco y del sitio de empalme conducen a proteínas mutantes aberrantes o defectos de tráfico intracelulares que conducen a actividad subnormal en la superficie celular. La multitud de mutaciones y el hecho de que la heterocigosidad del compuesto sea un suceso habitual en hipofosfatasia también explican la variable expresividad e incompleta penetrancia observadas a menudo en esta enfermedad (Whyte 2001) .
El progreso en la forma humana de la enfermedad se beneficia enormemente de la existencia de los ratones carentes de TNALP (Akp2-/-) como modelo de animal. Estos ratones Akp2-/- fenocopian notablemente bien HPP infantil, puesto que nacen con un esqueleto normalmente mineralizado, pero desarrollan raquitismo radiográficamente visible en alrededor de 6 días, y mueren entre los días 12 y 16 sufriendo una grave hipomineralización esquelética y episodios de apnea y ataques epilépticos atribuibles a alteraciones en el metabolismo de PLP (vitamina B6) (Waymire et al. 1995; Narisawa et al. 1997; Fedde et al. 1999; Narisawa et al. 2001) .
Se ha demostrado que algunas mutaciones de sitio activo de TNALP afectan a la capacidad de la enzima para metabolizar PPi o PLP de forma diferente (Di Mauro et al. 2002) . Tanto PLP como PPi son sustratos naturales confirmados de TNALP, y las anormalidades en el metabolismo de PLP explican los ataques epilépticos observados en ratones Akp2-/- (Waymire et al. 1995; Narisawa et al. 2001) , mientras que las anormalidades en el metabolismo de PPi explican el fenotipo esquelético en este modelo de ratón de hipofosfatasia (Hessle et al. 2002; Anderson et al. 2004; Harmey et al. 2004; Harmey et al. 2006; Anderson et al. 2005a) .
No hay ninguna terapia médica confirmada para HPP. Los informes de casos de terapia de sustitución enzimática (ERT) usando infusiones intravenosas (i.v.) de plasma rico en TNALP de pacientes con enfermedad ósea de Paget y ALP placentaria purificada han descrito la imposibilidad de salvar lactantes afectados (Whyte et al. 1982; Whyte et al. 1984) . En otro estudio similar, Weninger et al. (Weninger et al. 1989) intentaron una ERT para un niño prematuro gravemente afectado... [Seguir leyendo]
Reivindicaciones:
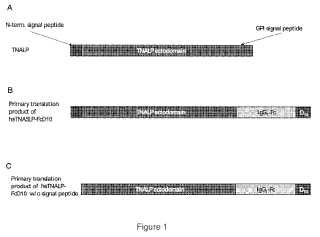
1. Una fosfatasa alcalina dirigida al hueso, que comprende un polipéptido que tiene la estructura:
Z-sALP-Y-espaciador-X-Wn-V, en la que sALP consiste en los restos de aminoácidos 18-502 de SEC ID NO: 8;
en la que V está ausente, o es una secuencia de aminoácidos de al menos un aminoácido;
X está ausente, o es una secuencia de aminoácidos de al menos un aminoácido;
Y está ausente, o es una secuencia de aminoácidos de al menos un aminoácido;
Z está ausente, o es una secuencia de aminoácidos de al menos un aminoácido;
Wn es un poliaspartato o un poliglutamato, en el que n = 10 a 16; y el espaciador comprende una región de fragmento cristalizable (Fc) .
2. La fosfatasa alcalina de la reivindicación 1, en la que el Fc comprende un dominio CH2, un dominio CH3 y una región de bisagra, o en la que el Fc es un dominio constante de una inmunoglobulina seleccionada del grupo que consiste en IgG-1, IgG-2, IgG-3, IgG-3 e IgG-4, preferiblemente en la que el Fc es un dominio constante de una inmunoglobulina IgG-1.
3. La fosfatasa alcalina de la reivindicación 2, en la que el Fc es un dominio constante de IgG-1 humana.
4. La fosfatasa alcalina de la reivindicación 3, en la que el Fc es como se expone en SEC ID NO: 3.
5. La fosfatasa alcalina de una cualquiera de las reivindicaciones 1 a 4, en la que Wn es un poliaspartato, preferiblemente en el que n = 10.
6. La fosfatasa alcalina de una cualquiera de las reivindicaciones 1 a 5, en la que Z está ausente, y/o en la que V está ausente.
7. La fosfatasa alcalina de una cualquiera de las reivindicaciones 1 a 6, en la que a) Y es un resto de dos aminoácidos, preferiblemente en la que Y es leucina-lisina; y/o b) X es un resto de dos aminoácidos, preferiblemente en la que X es aspartato-isoleucina.
8. La fosfatasa alcalina de la reivindicación 1, en la que el polipéptido es como se expone en SEC ID NO: 4.
9. La fosfatasa alcalina de una cualquiera de las reivindicaciones 1 a 8, que comprende el polipéptido en una forma que comprende un dímero.
10. La fosfatasa alcalina de una cualquiera de las reivindicaciones 1 a 9, en la que dicha fosfatasa alcalina consiste en dicho polipéptido.
11. La fosfatasa alcalina de una cualquiera de las reivindicaciones 1 a 10, en la que la fosfatasa alcalina está en un vehículo farmacéuticamente aceptable, preferiblemente en la que el vehículo farmacéuticamente aceptable es una disolución salina, más preferiblemente en la que la fosfatasa alcalina está en una forma liofilizada.
12. La fosfatasa alcalina de cualquiera de las reivindicaciones 1 a 11, para uso como un medicamento.
13. La fosfatasa alcalina de la reivindicación 12, en una dosificación diaria de alrededor de 0, 2 a alrededor de 20 mg/kg, o una dosificación semanal de alrededor de 1, 4 a alrededor de 140 mg/kg.
14. Un ácido nucleico aislado que comprende o consiste en una secuencia que codifica el polipéptido definido en una cualquiera de las reivindicaciones 1 a 8.
15. Un vector de expresión recombinante que comprende el ácido nucleico de la reivindicación 14.
16. Un vector vírico adenoasociado recombinante que comprende el ácido nucleico de la reivindicación 14.
17. Una célula hospedante recombinante aislada, transformada o transfectada con el vector de la reivindicación 15 ó
16.
18. Un método para producir la fosfatasa alcalina de una cualquiera de las reivindicaciones 1 a 8, que comprende cultivar la célula hospedante de la reivindicación 17 en condiciones adecuadas para efectuar la expresión de la fosfatasa alcalina, y recuperar la fosfatasa alcalina del medio de cultivo.
19. El método de la reivindicación 18, en el que la célula hospedante es una célula L, célula C127, célula 3T3, célula CHO, célula BHK, célula COS-7 o una célula de ovario de hámster chino (CHO) , preferiblemente en el que la célula hospedante es una célula de ovario de hámster chino (CHO) , más preferiblemente en el que la célula hospedante es una célula CHO-DG44.
20. Un kit que comprende la fosfatasa alcalina como se define en una cualquiera de las reivindicaciones 1 a 11, e instrucciones para uso en un método para corregir o evitar un fenotipo de hipofosfatasia (HPP) .
21. Una fosfatasa alcalina como se define en una cualquiera de las reivindicaciones 1 a 11, para uso en un método para corregir o evitar al menos un fenotipo de hipofosfatasia (HPP) en un sujeto que lo necesite.
22. La fosfatasa alcalina de la reivindicación 21, en la que
a) el sujeto tiene al menos un fenotipo de HPP, preferiblemente en la que i) el al menos un fenotipo de HPP comprende ataque relacionado con HPP, o ii) el al menos un fenotipo de HPP comprende pérdida prematura de dientes de leche, o iii) el al menos un fenotipo de HPP comprende mineralización ósea incompleta, preferiblemente en el que la mineralización ósea incompleta es mineralización ósea femoral incompleta o mineralización ósea tibial incompleta, o mineralización ósea metatarsiana incompleta, o mineralización ósea incompleta de las costillas, o iv) el al menos un fenotipo de HPP comprende niveles elevados sanguíneos y/o de orina de pirofosfato inorgánico (PPi) , o v) el al menos un fenotipo de HPP comprende niveles elevados sanguíneos y/o de orina de fosfoetanolamina (PEA) , o vi) el al menos un fenotipo de HPP comprende niveles elevados sanguíneos y/o de orina de 5'-fosfato de piridoxal (PLP) , o vii) el al menos un fenotipo de HPP comprende ganancia de peso inadecuada; o viii) el al menos un fenotipo de HPP comprende raquitismo, o ix) el al menos un fenotipo de HPP comprende dolor óseo, o x) el al menos un fenotipo de HPP comprende deposición de cristales de pirofosfato de calcio dihidratado; o xi) el al menos un fenotipo de HPP comprende aplasia, hipoplasia o displasia del cemento dental.
23. La fosfatasa alcalina de la reivindicación 21 ó 22, en la que el sujeto que la necesita tiene a) HPP de lactante; o b) HPP de la niñez; o c) HPP perinatal; o d) HPP de adulto; o e) HPP de odontohipofosfatasia.
24. La fosfatasa alcalina de cualquiera de las reivindicaciones 21 a 23, en la que el uso comprende transfectar una célula en el sujeto con un ácido nucleico que codifica la fosfatasa alcalina, en particular en la que la transfección de la célula se lleva a cabo in vitro de manera que la fosfatasa alcalina es expresada y segregada en una forma activa, y es administrada al sujeto con dicha célula.
25. La fosfatasa alcalina de una cualquiera de las reivindicaciones 21 a 23, en la que el uso comprende la administración subcutánea de la fosfatasa alcalina al sujeto.
26. La fosfatasa alcalina de una cualquiera de las reivindicaciones 21 a 23, en la que el uso comprende la administración intravenosa de la fosfatasa alcalina al sujeto.
Patentes similares o relacionadas:
 Animales no humanos que tienen un locus de cadena ligera lambda de inmunoglobulina modificado por ingeniería, del 29 de Julio de 2020, de REGENERON PHARMACEUTICALS, INC.: Un roedor cuyo genoma de la línea germinal comprende un locus de cadena ligera λ de inmunoglobulina endógeno que comprende:
(a) uno o más segmentos […]
Animales no humanos que tienen un locus de cadena ligera lambda de inmunoglobulina modificado por ingeniería, del 29 de Julio de 2020, de REGENERON PHARMACEUTICALS, INC.: Un roedor cuyo genoma de la línea germinal comprende un locus de cadena ligera λ de inmunoglobulina endógeno que comprende:
(a) uno o más segmentos […]
 Procedimiento para la producción de polipéptidos, del 29 de Julio de 2020, de F. HOFFMANN-LA ROCHE AG: Promotor que tiene la secuencia de ácido nucleico de SEQ ID NO: 02.
Procedimiento para la producción de polipéptidos, del 29 de Julio de 2020, de F. HOFFMANN-LA ROCHE AG: Promotor que tiene la secuencia de ácido nucleico de SEQ ID NO: 02.
Ratones con un sistema inmunitario humanizado con células dendríticas reforzadas, del 22 de Julio de 2020, de INSERM (INSTITUT NATIONAL DE LA SANTE ET DE LA RECHERCHE MEDICALE): Un ratón Rag-/-, γc-/-, Flk2-/- deficiente para el gen activador de recombinación 2 (Rag2) y/o el gen activador de recombinación 1 (Rag1), cadena gamma […]
Detección de interacciones proteína a proteína, del 15 de Julio de 2020, de THE GOVERNING COUNCIL OF THE UNIVERSITY OF TORONTO: Un método para medir cuantitativamente la fuerza y la afinidad de una interacción entre una primera proteína de membrana o parte de la misma y una […]
Procedimientos y composiciones para el tratamiento de una afección genética, del 24 de Junio de 2020, de Sangamo Therapeutics, Inc: Una célula precursora de glóbulos rojos genomanipulada caracterizada por una modificación genómica dentro del exón 2 o el exón 4 de BCL11A o dentro de BCL11A-XL […]
Estructuras artificiales de poliepítopos para uso en inmunoterapia, del 17 de Junio de 2020, de Invectys: Un vector de expresión de ADN o una mezcla de vectores de expresión de ADN que codifica al menos dos epítopos de CD4 de la transcriptasa inversa de la telomerasa […]
Expresión de proteína biotecnológica mejorada que usa un activador CHEF1 híbrido, del 17 de Junio de 2020, de AGC Biologics, Inc: Un vector de expresión que comprende ADN regulador de la transcripción del factor 1α de elongación de hámster chino (CHEF1) 5' y un activador de citomegalovirus (CMV) que […]
Roedores con alelos mutantes de Acvr1 condicionales, del 10 de Junio de 2020, de REGENERON PHARMACEUTICALS, INC.: Una construcción de ácido nucleico que comprende: (i) un exón 5 de Acvr1 que codifica una secuencia de tipo silvestre a nivel de proteína, […]