Procedimiento para la preparación de ésteres del ácido 2,3,4,9-tetrahidro-1H-beta-carbolin-3-carboxílico.
El procedimiento para la preparación de los compuestos de la fórmula (I)
que comprende la reacción entre triptófano y 3,
4- (metilendioxi) benzaldehído en un disolvente alcohólico de la fórmula R'OH en presencia de un exceso molar, con respecto al triptófano, de un ácido inorgánico prótico, en el que en R'OH y en la fórmula (I), R' representa el mismo sustituyente elegido entre alquilo, cicloalquilo, cicloalquilo que contiene heteroátomos, arilo, heteroarilo o aralquilo.
Tipo: Patente Internacional (Tratado de Cooperación de Patentes). Resumen de patente/invención. Número de Solicitud: PCT/EP2009/052037.
Solicitante: ENDURA S.P.A..
Nacionalidad solicitante: Italia.
Dirección: Viale Pietramellara 5 40121 Bologna ITALIA.
Inventor/es: BORZATTA, VALERIO, GUARNA, ANTONIO, SCARPI,Dina, OCCHIATO,Ernesto.
Fecha de Publicación: .
Clasificación Internacional de Patentes:
- C07D471/04 QUIMICA; METALURGIA. › C07 QUIMICA ORGANICA. › C07D COMPUESTOS HETEROCICLICOS (Compuestos macromoleculares C08). › C07D 471/00 Compuestos heterocíclicos que contienen átomos de nitrógeno como únicos heteroátomos del sistema condensado, teniendo al menos un ciclo de seis miembros con un átomo de nitrógeno, no previstos en los grupos C07D 451/00 - C07D 463/00. › Sistemas condensados en orto.
PDF original: ES-2381813_T3.pdf
Fragmento de la descripción:
Procedimiento para la preparación de ésteres del ácido 2, 3, 4, 9-tetrahidro-1H-beta-carbolin-3-carboxílico
5 Descripción de la invención
Campo de la invención [0001] La presente invención se refiere al procedimiento de síntesis de los ésteres del ácido 2, 3, 4, 9-tetrahidro-1H-β
carbolin-3-carboxílico sustituido en la posición 1.
Técnica anterior
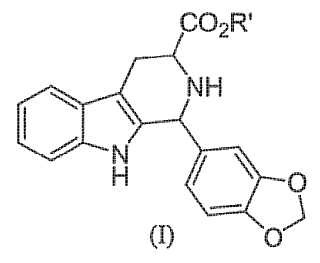
Los compuestos de la fórmula (I) 15
se usan ampliamente en la síntesis de ingredientes activos tales como alcaloides y fármacos. El producto intermedio más conocido se representa por el éster de metilo del ácido 2, 3, 4, 9-tetrahidro-1- (3, 4-benzodioxolil) -β-carbolin-3
carboxílico en la forma diastereomérica cis, usado en la síntesis del fármaco (6R, 12aR) -2, 3, 6, 7, 12, 12a hexahidro-2metil-6- (3, 4-metilendioxifenil) -pirazin[1', 2': 1, 6]pirido[3, 4-b] andol-1, 4-diona; también conocido como Tadalafilo.
Los compuestos de fórmula general (I) tienen dos centros estereogénicos en los que los sustituyentes distintos de los átomos de hidrógeno en los átomos de carbono asimétricos pueden estar en la configuración cis o trans. Se conoce bien que los compuestos biológicos activos que contienen al menos un átomo de carbono asimétrico poseen una actividad biológica diferente dependiendo de su estereoisomería, siendo uno de los estereoisómeros más activo que el otro.
Se conoce que se pueden obtener los compuestos de la fórmula general (I) en la configuración adecuada cis o trans por medio de la reacción de Pictet-Spengler entre el triptófano en la configuración adecuada D o L y 3, 4 (metilendioxi) -benzaldehído, como se describe a continuación en el presente documento:
[0005] En particular, se describe ampliamente la síntesis del éster de metilo del ácido cis 2, 3, 4, 9-tetrahidro-1- (3, 4benzodioxolil) -β-carbolin-3-carboxílico, un producto intermedio para la fabricación del Tadalafilo.
El documento de Patente de los Estados Unidos de América Nº 5.859.006 describe la síntesis del Tadalafilo y de su producto intermedio el éster de metilo del ácido cis 2, 3, 4, 9-tetrahidro-1- (3, 4-benzodioxolil) -β-carbolin-340 carboxílico por reacción entre el éster de metilo del D-triptófano y 3, 4-benzodioxol-1-carbaldehído (piperonal) en diclorometano y en presencia de ácido trifluoroacético. En este caso se obtienen ambos diastereómeros y el isómero cis se separa del isómero trans por medio de cromatografía preparativa. El proceso descrito anteriormente tiene la desventaja de la separación cromatográfica, el uso del ácido trifluoroacético que es altamente corrosivo, los largos tiempos de reacción (4-5 días) y los bajos rendimientos para el isómero cis (37-42%) .
En el documento de solicitud de patente internacional WO 2004/011463 se informó de la síntesis del Tadalafilo y del éster de metilo del ácido cis 2, 3, 4, 9-tetrahidro-1- (3, 4-benzodioxolil) -β-carbolin-3-carboxílico por reacción entre el hidrocloruro del éster de metilo del D-triptófano y piperonal en alcohol isopropílico anhidro.
El procedimiento tiene la desventaja del uso de alcohol isopropílico anhidro siendo de esa manera de escasa aplicación industrial. En el documento de solicitud de patente internacional WO 2005/068464 se describe un procedimiento de preparación en el que se condensan el éster de metilo del D-triptófano y piperonal en presencia de ácido trifluoroacético, en un disolvente adecuado y en presencia de tamices moleculares para absorber el agua liberada durante la reacción. Se obtiene tanto el estereoisómero cis como el trans que, por tratamiento con ácido clorhídrico acuoso, da la sal de hidrocloruro del isómero cis, que precipita en el medio de reacción y se aísla posteriormente y se hace reaccionar con los reactivos adecuados para obtener el Tadalafilo. El proceso descrito anteriormente tiene la desventaja del uso de los tamices moleculares, que dificulta la explotación a escala industrial, y del hecho que la reacción se lleva a cabo en dos etapas que requiere el aislamiento de productos intermedios.
En el documento de patente de los Estados Unidos de América Nº 6.143.746 se describe un procedimiento de preparación en el que se condensan el éster de metilo del D-triptófano y piperonal en presencia de ácido trifluoroacético en diclorometano anhidro. Se obtiene el isómero trans por medio de la concentración del disolvente y filtración. Las aguas madres, que contienen mayoritariamente el isómero cis, se concentran adicionalmente y se obtiene el isómero cis mediante cristalización añadiendo éter isopropílico como cosolvente. El procedimiento descrito anteriormente tiene la desventaja del uso de un disolvente clorado, un ácido extremadamente corrosivo como el ácido trifluoroacético, los largos tiempos de reacción y la separación por medio de cristalización fraccionada.
En el documento de patente de los Estados Unidos de América Nº 6.143.757 se describe un procedimiento para la preparación del Tadalafilo partiendo del hidrocloruro del éster de metilo del D-triptófano, por reacción de Pictet-Spengler en presencia de disolventes clorados, ácido trifluoroacético y piperonal, para obtener el éster de metilo del ácido 2, 3, 4, 9-tetrahidro-1- (3, 4-benzodioxolil) -β-carbolin-3-carboxílico en las formas diastereoméricas cis y trans. A continuación se separa la forma cis por medio de cromatografía preparativa y el diastereómero obtenido de esta manera se hace reaccionar con el isocianato apropiado para obtener el Tadalafilo. El procedimiento descrito anteriormente tiene la desventaja del uso del ácido trifluoroacético, altamente corrosivo, y la necesidad de separar los dos diastereómeros por medio de cromatografía preparativa.
En el documento de solicitud de patente internacional WO 2006/110893 se describe un procedimiento para obtener Tadalafilo y su precursor, el éster de metilo del ácido cis 2, 3, 4, 9-tetrahidro-1- (3, 4-benzodioxolil) -β-carbolin-3carboxílico. El último se obtiene por reacción del éster de metilo del D-triptófano y/o su sal adecuada en un disolvente elegido entre ésteres de alquilo de ácidos carboxílicos tales como, por ejemplo, acetato de etilo en presencia de ácido trifluoroacético, a una temperatura de reacción de aproximadamente 50 ºC durante prolongados tiempos de reacción (7 días) . A continuación se obtiene el diastereómero cis por filtración con un rendimiento que varía entre el 32% y el 76%. El procedimiento descrito anteriormente tiene la desventaja del uso del ácido trifluoroacético que es altamente corrosivo y de los prolongados tiempos de reacción (7 días) . En el documento de 45 solicitud de patente de los Estados Unidos de América Nº 2006/0258865 se describe un procedimiento para obtener Tadalafilo y su precursor el éster de metilo del ácido cis 2, 3, 4, 9-tetrahidro-1- (3, 4-benzodioxolil) -β-carbolin-3carboxílico. El último se prepara por reacción del hidrocloruro del éster de metilo del D-triptófano con piperonal en un disolvente polar aprótico con un punto de ebullición elevado tal como N, N-dimetil acetamida (DMA) en presencia de un agente deshidratante tal como sulfato sódico anhidro en cantidad considerable y con calentamiento durante 30-35 horas. La mezcla diastereomérica obtenida de esta manera se trata a continuación con ácido clorhídrico con calentamiento durante 6-10 horas adicionales para epimerizar el diastereómero trans y se separa el isómero cis por medio de cristalización en una mezcla de tolueno/ciclohexano después de la extracción orgánica de la solución ácida acuosa. Por cierto, el procedimiento descrito anteriormente tiene la desventaja de usar un disolvente polar aprótico que tiene un punto de ebullición elevado como la DMA, que es difícil de recuperar y un agente deshidratante tal 55 como sulfato sódico anhidro en cantidad considerable, seguido de reacción con ácido clorhídrico para obtener el isómero cis y la cristalización final después de la extracción de la solución ácida acuosa.
En Herralz T. et al., J.Agric. Food Chemistr y , 2003, 51, 2168-2173, el L-triptófano se hace reaccionar con el aldehído adecuado para dar el correspondiente ácido tetrahidro-β-carbolin-3-carboxílico en una mezcla diastereomérica en presencia de ácido sulfúrico durante periodos prolongados de reacción (9 días) . Mediante el uso de este procedimiento que parte directamente del aminoácido, el producto obtenido representa solamente el ácido y no su éster. Además, la reacción necesita tiempos prolongados... [Seguir leyendo]
Reivindicaciones:
1. El procedimiento para la preparación de los compuestos de la fórmula (I)
que comprende la reacción entre triptófano y 3, 4- (metilendioxi) benzaldehído en un disolvente alcohólico de la fórmula R'OH en presencia de un exceso molar, con respecto al triptófano, de un ácido inorgánico prótico, en el que en R'OH y en la fórmula (I) , R' representa el mismo sustituyente elegido entre alquilo, cicloalquilo, cicloalquilo que contiene heteroátomos, arilo, heteroarilo o aralquilo.
2. El procedimiento de acuerdo con la reivindicación 1 en el que el triptófano es D-triptófano, L-triptófano o sus mezclas.
3. El procedimiento de acuerdo con una cualquiera de las reivindicaciones 1-2, en el que el ácido es ácido clorhídrico, ácido sulfúrico o ácido nítrico.
4. El procedimiento de acuerdo con una cualquiera de las reivindicaciones 1-3, en el que el ácido prótico está
presente en un exceso molar de hasta el 50% con respecto al triptófano. 20
5. El procedimiento de acuerdo con la reivindicación 4, en el que el ácido prótico está presente en un exceso molar entre el 5% y el 30% con respecto al triptófano.
6. El procedimiento de acuerdo con la reivindicación 5, en el que el ácido prótico está presente en un exceso molar 25 entre el 10% y el 30% con respecto al triptófano.
7. El procedimiento de acuerdo con una cualquiera de las reivindicaciones 1-6, en el que se usa triptófano y 3, 4 (metilendioxi) benzaldehído en una cantidad equimolar.
8. El procedimiento de acuerdo con una cualquiera de las reivindicaciones 1-7, en el que el disolvente R'OH se selecciona entre metanol, etanol, n-propanol, isopropanol, n-butanol y sus isómeros, n-pentanol y sus isómeros, nhexanol y sus isómeros, n-heptanol y sus isómeros, n-octanol y sus isómeros, ciclopentanol, ciclohexanol, cicloheptanol, hidroxipiperidina, alcohol fenílico, alcohol bencílico, alcohol metilbencílico, alcohol 4-metoxibencílico, alcohol 3-metoxibencílico, alcohol 2-metoxibencílico, alcohol 4-nitrobencílico y tetrahidrofuranometanol.
9. El procedimiento de acuerdo con una cualquiera de las reivindicaciones 1-8, en el que la reacción entre triptófano, 3, 4- (metilendioxi) benzaldehído y R'OH se realiza a la temperatura de reflujo del R'OH, durante un período de tiempo entre 12 y 36 horas.
10. El procedimiento de acuerdo con una cualquiera de las reivindicaciones 1-9, en el que el producto (I) obtenido se somete posteriormente a una reacción de epimerización para aumentar la riqueza de uno de sus diastereómeros.
11. El procedimiento de acuerdo con la reivindicación 10, en el que el diastereómero es el diastereómero cis.
45 12. El procedimiento de acuerdo con la reivindicación 11, en el que la epimerización se realiza por reacción del compuesto (I) a una temperatura entre 40 y 70 ºC durante un periodo de tiempo entre 40 y 100 horas, con un exceso molar de ácido clorhídrico acuoso con respecto al triptófano de partida.
Patentes similares o relacionadas:
Derivados de piperidina 1,4 sustituidos, del 29 de Julio de 2020, de 89Bio Ltd: Un compuesto de acuerdo con la Fórmula I: **(Ver fórmula)** o una sal farmacéuticamente aceptable del mismo, en donde: A se selecciona de […]
Compuestos y procedimientos de uso, del 29 de Julio de 2020, de Medivation Technologies LLC: Un compuesto de fórmula (Aa-1): **(Ver fórmula)** o una sal farmacéuticamente aceptable del mismo, en la que: A representa H, halógeno, amino, […]
Compuestos de heteroaril carboxamida como inhibidores de RIPK2, del 29 de Julio de 2020, de BOEHRINGER INGELHEIM INTERNATIONAL GMBH: Un compuesto de fórmula (I): **(Ver fórmula)** o sus sales farmacéuticamente aceptables, en la que: X es N y Y es CH; o X es CH y Y es N; […]
Compuestos de alquinilbenceno heterocíclicos, y composiciones médicas y usos de los mismos, del 29 de Julio de 2020, de Guangzhou Healthquest Pharma Co., Ltd: Un compuesto de alquinilbenceno heterocíclico que tiene la fórmula (I) y una sal farmacéuticamente aceptable, o estereoisómero del mismo, **(Ver […]
Ureas cíclicas como inhibidores de ROCK, del 22 de Julio de 2020, de BRISTOL-MYERS SQUIBB COMPANY: Un compuesto de acuerdo con la Fórmula (I): **(Ver fórmula)** o un enantiómero, un diastereómero, un estereoisómero, un tautómero, una sal farmacéuticamente aceptable […]
Formas sólidas de un compuesto modulador de quinasas, del 22 de Julio de 2020, de PLEXXIKON, INC: Una forma cristalina del Compuesto I: **(Ver fórmula)** que es la Forma C del Compuesto I caracterizado por un difractograma de rayos […]
Derivado heteroarilo o sal farmacéuticamente aceptable del mismo, método de preparación del mismo y composición farmacéutica para prevenir o tratar enfermedades asociadas con PI3 quinasas, que contiene el mismo como principio activo, del 22 de Julio de 2020, de KOREA RESEARCH INSTITUTE OF CHEMICAL TECHNOLOGY: Un compuesto representado por la fórmula 1, un isómero óptico del mismo o una sal farmacéuticamente aceptable del mismo: **(Ver fórmula)** en la fórmula […]
Procedimiento de preparación de la forma A de grapiprant, del 22 de Julio de 2020, de Aratana Therapeutics Inc: Un procedimiento de preparación de una Forma A cristalina sustancialmente pura de grapiprant, comprendiendo el procedimiento: i. poner en contacto grapiprant a temperatura […]