UTILIZACIÓN DE INHIBIDORES DE LAS LISIL OXIDASAS PARA EL CULTIVO CELULAR Y LA INGENIERÍA TISULAR.
Utilización de inhibidores directos de lisil-oxidasas (LO) seleccionados entre:
las aminas primarias que reaccionan con el grupo carbonilo del sitio activo de las LO, y más particularmente las que proporcionan, después de una unión al carbonilo, un producto estabilizado por resonancia, tales como las aminas primarias siguientes: - la etilendiamina, - los aminonitrilos, tales como el β-aminopropionitrilo (βAPN) o la 2-nitroetilamina, - las haloaminas insaturadas o saturadas, tales como la 2-bromoetilamina, la 2-cloroetilamina, la 2-trifluoroetilamina, la 3-bromopropilamina, las p-halobencilaminas, y los compuestos halogenados insaturados, - la selenohomocisteína lactona. como inhibidores de la desdiferenciación de las células en cultivo in vitro, con vistas al mantenimiento constante del fenotipo de dichas células en el marco de la realización de un procedimiento de cultivo in vitro de estas últimas, y durante la totalidad del tiempo de cultivo, para la preparación de células diferenciadas cuyo fenotipo es idéntico, o para la preparación de una matriz celular constituida por células diferenciadas que conservan el mismo fenotipo y cultivadas en presencia de dichos inhibidores, y del medio extracelular segregado por dichas células y que une estas últimas en la matriz
Tipo: Patente Internacional (Tratado de Cooperación de Patentes). Resumen de patente/invención. Número de Solicitud: PCT/FR2002/002789.
Solicitante: CENTRE NATIONAL DE LA RECHERCHE SCIENTIFIQUE (CNRS)
UNIVERSITE CLAUDE BERNARD - LYON 1.
Nacionalidad solicitante: Francia.
Dirección: 3, RUE MICHEL-ANGE 75794 PARIS CEDEX 16 FRANCIA.
Inventor/es: FESSY, MICHEL-HENRI, DAMOUR NEE BAUDOUX,ODILE, SOMMER,PASCAL, FARJANEL,JEAN, BRAYE,FABIENNE.
Fecha de Publicación: .
Fecha Solicitud PCT: 2 de Agosto de 2002.
Clasificación Internacional de Patentes:
- A61L27/38 NECESIDADES CORRIENTES DE LA VIDA. › A61 CIENCIAS MEDICAS O VETERINARIAS; HIGIENE. › A61L PROCEDIMIENTOS O APARATOS PARA ESTERILIZAR MATERIALES U OBJECTOS EN GENERAL; DESINFECCION, ESTERILIZACION O DESODORIZACION DEL AIRE; ASPECTOS QUIMICOS DE VENDAS, APOSITOS, COMPRESAS ABSORBENTES O ARTICULOS QUIRURGICOS; MATERIALES PARA VENDAS, APOSITOS, COMPRESAS ABSORBENTES O ARTICULOS QUIRURGICOS (conservación de cuerpos o desinfección caracterizada por los agentes empleados A01N; conservación, p. ej. esterilización de alimentos o productos alimenticios A23; preparaciones de uso medico, dental o para el aseo A61K). › A61L 27/00 Materiales para prótesis o para revestimiento de prótesis (prótesis dentales A61C 13/00; forma o estructura de las prótesis A61F 2/00; empleo de preparaciones para la fabricación de dientes artificiales A61K 6/80; riñones artificiales A61M 1/14). › Células animales (para utilizar en piel artificial A61L 27/60).
- C12N5/06B16
- C12N5/06B20
Clasificación PCT:
- A61K35/32 A61 […] › A61K PREPARACIONES DE USO MEDICO, DENTAL O PARA EL ASEO (dispositivos o métodos especialmente concebidos para conferir a los productos farmacéuticos una forma física o de administración particular A61J 3/00; aspectos químicos o utilización de substancias químicas para, la desodorización del aire, la desinfección o la esterilización, vendas, apósitos, almohadillas absorbentes o de los artículos para su realización A61L; composiciones a base de jabón C11D). › A61K 35/00 Preparaciones medicinales que contienen sustancias de constitución indeterminada o sus productos de reacción. › Huesos; Osteocitos; Osteoblastos; Tendones; Tenocitos; Dientes; Odontoblastos; Cartílago; Condrocitos; Membrana sinovial.
- A61K35/36 A61K 35/00 […] › Piel; Sistema piloso; Uñas; Glándulas sebáceas; Cerumen; Epidermis; Células epiteliales; Queratinocitos; Células de Langerhans; Células del ectodermo (islotes de Langerhans A61K 35/39).
- C12N5/071 QUIMICA; METALURGIA. › C12 BIOQUIMICA; CERVEZA; BEBIDAS ALCOHOLICAS; VINO; VINAGRE; MICROBIOLOGIA; ENZIMOLOGIA; TECNICAS DE MUTACION O DE GENETICA. › C12N MICROORGANISMOS O ENZIMAS; COMPOSICIONES QUE LOS CONTIENEN; PROPAGACION, CULTIVO O CONSERVACION DE MICROORGANISMOS; TECNICAS DE MUTACION O DE INGENIERIA GENETICA; MEDIOS DE CULTIVO (medios para ensayos microbiológicos C12Q 1/00). › C12N 5/00 Células no diferenciadas humanas, animales o vegetales, p. ej. líneas celulares; Tejidos; Su cultivo o conservación; Medios de cultivo para este fin (reproducción de plantas por técnicas de cultivo de tejidos A01H 4/00). › Células o tejidos de vertebrados, p.ej. células o tejidos humanos.
- C12N5/077 C12N 5/00 […] › Células mesenquimales, p. ej. Células óseas, células cartilaginosas, Células del estroma de la médula ósea, células adiposas o células musculares.
- C12Q1/02 C12 […] › C12Q PROCESOS DE MEDIDA, INVESTIGACION O ANALISIS EN LOS QUE INTERVIENEN ENZIMAS, ÁCIDOS NUCLEICOS O MICROORGANISMOS (ensayos inmunológicos G01N 33/53 ); COMPOSICIONES O PAPELES REACTIVOS PARA ESTE FIN; PROCESOS PARA PREPARAR ESTAS COMPOSICIONES; PROCESOS DE CONTROL SENSIBLES A LAS CONDICIONES DEL MEDIO EN LOS PROCESOS MICROBIOLOGICOS O ENZIMOLOGICOS. › C12Q 1/00 Procesos de medida, investigación o análisis en los que intervienen enzimas, ácidos nucleicos o microorganismos (aparatos de medida, investigación o análisis con medios de medida o detección de las condiciones del medio, p. ej. contadores de colonias, C12M 1/34 ); Composiciones para este fin; Procesos para preparar estas composiciones. › en los que intervienen microorganismos vivos.
Clasificación antigua:
- A61K35/32 A61K 35/00 […] › Huesos; Osteocitos; Osteoblastos; Tendones; Tenocitos; Dientes; Odontoblastos; Cartílago; Condrocitos; Membrana sinovial.
- A61K35/36 A61K 35/00 […] › Piel; Sistema piloso; Uñas; Glándulas sebáceas; Cerumen; Epidermis; Células epiteliales; Queratinocitos; Células de Langerhans; Células del ectodermo (islotes de Langerhans A61K 35/39).
- C12N5/06
- C12Q1/02 C12Q 1/00 […] › en los que intervienen microorganismos vivos.
Países PCT: Austria, Bélgica, Suiza, Alemania, Dinamarca, España, Francia, Reino Unido, Grecia, Italia, Liechtensein, Luxemburgo, Países Bajos, Suecia, Mónaco, Portugal, Irlanda, Eslovenia, Finlandia, Rumania, Chipre, Lituania, Letonia, Ex República Yugoslava de Macedonia, Albania.
Fragmento de la descripción:
Utilización de inhibidores de las lisil oxidasas para el celular y la ingeniería tisular.
La presente invención tiene por objeto la utilización de inhibidores de las lisil-oxidasas en el marco de la realización de procedimientos de cultivo in vitro de células susceptibles de ser utilizadas en terapia tisular, o celular, o en farmacología experimental.
Las lisil-oxidasas son unas amina-oxidasas que inducen la reticulación de los colágenos y de la elastina catalizando la desaminación oxidativa de residuos lisilos e hidroxilisilos en α-aminoadipic-S-semialdehídos correspondientes (para revisión, Smith-Mango & Kagan, Matrix Biology 1998, 16: 387): RCH2NH2 + O2 + H2O
La reticulación dependiente de las LO de los colágenos y de elastina es un parámetro esencial de la formación de los tejidos y de los implantes neosintetizados in vitro: la ausencia de reticulación no permite la constitución de tejidos resistentes, demasiada reticulación (o una reticulación química inapropiada) provoca una rigidez demasiado grande y una retracción de los tejidos.
La presente invención resulta de la demostración por los inventores del hecho de que la adición de un inhibidor específico de las LO a unos condrocitos, células específicas del cartílago, permite anular la desdiferenciación de estas células. En efecto, el problema principal de la formación de implantes de cartílago por los condrocitos es que éstos se desdiferencian, y pierden su potencial para fabricar colágeno de cartílago (colágenos de tipo cartílago: II, IX, XI y X). Sin este inhibidor, los condrocitos desdiferenciados sintetizan unos tipos de colágenos anormales en el cartílago sano (I, III). La adición temporal del inhibidor de LO tiene por lo tanto un efecto importante y reversible en la formación del cartílago, cuyas propiedades físicas específicas están relacionadas con la presencia de los colágenos que lo constituyen.
Se sabe que el cultivo en gel de alginato permite evitar la desdiferenciación de los condrocitos y que la adición de β-aminopropionitrilo (βAPN) aumenta la síntesis global del colágeno y reduce su reticulación. (B. Beekman et al., Experimental Cell Research 1997, 237(1): 135-141). No se ha demostrado ningún efecto directo del βAPN sobre la diferenciación de las células y la ausencia de estudio detallado de los sub-tipos de colágeno no permite excluir la presencia minoritaria de colágeno I. Otros estudios han mostrado que la aplicación de βAPN sobre un explante de cartílago ya formado reducía su reticulación y concluyen en el interés de no utilizar ningún βAPN sobre un explante de cartílago para la reparación tisular. (Ahsan T et al., Journal of Orthopedic Research 1999, 17(6): 850-857).
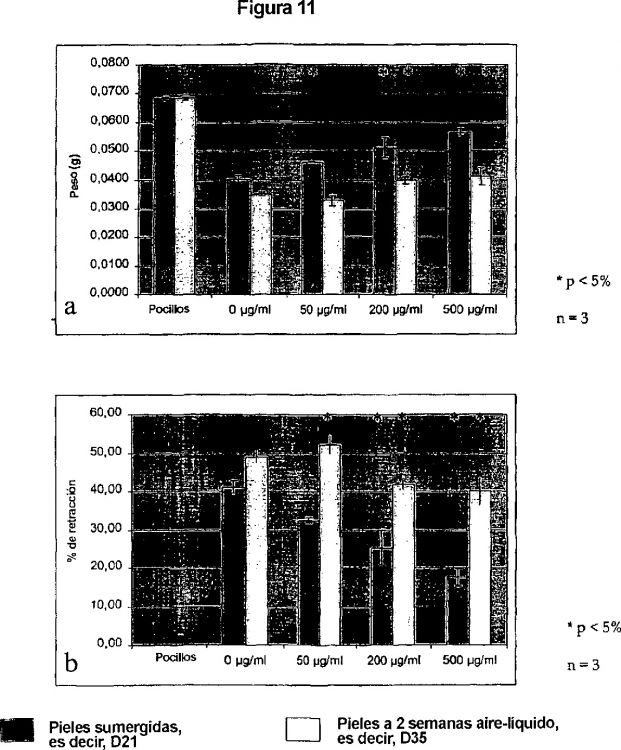
Además, los inventores han demostrado asimismo que la adición del mismo inhibidor de las LO durante la constitución de un modelo de piel reconstruida se traduce asimismo por un efecto sobre el fenotipo de las células. Los componentes celulares del modelo ensayado de piel reconstruida son unos fibroblastos y unos queratinocitos. Los fibroblastos sintetizan en particular los colágenos fibrilares (tipo I y III) y la elastina de la dermis, mientras que los queratinocitos se diferencian porque forman todas las capas de la epidermis hasta la capa córnea que asegura la función de barrera. En presencia del inhibidor de LO, se modifican las propiedades de la piel reconstruida. Se observa que la ausencia de reticulación de los colágenos permite una mejor colonización del soporte esponja por los fibroblastos y un aumento de la formación de la matriz extracelular, así como una disminución in vitro de la retracción de la piel reconstruida. Por otra parte, se observa una mejor organización de la epidermis, con una capa granulosa muy bien formada. La adición temporal de inhibidor de las LO tiene por lo tanto un efecto positivo en la gestión de la formación y de la organización de la piel reconstruida facilitando la preparación en gran cantidad de este material.
A partir de biopsias de cartílago, y en presencia de inhibidores de LO, los inventores han demostrado que resulta posible multiplicar unos condrocitos sobre un soporte plástico en 2 dimensiones en presencia de suero del donante según las condiciones clásicas, obteniendo al mismo tiempo la producción de una matriz extracelular libre de cualquier colágeno anormal, incluso después de 2 semanas de cultivo, y a pesar de una solubilización aumentada de los colágenos sintetizados en el medio de cultivo (figura 1, 2). Dicha matriz ve disminuir su fluidez a lo largo del tiempo de cultivo: se selecciona el tiempo de cultivo óptimo en función de la cantidad de matriz producida y de fluidez buscada. Resulta inútil entonces recurrir al uso de soportes exógenos de los que, ulteriormente, el rechazo o la resorción defectuosa eventuales anularían las propiedades favorables ya obtenidas.
En ausencia del inhibidor tipo de la actividad LO, el βAPN, la matriz extracelular está muy empobrecida en colágenos de tipo cartílago, y mayoritariamente constituida por colágenos de tipo I así como, para una pequeña parte, por colágeno de tipo III, es decir, por colágenos que no participan en la elaboración del cartílago. Además, la matriz presenta una ausencia de fluidez incompatible con el recurso eventual a unas inyecciones mediante jeringuilla.
La expresión de varias isoformas de lisil oxidasa (LOX y LOL1 por lo menos) por los condrocitos es manifiesta, pero no se modifica por el tratamiento mediante βAPN (figura 3) que inhibe sólo la actividad de la enzima (tabla I).
La adición de βAPN, utilizado a diferentes concentraciones (entre 50 y 200 μg/ml), permite la formación de pieles reconstruidas humanas cuya retracción puede ser disminuida in vitro. Además, el βAPN a 50 μg/ml mejora la colonización de la esponja por los fibroblastos y la extensión de la síntesis de la matriz extracelular. Mejora asimismo la organización de la epidermis, con una capa granulosa muy bien formada que genera una capa córnea muy estructurada. Este efecto sobre la diferenciación de la epidermis y la disminución de la retracción reducen la formación de hojas que se sueltan y pueden facilitar la preparación de piel reconstruida (figura 4).
La utilización de inhibidores de la actividad LO se puede aplicar a cualquier cultivo de células con el fin de obtener cualquier implante tisular, puesto que los colágenos y las LO son unos constituyentes y unos participantes ubiquitarios de todos los tejidos animales. Sin embargo, las condiciones de los cultivos pueden variar en función de los tipos celulares usados y de los sustratos diana.
La invención tiene por objeto la utilización de inhibidores directos o indirectos de las lisil-oxidasas (LO), como inhibidores de la desdiferenciación de las células en cultivo in vitro, con vistas al mantenimiento casi constante del fenotipo de dichas células en el marco de la realización de procedimientos de cultivo in vitro de estas últimas, y durante casi la totalidad del tiempo de cultivo.
Con este fin, la invención tiene muy particularmente por objeto la utilización de inhibidores mencionados anteriormente para la preparación de células diferenciadas cuyo fenotipo está preservado.
La invención se refiere más particularmente todavía a la utilización de inhibidores mencionados anteriormente para la preparación de una matriz celular, constituida por células diferenciadas cultivadas en presencia de dichos inhibidores, y del medio extracelular condicionado por dichas células y en contacto con dicha matriz, siendo dicha matriz celular susceptible de poder ser utilizada como tejidos o implantes tisulares.
La invención tiene asimismo por objeto la utilización mencionada anteriormente, de inhibidores de las LO seleccionadas de entre:
las...
Reivindicaciones:
1. Utilización de inhibidores directos de lisil-oxidasas (LO) seleccionados entre:
las aminas primarias que reaccionan con el grupo carbonilo del sitio activo de las LO, y más particularmente las que proporcionan, después de una unión al carbonilo, un producto estabilizado por resonancia, tales como las aminas primarias siguientes:
como inhibidores de la desdiferenciación de las células en cultivo in vitro, con vistas al mantenimiento constante del fenotipo de dichas células en el marco de la realización de un procedimiento de cultivo in vitro de estas últimas, y durante la totalidad del tiempo de cultivo, para la preparación de células diferenciadas cuyo fenotipo es idéntico, o para la preparación de una matriz celular constituida por células diferenciadas que conservan el mismo fenotipo y cultivadas en presencia de dichos inhibidores, y del medio extracelular segregado por dichas células y que une estas últimas en la matriz.
2. Utilización del βAPN como inhibidor de las LO según la reivindicación 1.
3. Utilización de inhibidores de LO según una de las reivindicaciones 1 a 2, para la realización de procedimientos de cultivo in vitro de cualquier célula de origen humano o animal, en la que dichas células son mantenidas a un fenotipo de diferenciación constante, y se seleccionan en particular de entre los condrocitos de los cartílagos, y las células de la córnea, las células de la piel (tales como los fibroblastos de la dermis, y los queratinocitos de la epidermis), las células endoteliales de los vasos, los osteoblastos de los huesos, los hepatocitos, las células renales, las células musculares, las células cepas o pluripotentes.
4. Utilización de inhibidores de LO según una de las reivindicaciones 1 a 3, para la realización de procedimientos de cultivo in vitro de células.
5. Utilización de inhibidores de LO según una de las reivindicaciones 1 a 3, para la realización de procedimientos de cultivo in vitro de células con vistas a obtener unos tejidos, tales como de la piel o de cartílago.
6. Procedimiento de cultivo in vitro de células tales como las definidas en la reivindicación 3, durante el cual el fenotipo de dichas células se mantiene en un estado idéntico al que se encontraban inicialmente dichas células durante su cultivo, comprendiendo dicho procedimiento el cultivo de dichas células en un medio apropiado que contiene uno o varios inhibidores de LO definidos en una de las reivindicaciones 1 a 2.
7. Procedimiento de preparación de células, o de implantes celulares, caracterizado porque comprende:
8. Procedimiento de preparación in vitro de una matriz celular tal como la definida en la reivindicación 1, susceptible de poder ser utilizada como tejidos o implantes tisulares, constituidos por células diferenciadas al fenotipo idéntico, caracterizado porque comprende:
9. Procedimiento de preparación in vitro de tejidos según la reivindicación 8, aplicado a la neosíntesis de implantes de cartílago cuando dicho procedimiento se efectúa a partir de condrocitos, o a la preparación de sustitutos cutáneos cuando dicho procedimiento se efectúa a partir de fibroblastos y/o de queratinocitos.
10. Procedimiento de cribado de moléculas de interés farmacológico, en particular de medicamentos, caracterizado porque comprende:
11. Implantes para la terapia celular que corresponden a unos implantes de suspensiones de condrocitos diferenciados, cuyo fenotipo inicial de tipo cartílago ha sido mantenido durante la fase preliminar de multiplicación celular in vitro, tales como los obtenidos mediante la realización de un procedimiento según la reivindicación 7.
12. Implantes para la terapia tisular de tipo cartílago, tales como los obtenidos mediante la realización de un procedimiento según la reivindicación 8 efectuado a partir de condrocitos, que comprenden una matriz extracelular exenta de colágenos normalmente ausentes del cartílago sano (a saber, los colágenos I y III), y que comprenden la totalidad de los colágenos específicos del cartílago (a saber, los colágenos II, IX, XI, y llegado el caso X).
13. Implantes de cartílago según la reivindicación 12, caracterizados porque contienen unos inhibidores de LO en el estado de trazas.
14. Implantes de piel reconstituida, o sustitutos cutáneos, tales como los obtenidos mediante la realización de un procedimiento según la reivindicación 10 efectuado a partir de fibroblastos y/o de queratinocitos, habiendo disminuido la superficie de dichos implantes 40% después de 35 días de cultivo con respecto a la superficie de partida.
Patentes similares o relacionadas:
Matriz de soporte de injerto para reparación de cartílago y procedimiento de obtención de la misma, del 1 de Julio de 2020, de ETH ZURICH: Un procedimiento de proporción de una matriz de soporte de injerto para reparación de cartílagos, particularmente en un paciente humano, que comprende las etapas de: […]
Métodos y dispositivos para trasplante celular, del 10 de Junio de 2020, de Sernova Corporation: Un dispositivo para implantar células en un cuerpo huésped, que comprende: un andamio poroso que comprende al menos una cámara que tiene un extremo proximal y un extremo […]
Reparación de tejido cartilaginoso, del 27 de Mayo de 2020, de CartiRegen B.V: Un método para la separación electroforética de células a partir de un tejido, comprendiendo el método: a) seccionar un tejido para preparar fragmentos de dicho tejido, […]
Procedimientos de preparación de un hidrogel esterilizado de modo terminal que proviene de matriz extracelular, del 22 de Abril de 2020, de UNIVERSITY OF PITTSBURGH OF THE COMMONWEALTH SYSTEM OF HIGHER EDUCATION: Un procedimiento de preparación de un material digerido de matriz extracelular esterilizado de modo terminal capaz de gelificar, que comprende: (i) solubilizar la matriz […]
Estructuras para trasplante celular, del 15 de Abril de 2020, de PRESIDENT AND FELLOWS OF HARVARD COLLEGE: Un dispositivo que comprende una composición de estructura que presenta macroporos abiertos e interconectados, y que es capaz de controlar en el tiempo […]
Espumas de fibroína de seda inyectables y usos de la misma, del 1 de Abril de 2020, de TRUSTEES OF TUFTS COLLEGE: Un aplicador de inyección que comprende una composición inyectable, la composición inyectable comprende una espuma de fibroína de seda comprimida que tiene […]
Procedimiento para la multiplicación del cabello in vivo, del 25 de Marzo de 2020, de Prostem International B.V: Procedimiento cosmético para la multiplicación del cabello in vivo, que comprende los pasos de: (a) proporcionar al menos una parte de un folículo piloso en la fase anágena, […]
Material biocompatible que presenta un tejido de nano- o microfibras no tejidas producido por procedimiento de electrohilado, del 25 de Marzo de 2020, de SUNSTAR SUISSE SA: Material biocompatible que comprende un tejido no tejido de nano- o microfibra biocompatible producido mediante electrohilado para su uso en el tratamiento de hueso […]