PROCESO DE EXTRACCIÓN MEJORADO.
Un proceso para aislar péptidos de bajo peso molecular ("LWM") a partir de tejido in situ caracterizado porque comprende las etapas de:
a) homogenizar el tejido; b) mezclar el tejido homogenizado con un solvente orgánico para formar una suspensión completamente húmeda; c) reposar o agitar la suspensión para desnaturalizar las proteínas in situ dentro del tejido; d) remover el solvente orgánico del tejido; e) mezclar el tejido tratado con solvente orgánico de la etapa d) con un volumen suficiente de agua o una solución acuosa para extraer los péptidos; f) separar un extracto líquido a partir del residuo de tejido de la etapa e) para obtener una solución acuosa que contiene la fracción de péptido de bajo peso molecular removida del tejido
Tipo: Patente Internacional (Tratado de Cooperación de Patentes). Resumen de patente/invención. Número de Solicitud: PCT/NZ2004/000058.
Solicitante: VELVET ANTLER RESEARCH NEW ZEALAND LIMITED.
Nacionalidad solicitante: Nueva Zelanda.
Dirección: AGRESEARCH NEW ZEALAND LIMITED, PUDDLE ALLEY MOSGIEL NUEVA ZELANDA.
Inventor/es: HAINES,Stephen.
Fecha de Publicación: .
Fecha Solicitud PCT: 19 de Marzo de 2004.
Clasificación Internacional de Patentes:
- C07K14/495 QUIMICA; METALURGIA. › C07 QUIMICA ORGANICA. › C07K PEPTIDOS (péptidos que contienen β -anillos lactamas C07D; ipéptidos cíclicos que no tienen en su molécula ningún otro enlace peptídico más que los que forman su ciclo, p. ej. piperazina diones-2,5, C07D; alcaloides del cornezuelo del centeno de tipo péptido cíclico C07D 519/02; proteínas monocelulares, enzimas C12N; procedimientos de obtención de péptidos por ingeniería genética C12N 15/00). › C07K 14/00 Péptidos con más de 20 aminoácidos; Gastrinas; Somatostatinas; Melanotropinas; Sus derivados. › Factor de crecimiento transformante (TGF).
- C07K14/65 C07K 14/00 […] › Factores de crecimiento de tipo insulina (Somatomedinas), p. ej. IGF-1, IGF-2.
Clasificación PCT:
- C07B63/00 C07 […] › C07B PROCESOS GENERALES DE QUIMICA ORGANICA; SUS APARATOS (preparación de ésteres de ácidos carboxílicos por telomerización C07C 67/47; procesos para la preparación de compuestos macromoleculares, p.ej. telomerzación C08F, C08G). › Purificación; Separación adaptada especialmente con el objetivo de recuperar los compuestos orgánicos (separación de compuestos ópticamente activos C07B 57/00 ); Empleo de aditivos; Empleo de aditivos.
- C07K1/14 C07K […] › C07K 1/00 Procedimientos generales de preparación de péptidos. › Extracción; Separación; Purificación.
- C07K1/30 C07K 1/00 […] › por precipitación.
- C07K14/495 C07K 14/00 […] › Factor de crecimiento transformante (TGF).
- C07K14/65 C07K 14/00 […] › Factores de crecimiento de tipo insulina (Somatomedinas), p. ej. IGF-1, IGF-2.
- C07K2/00 C07K […] › Péptidos con un número indeterminado de aminoácidos; Sus derivados.
Clasificación antigua:
- C07B63/00 C07B […] › Purificación; Separación adaptada especialmente con el objetivo de recuperar los compuestos orgánicos (separación de compuestos ópticamente activos C07B 57/00 ); Empleo de aditivos; Empleo de aditivos.
- C07K2/00 C07K […] › Péptidos con un número indeterminado de aminoácidos; Sus derivados.
Países PCT: Austria, Bélgica, Suiza, Alemania, Dinamarca, España, Francia, Reino Unido, Grecia, Italia, Liechtensein, Luxemburgo, Países Bajos, Suecia, Mónaco, Portugal, Irlanda, Eslovenia, Finlandia, Rumania, Chipre, Lituania, Letonia, Ex República Yugoslava de Macedonia, Albania.
PDF original: ES-2358110_T3.pdf




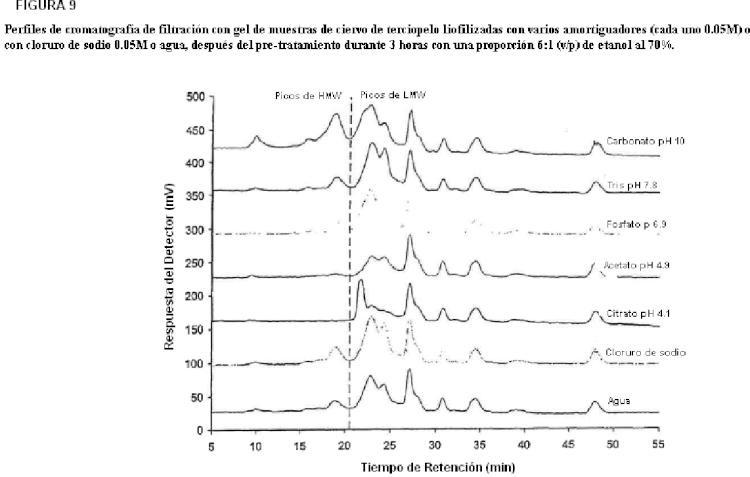
Fragmento de la descripción:
CAMPO DE LA INVENCIÓN
La presente invención se refiere a un proceso de extracción mejorado. En particular, la presente invención se refiere a un proceso de extracción mejorado para aislar péptidos de bajo peso molecular a partir de tejido animal.
ANTECEDENTES DE LA TÉCNICA
En los mercados de alimentos saludables y biomédicos existe una demanda creciente para extractos de productos animales que contienen niveles enriquecidos de factores de crecimiento y otros polipéptidos de bajo peso molecular. Esta demanda se deriva de la bioactividad intensificada, y solubilidad y estabilidad a menudo mayor, de polipéptidos más pequeños en relación a las proteínas más grandes presentes en el tejido u otra fuente de material. En particular, péptidos de bajo peso molecular y extractos del factor de crecimiento tienen propiedades que los hacen adecuados para un número de diversas aplicaciones que incluyen productos médicos (por ejemplo, cicatrización de herida), ingredientes en suplementos dietéticos, cosméticos y medios de crecimiento celular.
Se han desarrollado y usado una variedad de métodos estándares para extracción acuosa de tejidos animales ampliamente para aislar proteínas, Scopes R.K. (1987). Típicamente, la extracción acuosa involucra usar algún método para romper células, tal como ruptura por ultrasonido o mecánica (en una mezcladora), en la presencia de agua o una sal acuosa o amortiguador. El pH del sistema de extracción es algunas veces manipulado, o se usan detergentes y otros aditivos, para intensificar la solubilidad de proteínas objetivo específicas (por ejemplo, enzimas asociadas con la membrana). Sin embargo, típicamente el extracto de proteína total inicial contendrá proteína que tiene un intervalo amplio de pesos moleculares. Etapas de procesamiento adicionales son entonces requeridas para enriquecimiento selectivo de factores de crecimiento y otros polipéptidos de bajo peso molecular en los extractos de proteína total.
La producción comercial de extractos de tejido enriquecido con el factor de crecimiento enriquecidos con péptidos de bajo peso molecular requiere de métodos efectivos en costos, prácticos para remover proteínas de alto peso molecular no deseadas a partir de las mezclas. Los métodos actuales que son aplicables en una escala industrial para fraccionamiento de extractos de tejido y otro material derivado de animal (por ejemplo, sangre, leche, calostro), con enriquecimiento potencial de factores de crecimiento, incluyen:
Ultrafiltración
Cromatografía de filtración por gel (GFC)(también conocida como cromatografía de exclusión por tamaño)
Otros sistemas de fraccionamiento cromatográfico (por ejemplo, intercambio iónico, interacción hidrofóbica, afinidad)
División de fase líquida en sistemas multifásicos
Precipitación de solución acuosa (es decir, de la fase líquida) usando solventes orgánicos miscibles en agua (etanol, acetona), típicamente el solvente orgánico es enfriado en hielo algunas veces con la adición de solventes orgánicos inmiscibles (cloroformo) para intensificar el efecto de desnaturalización, Scopes, R.K. (1987).
Salazón con sales neutrales o aminoácidos
Sin embargo, en muchos casos estos métodos se han usado para aislar enzimas y otras proteínas moderadamente grandes, en lugar de la concentración de factores de crecimiento y otros péptidos. Por ejemplo, la precipitación usando etanol frío es la base del método de fraccionamiento Cohn tradicional para la preparación de albúmina y otras proteínas a partir de plasma.
Consecuentemente, estos métodos tienen las desventajas, o de otra forman no son apropiados, para enriquecimiento general de factores de crecimiento y otros polipéptidos de bajo peso molecular.
La ultrafiltración y GFC ambos requieren inversión de capital costoso, son sensibles a incrustación y este último resulta en dilución de la fracción de bajo peso molecular deseado. Otros sistemas de fraccionamiento cromatográfico pueden también ser costosos para operar, y tienden a ser usados para purificar péptidos específicos en lugar de aislar fracciones de alto o bajo peso molecular.
La división de fase líquida en sistemas de multifase (por ejemplo, extracción de punto de turbidez y sistemas acuosos de dos fases) es particularmente de uso cuando una proteína lábil (por ejemplo, una enzima) es el producto deseado ya que la proteína es retenida a través de todo el ambiente acuoso, Skopes R. K. (1987), Tani H. et al (1997). Esto ayuda con la retención de la actividad biológica de la molécula. La desventaja del método es que el producto deseado se obtiene en la presencia de grandes cantidades de detergentes, sales y/o polímeros solubles en agua los cuales pueden ser removidos. Esto se agrega al costo del proceso y frecuentemente necesita el uso de etapas adicionales tales como ultrafiltración.
Los otros métodos restantes también resultan en adición de grandes cantidades de otros químicos (solvente orgánico, aminoácidos o sales) los cuales pueden ser removidos a partir de la solución de polipéptido. Así como incrementar los costos debido a la necesidad de etapas de procesamiento adicionales, estas pueden introducir cuestiones de seguridad como en el caso del uso de grandes volúmenes de solventes inflamables y/o tóxicos. La manipulación segura y eventual eliminación de los solventes requiere el uso de instalaciones y equipamiento para procesamientos especialmente diseñados y típicamente muy costosos.
El documento US 6,093,402 describe extracto de citrus amanatsudaidai para aislar un péptido. El documento EP0273121 describe oligopéptidos extraídos de sangre de bovino a un método para su preparación y empleo. El documento WO97/00269 describe una familia de péptidos antimicrobianos lineales a partir del intestino de Mixina. El documento WO97/00269 también describe las secuencias químicas de estas proteínas.
Se reconoce que el término “comprende” puede, bajo jurisdicciones variadas, ser atribuido ya sea con un significado exclusivo o uno inclusivo. Para el propósito de esta especificación, y a menos que se note de otra forma, el término “comprende” debe tener un significado inclusivo, es decir, que debe ser tomado en el sentido de una inclusión de no solamente los componentes listados directamente en las referencias, sino también otros componentes o elementos no especificados. Este razonamiento también puede ser usado cuando el término “comprendido” o “que comprende” se usan en relación a una o más etapas en un método o proceso.
Es un objetivo de la presente invención hacer frente a los problemas precedentes o al menos proporcionar al público una opción útil.
Aspectos y ventajas adicionales de la presente invención pueden llegar a ser aparentes de la descripción consiguiente la cual se proporciona por medio de ejemplo únicamente.
BREVE DESCRIPCIÓN DE LA INVENCIÓN
Las deficiencias de estos métodos variados para remover proteínas más grandes de extractos de tejido, cuando los péptidos de bajo peso molecular son los péptidos de interés, lleva a los inventores a considerar una nueva alternativa. Es decir, la prevención de la disolución inicial de proteínas de fracción de alto peso molecular, por desnaturalización in situ dentro del tejido, por un solvente orgánico (preferiblemente etanol) antes de la extracción acuosa. El tratamiento de tejido sólido con solvente orgánico se ha usado previamente, pero específicamente para la deslipidación y deshidratación del tejido (Scopes, R.K. (1987), Betzing, H. et al (1975)) en lugar de intensificar la concentración de polipéptidos de bajo peso molecular en extractos acuosos subsecuentes. Consecuentemente, se requiere aislamiento adicional de los péptidos de LWM.
De conformidad con un aspecto de la presente invención, se proporciona un proceso para aislar péptidos de bajo peso molecular (“LWM”) de tejido in situ, que comprende las etapas de:
a) homogenizar el tejido;
b) mezclar el tejido homogenizado con un solvente orgánico para formar una suspensión completamente humedecida;
c) dejar reposar o agitar la suspensión para desnaturalizar las proteínas in situ dentro del tejido;
d) remover el solvente orgánico del tejido;
e)... [Seguir leyendo]
Reivindicaciones:
1. Un proceso para aislar péptidos de bajo peso molecular (“LWM”) a partir de tejido in situ caracterizado porque comprende las etapas de: a) homogenizar el tejido; b) mezclar el tejido homogenizado con un solvente orgánico para formar una suspensión completamente húmeda; c) reposar o agitar la suspensión para desnaturalizar las proteínas in situ dentro del tejido;
d) remover el solvente orgánico del tejido; e) mezclar el tejido tratado con solvente orgánico de la etapa d) con un volumen suficiente de agua o una solución acuosa para extraer los péptidos;
f) separar un extracto líquido a partir del residuo de tejido de la etapa e) para obtener una solución acuosa que contiene la fracción de péptido de bajo peso molecular removida del tejido.
2. Un proceso como se reivindica de conformidad con la reivindicación 1, caracterizado porque previo a emprender la etapa a) el tejido se seca en una pre-etapa.
3. Un proceso como se reivindica de conformidad con la reivindicación 2, caracterizado porque el tejido es liofilizado.
4. Un proceso como se reivindica de conformidad con la reivindicación 1, caracterizado porque el solvente orgánico de la etapa b) es etanol.
5. Un proceso como se reivindica de conformidad ya sea con la reivindicación 1 o reivindicación 4, caracterizado porque el solvente orgánico en la etapa b) es 70% de etanol.
6. Un proceso como se reivindica de conformidad con ya sea la reivindicación 1 o reivindicación 4, caracterizado porque el solvente orgánico en la etapa b) es etanol que tiene una concentración de sustancialmente entre 50%-80% de etanol.
7. Un proceso como se reivindica de conformidad con ya sea la reivindicación 1 o reivindicación 4, caracterizado porque el solvente orgánico en la etapa b) es etanol que tiene una concentración de sustancialmente entre 60%-70% de etanol.
8. Un proceso como se reivindica de conformidad con la reivindicación 1, caracterizado porque el solvente orgánico de la etapa b) es etanol absoluto el cual se agrega al tejido homogenizado para proporcionar un contenido de agua total de aproximadamente 30% con respecto al volumen de etanol.
9. Un proceso como se reivindica de conformidad con la reivindicación 1, caracterizado porque en la etapa c) la suspensión se deja reposar o se agita por un periodo de al menos sustancialmente 1 hora.
10. Un proceso como se reivindica de conformidad con la reivindicación 1, caracterizado porque en la etapa c) la suspensión se deja reposar o se agita por un periodo de sustancialmente 3 horas o más.
11. Un proceso como se reivindica en ya se la reivindicación 9 o reivindicación 10, caracterizado porque la suspensión se deja reposar o se agita a temperatura ambiente entre 10-30°C.
12. Un proceso como se reivindica de conformidad con la reivindicación 1, caracterizado porque comprende la etapa adicional d1) en donde el tejido tratado con solvente de la etapa d) es completamente secado previo a emprender la etapa e).
13. Un proceso como se reivindica en ya se la reivindicación 1 o reivindicación 12, caracterizado porque el tejido tratado con solvente orgánico de las etapas d) o d1) se mezcla con agua o solución acuosa por sustancialmente 1 hora.
14. Un proceso como se reivindica de conformidad con la reivindicación 13, caracterizado porque el mezclado se realiza a temperatura ambiente la cual no excede 30°C.
15. Un proceso como se reivindica de conformidad con la reivindicación 1, caracterizado porque comprende la etapa adicional g) en donde las etapas e) a f) son repetidas una o más veces, para mejorar el rendimiento de extracto líquido del residuo de tejido de la etapa e).
16. Un proceso como se reivindica en ya se la reivindicación 1 o reivindicación 15, caracterizado porque el extracto líquido de las etapas f) o g) se seca para obtener un extracto de péptido de bajo peso molecular.
17. Una mezcla aislada de péptidos de bajo peso molecular caracterizada porque se obtiene por el proceso de conformidad con la reivindicación 1.
18. El uso de un solvente orgánico para desnaturalizar proteínas in situ dentro del tejido como parte de un proceso de
extracción para aislar un extracto de péptido de bajo peso molecular del tejido.
19. Una mezcla aislada de péptidos de bajo peso molecular caracterizada porque se obtiene a partir de ciervo de terciopelo.
Patentes similares o relacionadas:
Proteínas de fusión terapéuticas dirigidas de enzima lisosómica y usos de las mismas, del 7 de Noviembre de 2019, de BIOMARIN PHARMACEUTICAL INC: Una proteína de fusión terapéutica dirigida que comprende (a) una enzima lisosómica, (b) un marcador peptídico que tiene una secuencia de aminoácidos al menos un 70% […]
Polipéptidos de factor de crecimiento insulínico estabilizados, del 21 de Agosto de 2019, de NOVARTIS AG: Un polipéptido que comrpende una proteína de IGF-1 humano, donde el aminoácido glicina en la posición 42 de dicha proteína de IGF-1 se muta a serina, y donde la numeración […]
Producción de proteínas terapéuticas en células de mamífero modificadas genéticamente, del 24 de Abril de 2019, de NOVARTIS AG: Un metodo para producir una proteina terapeutica en una celula de mamifero que expresa de forma endogena un receptor cognado de dicha proteina terapeutica […]
Proteínas de fusión terapéuticas dirigidas de enzima lisosómica y usos de las mismas, del 30 de Mayo de 2018, de BIOMARIN PHARMACEUTICAL INC: Una proteína de fusión terapéutica dirigida que comprende (a) una enzima lisosómica, (b) un marcador peptídico que tiene una secuencia de aminoácidos al menos un […]
Proteínas de fusión dirigidas/inmunomoduladoras y métodos de preparación de las mismas, del 30 de Mayo de 2018, de BIOCON LIMITED: Una proteína de fusión quimérica que consiste en un resto de direccionamiento para dirigir a una célula cancerosa, un resto inmunomodulador que contrarresta […]
Métodos para acoplar péptidos direccionadores a enzimas lisosomales recombinantes para optimizar los tratamientos de las enfermedades por depósito lisosomal, del 22 de Noviembre de 2017, de AMICUS THERAPEUTICS, INC: Un método para preparar un péptido direccionador conjugado con una enzima lisosomal recombinante, método que comprende lo siguiente: (a) […]
Un anticuerpo que se une específicamente al factor de crecimiento insulinoide 1, del 14 de Junio de 2017, de F. HOFFMANN-LA ROCHE AG: Un anticuerpo aislado que se une a un epítopo comprendido dentro de los aminoácidos 76-84 (SEQ ID NO: 3) del precursor del factor de crecimiento […]
Supresión del cáncer, del 29 de Marzo de 2017, de Ipsen Bioinnovation Limited: Un polipéptido, para uso en la supresión o tratamiento del cáncer mediante la inhibición de la secreción autocrina de una célula cancerosa en un paciente, […]