PEROXIDASAS MEJORADAS.
Peroxidasas mejoradas.La presente invención se refiere a peroxidasas fúngicas mejoradas en su capacidad para oxidar compuestos fenólicos.
Dicha mejora se obtiene mediante un procedimiento basado en la identificación de aminoácidos específicos del canal principal de acceso al hemo y su modificación mediante técnicas de mutagénesis. La modificación de dichos aminoácidos en la peroxidasa versátil del hongo Pleurotus eryngii, consistente en la sustitución por residuos sin cadena lateral y/o con menor carga electrostática positiva, aumentó la eficiencia catalítica de dicha peroxidasa hasta nueve veces. Las peroxidasas mejoradas según la invención son de interés como biocatalizadores para aquellas aplicaciones industriales o medioambientales que requieran la modificación oxidativa de compuestos fenólicos en los sectores de la alimentación, detergentes, textil y químico, y en particular los relacionados con el aprovechamiento de los materiales lignocelulósicos
Tipo: Patente de Invención. Resumen de patente/invención. Número de Solicitud: P200801292.
Solicitante: CONSEJO SUPERIOR DE INVESTIGACIONES CIENTIFICAS (CSIC).
Nacionalidad solicitante: España.
Provincia: MADRID.
Inventor/es: GUTIERREZ SUAREZ,ANA, MARTINEZ HERNANDEZ,MARIA JESUS, MARTINEZ FERRER,ANGEL TOMAS, DEL RIO ANDRADE,JOSE CARLOS, RENCORET PAZO,JORGE, RUIZ DUEÑAS,FRANCISCO J, MORALES ESTEBAN,MARIA.
Fecha de Solicitud: 6 de Mayo de 2008.
Fecha de Publicación: .
Fecha de Concesión: 18 de Abril de 2011.
Clasificación Internacional de Patentes:
- C12N15/11 QUIMICA; METALURGIA. › C12 BIOQUIMICA; CERVEZA; BEBIDAS ALCOHOLICAS; VINO; VINAGRE; MICROBIOLOGIA; ENZIMOLOGIA; TECNICAS DE MUTACION O DE GENETICA. › C12N MICROORGANISMOS O ENZIMAS; COMPOSICIONES QUE LOS CONTIENEN; PROPAGACION, CULTIVO O CONSERVACION DE MICROORGANISMOS; TECNICAS DE MUTACION O DE INGENIERIA GENETICA; MEDIOS DE CULTIVO (medios para ensayos microbiológicos C12Q 1/00). › C12N 15/00 Técnicas de mutación o de ingeniería genética; ADN o ARN relacionado con la ingeniería genética, vectores, p. ej. plásmidos, o su aislamiento, su preparación o su purificación; Utilización de huéspedes para ello (mutantes o microorganismos modificados por ingeniería genética C12N 1/00, C12N 5/00, C12N 7/00; nuevas plantas en sí A01H; reproducción de plantas por técnicas de cultivo de tejidos A01H 4/00; nuevas razas animales en sí A01K 67/00; utilización de preparaciones medicinales que contienen material genético que es introducido en células del cuerpo humano para tratar enfermedades genéticas, terapia génica A61K 48/00; péptidos en general C07K). › Fragmentos de ADN o de ARN; sus formas modificadas (ADN o ARN no empleado en tecnología de recombinación C07H 21/00).
- C12N9/08 C12N […] › C12N 9/00 Enzimas, p. ej. ligasas (6.); Proenzimas; Composiciones que las contienen (preparaciones para la limpieza de los dientes que contienen enzimas A61K 8/66, A61Q 11/00; preparaciones de uso médico que contienen enzimas A61K 38/43; composiciones detergentes que contienen enzimas C11D ); Procesos para preparar, activar, inhibir, separar o purificar enzimas. › actúan sobre el peróxido de hidrógeno como aceptor (1.11).
- C12R1/645 C12 […] › C12R SISTEMA DE INDEXACION ASOCIADO A LAS SUBCLASES C12C - C12Q, RELATIVO A LOS MICROORGANISMOS. › C12R 1/00 Microorganismos. › Hongos.
- D21C5/00B
Clasificación PCT:
- C12N15/53 C12N 15/00 […] › Oxidorreductasas (1).
- C12N9/08 C12N 9/00 […] › actúan sobre el peróxido de hidrógeno como aceptor (1.11).
- D21C9/10 TEXTILES; PAPEL. › D21 FABRICACION DEL PAPEL; PRODUCCION DE LA CELULOSA. › D21C PRODUCCION DE CELULOSA POR ELIMINACION DE SUSTANCIAS NO CELULOSICAS DE LAS MATERIAS QUE CONTIENEN LA CELULOSA; REGENERACION DE LIQUIDOS RESIDUALES; APARATOS PARA ESTE EFECTO. › D21C 9/00 Post-tratamiento de la pasta de celulosa, p. ej. de la pasta de madera, o de las borras de algodón. › Blanqueamiento.
PDF original: ES-2342701_B1.pdf
Fragmento de la descripción:
Peroxidasas mejoradas.
Sector de la técnica
El campo de la invención es el de las peroxidasas mejoradas en su actividad catalítica. El sector de la técnica es por tanto el de las enzimas así como los procesos para obtener y mejorar las mismas, y más específicamente el de las oxidorreductasas que utilizan el peróxido de hidrógeno (H2O2) u otros hidroperóxidos como aceptares finales de electrones (peroxidasas). La mejora se logra preferentemente a través de procesos de mutagénesis dirigida, mutagénesis saturante o evolución dirigida, por lo que la invención se encuadra también en el campo de la tecnología del ADN recombinante. El área de aplicación de la invención es la de la biotecnología y, más específicamente, el uso de enzimas como catalizadores en procesos industriales relacionados con la transformación de la biomasa lignocelulósica, la obtención de biocombustibles, el sector alimenticio, el desarrollo de detergentes, la producción textil y el sector químico, así como en el procesamiento de los efluentes originados en dichos procesos.
Estado de la técnica
Las peroxidasas (EC 1.11.1) tienen una amplia utilización industrial en formulación de detergentes, procesamiento de alimentos y bebidas, kits analíticos, biosensores, etc, así como un amplio futuro para el desarrollo de diferentes biocatalizadores industriales y medioambientales. Estas enzimas son oxidorreductasas que utilizan H2O2 u otros hidroperóxidos como oxidantes divalentes de la enzima, siendo la enzima activada capaz de catalizar sucesivamente dos oxidaciones monovalentes de diferentes compuestos aromáticos, colorantes, iones metálicos y otros sustratos. Dicha catálisis se lleva a cabo a través del grupo hemo, una protoporfirina IX con un átomo de hierro que actúa como cofactor de la mayoría de las peroxidasas y que está situado en una cavidad central conectada a la superficie de la enzima por uno o varios canales que permiten el acceso de los sustratos a este centro catalítico (Dunford. Heme peroxidases. Wiley-VCH, New York, 1999).
Las peroxidasas se han dividido en dos superfamilias: i) las peroxidasas animales; y ii) las peroxidasas bacterianas (Clase I, intracelulares), fúngicas (Clase II, extracelulares) y de plantas (Clase III, extracelulares) (Welinder. Superfamily of plant, fungal and bacterial peroxidases. Curr. Opin. Struct. Biol. 2: 388-393. 1992), Las peroxidasas de plantas han sido las más estudiadas, especialmente la del rábano picante (Armoracia rusticana) conocida por sus siglas en inglés (HRP) pero son las fúngicas las que presentan mayor potencial biotecnológico. Dicho potencial se debe a que esta clase incluye las peroxidasas de los basidiomicetos ligninolíticos, caracterizadas por su elevado potencial redox. Esta característica les permite oxidar el polímero de lignina, y otros sustratos aromáticos y colorantes recalcitrantes que no pueden ser oxidados por otras peroxidasas o por las lacasas (enzimas de tipo fenoloxidasa producidas por hongos y otros organismos) (Martínez, A.T., et al. Biodegradation of lignocellulosics: Microbiological, chemical and enzymatic aspects of fungal attack to lignin. Intern. Microbiol. 8: 195-204. 2005).
Las peroxidasas fúngicas de alto potencial redox incluyen tres familias: lignina peroxidasas (LiP), manganeso peroxidasas (MnP) y peroxidasas versátiles (VP, de sus siglas en inglés). Las LiP (EC 1.11.1.13) se caracterizan por su capacidad para oxidar dímeros de lignina de tipo no fenólico y otros compuestos aromáticos de alto potencial redox, siendo el alcohol veratrílico el sustrato habitualmente utilizado para medir su actividad. Las MnP (EC 1.11.1.14) oxidan específicamente el Mn2+ a Mn3+ y éste, al quelarse con ácidos orgánicos sintetizados por los hongos, actúa como un oxidante difusible durante la degradación de la lignina en la pared vegetal, aunque no es capaz de oxidar directamente sus unidades no fenólicas. Las VP (EC 1.11.1.16) descritas recientemente en especies de Pleurotus y Bjerkandera (Martínez, A.T. Molecular biology and structure-function of lignin-degrading heme peroxidases. Enzyme Microb. Technol. 30: 425-444. 2002) combinan las propiedades catalíticas de la LiP y la MnP y de ciertas peroxidasas de plantas, lo que le confiere una gran versatilidad y potencial biotecnológico (Martínez, A.T. High redox potential peroxidases, En Polaina y MacCabe (Eds.) Industrial Enzymes: Structure, Function and Applications. Springer, Berlin, pags. 475-486, 2007).
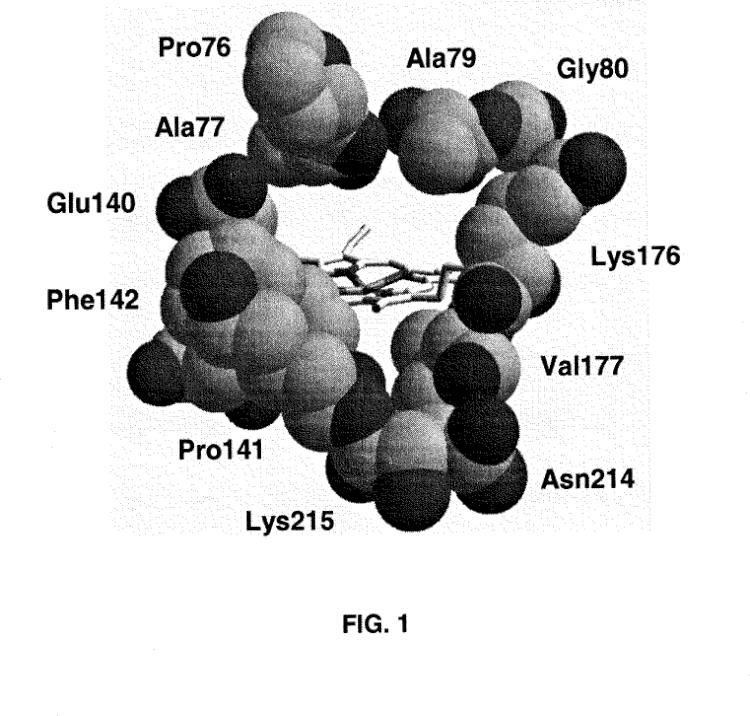
Las peroxidasas de alto potencial redox y otras peroxidasas de basidiomicetos (que forman parte de la Clase II) presentan estructuras moleculares altamente conservadas (resueltas por difracción de rayos X) aun presentando identidades en sus secuencias aminoacídicas de sólo 40-50% en diferentes casos (e identidades en sus secuencias nucleotídicas lógicamente aun inferiores). Dichas semejanzas estructurales afectan tanto a la topología general de la macromolécula como al centro activo y a diferentes regiones de la enzima (incluyendo el canal principal de acceso al hemo al que se hace referencia en la presente invención) y, aunque en grados inferiores, se extienden también a las peroxidasas de plantas (Clase III) como la HRP, e incluso a las peroxidasas de origen procariota (Clase I) como la citrocromo c peroxidasa.
La VP mejor caracterizada es la de Pleurotus eryngii (conocido como "seta de cardo"), un hongo modelo para los estudios de degradación selectiva de la lignina. Su caracterización ha comprendido análisis espectroscópicos y cristalográficos y la aplicación de mutagénesis dirigida, lo que ha convertido a la VP en un modelo tanto para el estudio de mecanismos generales de la catálisis por peroxidasas como para el establecimiento de las bases estructurales de sus propiedades catalíticas únicas (Ruiz-Dueñas, F. J. et al. Structure-function studies of Pleurotus versatile peroxidase, A model ligninolytic enzyme. Proc. OxiZymes in Oeiras, 7-9 September, Oeiras, Portugal. 2006). Estos estudios han permitido demostrar por primera vez la existencia de un radical de proteína en una peroxidasa fúngica (Pogni, R. et al. A tryptophan neutral radical in the oxidized state of versatile peroxidase from Pleurotus eryngii: a combined multi-frequency EPR and DFT study. J. Biol. Chem. 281: 9517-9526. 2006) y establecer las bases estructurales de su actividad sobre sustratos de alto potencial redox y de la oxidación del Mn2+ a Mn3+ (Pérez-Boada, M. et al. Versatile peroxidase oxidation of high redox potential aromatic compounds: Site-directed mutagenesis, spectroscopic and crystallographic investigations of three long-range electrón transfer pathways. J. Mol. Biol. 354: 385-402. 2005; Ruiz-Dueñas, F.J. et al. Manganese oxidation site in Pleurotus eryngii versatile peroxidase: A site-directed mutagenesis, kinetic and crystallographic study. Biochemistry 46: 66-77. 2007).
Las reacciones sobre los sustratos aromáticos de alto potencial redox y sobre el Mn2+ tienen lugar en dos sitios catalíticos distintos de la VP. Los estudios recientes de los autores de la presente invención indican la existencia de un tercer sitio catalítico implicado en la oxidación de fenoles, situado en el canal principal de acceso al grupo hemo. La presente invención consiste tanto en un procedimiento para aumentar la eficiencia catalítica de peroxidasas de clase II oxidando fenoles, basado en la mutación de los aminoácidos que forman el canal principal de acceso de los sustratos hasta el grupo hemo, como en las variantes de VP con mayor eficiencia catalítica sobre diversos sustratos fenólicos obtenidas por aplicación de dicho procedimiento y las secuencias de ADN que codifican estas proteínas.
Descripción detallada de la invención
La presente invención se basa en la identificación por los inventores de varios sitios catalíticos diferentes en la VP de P. eryngii, incluyendo un sitio para la oxidación del Mn2+ junto al propionato interno del hemo, otro para la oxidación de sustratos de alto potencial redox en un triptófano superficial y un tercero para la oxidación de sustratos fenólicos. Este tercer sitio catalítico está situado en el canal principal de acceso al grupo hemo de dicha enzima y los inventores han demostrado que ciertas mutaciones en dicho canal, que amplían su apertura y reducen su carga electrostática positiva, inducen un incremento de la eficiencia catalítica de la VP oxidando diferentes fenoles.
La presente invención comprende... [Seguir leyendo]
Reivindicaciones:
1. Procedimiento para la obtención de peroxidasas de hongos con mayor eficiencia catalítica para oxidar compuestos fenólicos que las peroxidasas naturales, caracterizado por que se modifican los residuos de aminoácidos que forman el canal principal de acceso de los sustratos hasta el grupo hemo.
2. Procedimiento según la reivindicación anterior caracterizado por que las modificaciones de los residuos aminoacídicos del canal del hemo se diseñan tras analizar la estructura molecular real o teórica de la enzima, o tras un simple alineamiento de la secuencia de aminoácidos; e incluyen mutaciones simples (sustitución de un sólo residuo aminoacídico) o múltiples (sustitución de varios residuos de aminoácidos) con el propósito de modificar el tamaño del canal de acceso al hemo, su carga electrostática o una combinación de ambos.
3. Procedimiento según la reivindicación anterior caracterizado por que las modificaciones de los residuos aminoacídicos del canal del hemo incluyen el acortamiento o la eliminación de cadenas laterales, con el propósito de ampliar dicho canal.
4. Procedimiento para la mejora de diferentes peroxidasas según la reivindicación 2 caracterizado por que las modificaciones de los residuos aminoacídicos del canal del hemo incluyen la modificación de la carga electrostática y se lleva a cabo por sustitución de residuos ácidos por básicos y viceversa, así como por la sustitución de los tipos an- teriores por residuos neutros (sin carga), o la sustitución de este último tipo de residuos neutros por residuos cargados.
5. Procedimiento para la mejora de diferentes peroxidasas según cualquiera de las reivindicaciones anteriores caracterizado por que las modificaciones de los residuos aminoacídicos del canal del hemo se consigue mediante el procedimiento de mutagénesis dirigida, basado en el diseño racional y la mutagénesis puntual de uno o varios residuos aminoacídicos mediante PCR (reacción en cadena de la polimerasa) o por el procedimiento de mutagénesis saturante combinatoria (basado en la sustitución de residuos seleccionados por todos los posibles aminoácidos en todas las combinaciones posibles).
6. Procedimiento según la reivindicación 1 caracterizado por que las modificaciones de los residuos aminoacídicos del canal del hemo se consigue mediante el procedimiento denominado de evolución dirigida, basado en ciclos sucesivos de mutación al azar y selección de los mejores transformantes utilizando un sistema de expresión adecuado, así como mediante la aplicación de este método conjuntamente con el de mutagénesis dirigida o saturante mencionadas en la reivindicación anterior.
7. Procedimiento según cualquiera de las reivindicaciones 1 a 6 caracterizado por que las peroxidasas mejoradas se obtienen tras expresión del ADNc o ADN genómico que codifica cualquiera de estas peroxidasas en un sistema de expresión de tipo eucariota como especies fúngicas de los géneros Aspergillus, Emericella, Fusarium, Trichoderma, Pycnoporus, Pichia y Saccharomyces, especies de plantas o cultivos de células de insectos.
8. Procedimiento según cualquiera de las reivindicaciones 1 a 6 caracterizado por que las peroxidasas mejoradas se obtienen tras expresión del ADNc o ADN genómico que codifica cualquiera de estas peroxidasas en un sistema de expresión de tipo procariota como Escherichia coli y especies del género Bacillus.
9. Peroxidasa (EC 1.11.1) fúngica caracterizada por que, respecto a su forma natural, presenta al menos una modificación de uno de los residuos de aminoácidos que forman el canal principal de acceso de los sustratos hasta el grupo hemo y por que presenta una mayor eficiencia catalítica para oxidar compuestos fenólicos.
10. Peroxidasa según la reivindicación anterior caracterizada por que su forma natural pertenece al grupo formado por las enzimas: i) clasificadas como peroxidasa versátil (EC 1.11.1.16); ii) clasificadas como lignina peroxidasa (EC 1.11.1.13); iii) clasificadas como manganeso peroxidasa (EC 1.11.1.14); iv) clasificadas como simplemente peroxidasa (EC 1.11.1.7); y v) con una denominación no recogida en la clasificación de enzimas.
11. Peroxidasa según la reivindicación anterior caracterizada por que la forma natural procede de un hongo perteneciente al grupo de los basidiomicetos.
12. Peroxidasa según la reivindicación anterior caracterizada por que la forma natural procede de una especie cualquiera de los géneros pertenecientes al grupo formado formado por: Agaricus, Bjerkandera, Ceriporiopsis, Dichomitus, Ganoderma, Phanerochaete, Phlebia, Pleurotus, Pycnoporus y Trametes.
13. Peroxidasa según la reivindicación anterior caracterizada por que la forma natural procede de una especie del grupo formado por: Pleurotus eryngii, Pleurotus pulmonarius, Pleurotus ostreatus, Bjerkandera adusta y Phanerochaete chrysosporium.
14. Peroxidasa según la reivindicación anterior caracterizada por que la forma natural procede de una cepa fúngica perteneciente al grupo formado por: CBS 613.91 (Pleurotus eryngii), CBS 507.85 (Pleurotus pulmonarius), CBS 411.71 (Pleurotus ostreatus), CBS 230.93 (Bjerkandera adusta), BOS55 de la Universidad de Wageningen (Bjerkandera sp), RP-78 del JGI (Phanerochaete chrysosporium) y CSP #776985 del JGI (Pleurotus ostreatus).
15. Peroxidasa según cualquiera de las reivindicaciones 10 y 11 derivada de las secuencias de aminoácidos depositadas en las bases de datos de proteínas pertenecientes al grupo formado por: 1906181 A, AAA33736, AAA33738, AAA33739, AAA33741, AAA33744, AAA33745, AAA34049, AAA53109, AAA56852, AAA84396, AAB03480, AAB39652, AAB63460, AAD01401, AAD01404, AAD43581, AAD45725, AAD46494, AAD54310, AAF31329, AAF31330, AA047909, AA061784, AAU82081, BAD52441, ABB77243, ABB77244, BAA33449, BAA88392, BAC06185, BAC06186, BAC06187, CAA33621, CAA50060, CAA53333, CAA54398, CAA83147, CAA83148, CAA91043, CAB51617, CAC84573, CAC85963, CAD56164, CAG27835, CAJ01576, AAZ04666 y P20010.
16. Peroxidasa según cualquiera de las reivindicaciones 10 y 11 caracterizada por que su secuencia de aminoácidos presenta al menos un 40% de identidad, y preferentemente más de un 50% de identidad, con alguna de las secuencias indicadas en la reivindicación anterior.
17. Peroxidasa según la reivindicación 13, caracterizada por que su forma natural corresponde a una peroxidasa versátil de Pleurotus eryngii.
18. Peroxidasa según la reivindicación anterior, caracterizada por que, antes de su modificación, su secuencia comprende la secuencia SEQ ID NO.2.
19. Peroxidasa según la reivindicación 18, caracterizada por que las modificaciones comprenden la sustitución de al menos un aminoácido del grupo siguiente: Prolina en la posición 76, Ácido Glutámico en la posición 140, Prolina en la posición 141, Fenilalanina en la posición 142, Usina en la posición 176 y Usina en la posición 215.
20. Peroxidasa según cualquiera de las reivindicaciones 18 y 19, caracterizada por que las modificaciones de la secuencia SEQ ID NO.2 comprenden al menos una sustitución seleccionada del grupo siguiente: Acido Glutámico de la posición 140 por Glicina, Prolina de la posición 141 por Glicina, Usina de la posición 176 por Glicina, Usina de la posición 176 por Acido Aspártico, Usina de la posición 215 por Glutamina o una combinación de dos o más de dichas sustituciones.
21. Polinucleótido capaz de codificar una peroxidasa según cualquiera de las reivindicaciones 9 a 20.
22. Polinucleótido según la reivindicación anterior, caracterizado por que resulta de la modificación de una secuencia de nucleótidos que, antes de dicha modificación, comprende la secuencia SEQ ID NO. 1.
23. Polinucleótido según la reivindicación 21, caracterizado por que resulta de la modificación de una secuencia de nucleótidos que, antes de dicha modificación, comprende una secuencia con al menos un 30% de identidad, y preferentemente más de un 40% de identidad, con la secuencia SEQ ID NO.1, o polinucleótido sintético preparado de acuerdo con dicha secuencia modificada.
24. Vector recombinante que comprende un polinucleótido definido según cualquiera de las reivindicaciones 21 a 23.
25. Célula transformada, caracterizada por que es capaz de producir una peroxidasa definida según cualquiera de las reivindicaciones 9 a 20.
26. Uso de la peroxidasa definida según cualquiera de las reivindicaciones 9 a 20 en procesos industriales o medioambientales de oxidación de compuestos fenólicos.
27. Uso según la reivindicación anterior caracterizado por que el compuesto fenólico pertenece al grupo siguiente: metoxifenoles, hidroquinonas o mezclas complejas de fenoles incluyendo efluentes industriales.
28. Uso según las reivindicaciones 26 ó 27 caracterizado por que las peroxidasas se aplican directamente, o formando parte de sistemas enzima-mediador, en la transformación de la biomasa lignocelulósica, el tratamiento de efluentes, la modificación de ligninas, la polimerización de fenoles, la obtención de biocombustibles, la funcionalización de fibras de celulosa, la coloración de fibras textiles, la síntesis química, el procesamiento de alimentos y bebidas, la producción de detergentes enzimáticos, la obtención de kits analíticos y la fabricación de biosensores.
Patentes similares o relacionadas:
Proteínas del factor VIII que tienen secuencias ancestrales, vectores de expresión, y usos relacionados con ellos, del 15 de Julio de 2020, de EMORY UNIVERSITY: Una proteína FVIII recombinante o quimérica que comprende una o más mutaciones ancestrales y una eliminación del dominio B, y en donde la secuencia […]
Método para romper un ácido nucleico y añadir un adaptador por medio de transposasa y reactivo, del 1 de Julio de 2020, de MGI Tech Co., Ltd: Un metodo para romper un acido nucleico y anadir un adaptador por medio de una transposasa, que comprende las siguientes etapas: interrumpir […]
Vacuna subunitaria contra Mycoplasma spp., del 1 de Julio de 2020, de Agricultural Technology Research Institute: Una composición para prevenir una infección por Mycoplasma spp., que comprende: un principio activo, que comprende una proteína de PdhA; y un adyuvante […]
Composiciones para modular la expresión de SOD-1, del 24 de Junio de 2020, de Biogen MA Inc: Un compuesto antisentido según la siguiente fórmula: mCes Aeo Ges Geo Aes Tds Ads mCds Ads Tds Tds Tds mCds Tds Ads mCeo Aes Geo mCes Te (secuencia […]
Oligonucleótidos para tratar una enfermedad ocular, del 13 de Mayo de 2020, de ProQR Therapeutics II B.V: Un oligonucleótido antisentido (OAS) que es capaz de inducir omisión del pseudoexón 40 (PE40) de pre-ARNm de USH2A humano, donde dicho OAS comprende una secuencia […]
Composiciones promotoras, del 6 de Mayo de 2020, de UNIVERSITY OF IOWA RESEARCH FOUNDATION: Una secuencia promotora aislada que comprende un ácido nucleico de entre 500 y 1700 nucleótidos de longitud que tiene por lo menos un 98% de identidad con la SEQ […]
Transfección mediada por células apoptóticas de células de mamífero con ARN de interferencia, del 22 de Abril de 2020, de LOMA LINDA UNIVERSITY: Una célula de mamífero apoptótica o preapoptótica para su uso en la prevención del rechazo de trasplantes, en la que la célula de mamífero […]
Ácidos ribonucleicos con nucleótidos modificados con 4-tio y procedimientos relacionados, del 15 de Abril de 2020, de Translate Bio, Inc: Una molécula de ARNm que tiene una región codificante y opcionalmente, una o más regiones no codificantes, en donde al menos el 25% de los residuos de nucleótidos del […]