INHIBIDORES DE QUINASA BASADOS EN LA HIDANTOÍNA.
Un compuesto de la fórmula I: en la queR1se elige entre el grupo formado por bromo,
yodo, etinilo, cicloalquilo, alcoxi, azetidinilo, acetilo, heterociclilo, ciano, alquilo de cadena lineal y alquilo de cadena ramificada; R2se elige entre el grupo formado por hidrógeno, cloro, flúor y alquilo; R3se elige entre el grupo formado por hidrógeno, cloro y flúor; R4es fenilo, que está sin sustituir o sustituido 1 ó 2 veces por un sustituyente elegido con independencia entre -halógeno, -P(O)(O-CH3)2, -P(O)(OH)2, -S(O)2-alquilo C1-C6, -(O-CH2-CH2)2-O-CH3 y -O-alquilo C1-C6, dicho grupo alquilo está sin sustituir o sustituido 1 ó 2 veces por un sustituyente elegido con independencia entre -OH, -oxo, -cicloalquilo C3-C6, -O-alquilo C1-C6, -NH-alquilo C1-C6 o -N(alquilo C1-C6)2, dichos grupos alquilo están sin sustituir o sustituidos por -OH, o - un heterociclo de 4 a 6 eslabones, cuyos heteroátomos se eligen entre N, S y O; R5es 1-feniletilo; o -alquilo C1-C6, que está sin sustituir o sustituido 1 ó 2 veces por un sustituyente elegido con independencia entre -naftilo, piridinilo, tiazolilo, tiofenilo que está opcionalmente sustituido por bromo, imidazolilo que está opcionalmente sustituido por metilo; o -cicloalquilo C3-C6; -CF3; -O-alquilo C1-C6; -O-CH2-fenilo; -S(O)2-metilo; -oxo; o -NH2; o -bencilo, cuyo bencilo está no sustituido o sustituido una vez por -alquilo C1-C6, -flúor o cloro, -CN, -O-alquilo C1-C6, y -CF3; y sus sales farmacéuticamente aceptables
Tipo: Patente Internacional (Tratado de Cooperación de Patentes). Resumen de patente/invención. Número de Solicitud: PCT/EP2007/051313.
Solicitante: F. HOFFMANN-LA ROCHE AG.
Nacionalidad solicitante: Suiza.
Dirección: GRENZACHERSTRASSE 124 4070 BASEL.
Inventor/es: ZHANG, ZHUMING, KONG, NORMAN, MISCHKE, STEVEN GREGORY, CHEN,SHAOQING, HUBY,NICHOLAS,JOHN,SILVESTER, MOLITERNI,JOHN,ANTHONY, WANG,HONG.
Fecha de Publicación: .
Fecha Solicitud PCT: 12 de Febrero de 2007.
Clasificación PCT:
- A61K31/4166 NECESIDADES CORRIENTES DE LA VIDA. › A61 CIENCIAS MEDICAS O VETERINARIAS; HIGIENE. › A61K PREPARACIONES DE USO MEDICO, DENTAL O PARA EL ASEO (dispositivos o métodos especialmente concebidos para conferir a los productos farmacéuticos una forma física o de administración particular A61J 3/00; aspectos químicos o utilización de substancias químicas para, la desodorización del aire, la desinfección o la esterilización, vendas, apósitos, almohadillas absorbentes o de los artículos para su realización A61L; composiciones a base de jabón C11D). › A61K 31/00 Preparaciones medicinales que contienen ingredientes orgánicos activos. › teniendo grupos oxo unidos directamente al heterociclo, p. ej. fenitoína.
- A61K31/4178 A61K 31/00 […] › no condensados y conteniendo otros heterociclos, p. ej. pilocarpina, nitrofurantoína.
- C07D233/76 QUIMICA; METALURGIA. › C07 QUIMICA ORGANICA. › C07D COMPUESTOS HETEROCICLICOS (Compuestos macromoleculares C08). › C07D 233/00 Compuestos heterocíclicos que contienen ciclos de diazol-1,3 o diazol-1,3 hidrogenado, no condensados con otros ciclos. › con radicales hidrocarbonados sustituidos unidos al tercer átomo de carbono del ciclo.
- C07D233/78 C07D 233/00 […] › Radicales sustituidos por átomos de oxígeno.
Países PCT: Austria, Bélgica, Suiza, Alemania, Dinamarca, España, Francia, Reino Unido, Grecia, Italia, Liechtensein, Luxemburgo, Países Bajos, Suecia, Mónaco, Portugal, Irlanda, Eslovenia, Finlandia, Rumania, Chipre, Lituania, Letonia, Ex República Yugoslava de Macedonia, Albania.
Fragmento de la descripción:
Inhibidores de quinasa basados en la hidantoína.
La presente invención se refiere a derivados de hidantoína y a su utilización como inhibidores de dos proteína-quinasas conocidas habitualmente como MEK1 y MEK2 para el tratamiento de enfermedades humanas, tales como el cáncer. MEK es una abreviatura empleada normalmente para la quinasa MAP/quinasa ERK, que a su vez es una abreviatura de proteína activada por mitógeno/quinasa-quinasa regulada por señales extracelulares. MEK se denomina también en ocasiones quinasa MAPK o quinasa-quinasa MAP.
El cáncer es una enfermedad caracterizada por la proliferación de células y tumores malignos, que tienen un potencial ilimitado de crecimiento, de expansión local y de metástasis sistémica. Este crecimiento incontrolado se deriva de anormalidad en los mecanismos de transducción de señales y la respuesta a varios factores de crecimiento, que difiere de los hallados en células normales. Las anormalidades incluyen cambios en la actividad intrínseca o en la concentración celular de una o más proteínas dentro de la cascada de señalización. Estos cambios están provocados con frecuencia por mutaciones intrínsecas o la sobreexpresión de proteínas de señalización intracelular, lo cual conduce a señales mitógenas espúreas dentro de las células.
El mecanismo de la quina de proteína activada por mitógeno (MAP) es uno de los mecanismos de señalización mejor caracterizados, que intervienen en el desarrollo y la progresión de los cánceres humanos.
Este mecanismo, a través de la cascada de señalización Ras/Raf/MEK/ERK, permite realizar la transmisión y amplificación de señales mitógenas desde la superficie de la célula hacia el núcleo, donde los factores de transcripción activados regulan la expresión genética y determinan el destino de la célula. La activación constitutiva de este mecanismo es suficiente para inducir la transformación celular. La activación desregulada del mecanismo de la quinasa MAP, debida a una activación aberrante de la tirosina-quinasa de receptor, mutaciones RAS o mutaciones Raf, se ha observado con frecuencia en cánceres humanos y constituye un factor importante para determinar el control de un crecimiento anormal. En enfermedades malignas, las mutaciones Ras son frecuentes y se han detectado en un 30% de los cánceres. El grupo Ras de las proteína-GTPasas (proteínas que convierten el trifosfato de guanosina en difosfato de guanosina) emite señales de receptores de factores de crecimiento activados en dirección a sus interlocutores celulares. Destacan entre las dianas reclutadas por la Ras activa fijada sobre membrana las serina/treonina-proteína-quinasas del grupo Raf. El grupo Raf se compone de tres quinasa afines (la A-Raf, B-Raf y C-Raf), que actúan en dirección a los efectores de la Ras. La activación de la Raf mediada por la Ras dispara a su vez la activación de las MEK1 y MEK2 (MAP/ERK-quinasas 1 y 2), que a su vez fosforilan la ERK1 y la ERK2 (quinasas 1 y 2 reguladas por señales extracelulares) tanto en la tirosina-185 como en la treonina-183. Las ERK1 y ERK2 activadas cambian de ubicación y se acumulan en el núcleo, donde pueden fosforilar un gran número de sustratos, incluidos los factores de transcripción que controlan el crecimiento y la supervivencia celular. Dada la importancia del mecanismo Ras/Raf/MEK/ERK en el desarrollo del cáncer humano, los componentes quinasa de la cascada de señalización están surgiendo como dianas potencialmente importantes para la modulación del progreso del estado patológico, ya sea en el cáncer, ya sea en otras enfermedades proliferantes.
La MEK1 y la MEK2 son componentes de un grupo más amplio de quinasas de especificidad dual (MEK1-7), que fosforilan los restos treonina y tirosina de varias quinasas MAP. La MEK1 y la MEK2 se codifican con distintos genes, pero comparten una alta homología (80%) no solo con los dominios de quinasa catalíticos del extremo C, sino también con la mayor parte de la región reguladora del extremo N. Las formas oncogénicas de la MEK1 y de la MEK2 se han detectado en cánceres humanos, pero la activación constitutiva de la MEK se ha constatado que provoca una transformación celular. Además de la Raf, la MEK puede activarse también por acción de otros oncogenes. Hasta el momento, los únicos sustratos conocidos de la MEK1 y de la MEK2 son la ERK1 y la ERK2. Esta especificidad inusual de sustrato y además la capacidad única de fosforilar tanto los restos tirosina como treonina, convierte a la MEK1 y a la MEK2 en puntos críticos dentro de la cascada de transducción de señales, que permiten integrar muchas señales extracelulares en el mecanismo MAPK.
En los estudios publicados anteriormente sobre un inhibidor de la MEK, la 2-(2-cloro-4-yodo-fenilamino)-N-ciclopropilmetoxi-3,4-difluor-benzamida, también conocido como Cl-1040 (publicación PCT nº WO 99/01426), se pone de manifiesto que la MEK1 y MEK2 constituyen una diana atractiva para la intervención farmacológica en el cáncer o en otras enfermedades humanas, caracterizadas por la hiperactividad de la MEK y enfermedades reguladas por el mecanismo MAPK.
Las hidantoínas sustituidas se han publicado anteriormente como activadores de glucoquinasa (publicación PCT nº WO 01/83478).
Resumen de la invención
Esta invención se refiere a compuestos de la fórmula I:

o sus sales farmacéuticamente aceptables,
en la que R1, R2, R3, R4, R5, R6, R7 y R8 tienen los significados definidos en esta solicitud. Estos compuestos inhiben las enzimas MEK1 y MEK2, proteína-quinasas que son componentes del mecanismo de transducción de señales de la MAP-quinasa y, como tales, estos compuestos tendrán actividad celular anti-hiperproliferante.
Descripción detallada de la invención
La presente invención se refiere a compuestos de la fórmula I:
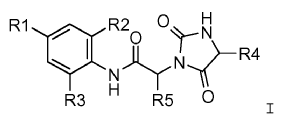
en la que:
Reivindicaciones:
1. Un compuesto de la fórmula I:

en la que
sus sales farmacéuticamente aceptables.
2. Un compuesto según la reivindicación 1, elegido entre el grupo formado por:
(2S,3S)-N-(4-yodo-fenil)-2-[(R)-4-(4-metoxi-fenil)-2,5-dioxo-imidazolidin-1-il]-3-fenil-butiramida;
(2S,3S)-N-(4-etinil-2-fluor-fenil)-2-{(R)-4-[4-(2-hidroxi-etoxi)-fenil]-2,5-dioxo-imidazolidin-1-il}-3-fenil-butiramida;
(2S,3S)-N-(2-cloro-4-yodo-fenil)-2-{(R)-4-[4-(2-hidroxi-etoxi)-fenil]-2,5-dioxo-imidazolidin-1-il}-3-fenil-butiramida;
(2S,3S)-2-{(R)-4-[4-(2-hidroxi-etoxi)-fenil]-2,5-dioxo-imidazolidin-1-il}-N-(4-yodo-2-metil-fenil)-3-fenil-butiramida;
(2S,3S)-N-(2-cloro-4-yodo-fenil)-2-{(R)-4-[4-((R)-2,3-dihidroxi-propoxi)-fenil]-2,5-dioxo-imidazolidin-1-il}-3-fenil-butiramida;
(2S,3S)-N-(2-cloro-4-yodo-fenil)-2-{(R)-4-[4-((S)-2,3-dihidroxi-propoxi)-fenil]-2,5-dioxo-imidazolidin-1-il}-3-fenil-butiramida;
(S)-N-(2-fluor-4-yodo-fenil)-2-{(R)-4-[4-(2-hidroxi-etoxi)-fenil]-2,5-dioxo-imidazolidin-1-il}-3-metil-butira-mida;
(S)-N-(2-fluor-4-yodo-fenil)-2-[(R)-4-(4-metoxi-fenil)-2,5-dioxo-imidazolidin-1-il]-3-o-tolil-propionamida;
(S)-N-(2-fluor-4-yodo-fenil)-2-[(R)-4-(4-metoxi-fenil)-2,5-dioxo-imidazolidin-1-il]-3-m-tolil-propionamida;
(S)-N-(2-fluor-4-yodo-fenil)-2-[(R)-4-(4-metoxi-fenil)-2,5-dioxo-imidazolidin-1-il]-3-p-tolil-propionamida; y
(S)-N-(4-ciclopropil-2-fluor-fenil)-3-(4-fluor-fenil)-2-{(R)-4-[4-(2-hidroxi-1-hidroximetil-etoxi)-fenil]-2,5-dioxo-imidazolidin-1-il}-propionamida.
3. Un compuesto según la reivindicación 1, elegido entre el grupo formado por:
(2S,3S)-N-(2-fluor-4-yodo-fenil)-2-{(R)-4-[4-(2-hidroxi-etoxi)-fenil]-2,5-dioxo-imidazolidin-1-il}-3-fenil-butiramida;
(2S,3S)-2-{(R)-4-[4-((R)-2,3-dihidroxi-propoxi)-fenil]-2,5-dioxo-imidazolidin-1-il}-N-(2-fluor-4-yodo-fenil)-3-fenil-butiramida;
(2S,3S)-N-(2-cloro-4-yodo-fenil)-2-{(R)-4-[4-((R)-2,3-dihidroxi-propoxi)-fenil]-2,5-dioxo-imidazolidin-1-il}-3-fenil-butiramida;
(2S,3S)-N-(2-cloro-4-yodo-fenil)-2-{(R)-4-[4-((S)-2,3-dihidroxi-propoxi)-fenil]-2,5-dioxo-imidazolidin-1-il}-3-fenil-butiramida; y
(2S,3S)-N-(4-ciclopropil-2-fluor-fenil)-2-{(R)-4-[4-(2-hidroxi-etoxi)-fenil]-2,5-dioxo-imidazolidin-1-il}-3-fenil-butiramida.
4. El compuesto (2S,3S)-N-(4-bromo-fenil)-2-[(R)-4-(4-metoxi-fenil)-2,5-dioxo-imidazolidin-1-il]-3-fenil-butiramida.
5. Una composición farmacéutica que contiene un compuesto de la reivindicación 1 ó 4 y un diluyente, excipiente o adyuvante farmacéuticamente aceptable.
6. Un compuesto de reivindicación 1 ó 4 para el uso de medicamento.
7. Un compuesto según la reivindicación 1 ó 4 para el uso de medicamento destinado al tratamiento del cáncer, en particular de tumores sólidos, más en particular de tumores de pulmón, de mama, de colon o de próstata.
8. El uso de un compuesto según la reivindicación 1 ó 4 para la fabricación de un compuesto para el tratamiento del cáncer, en particular tumores sólidos, más en particular tumores de pulmón, de mama, de colon o de próstata.
9. Un proceso para la síntesis de compuestos de la fórmula I según la reivindicación 1, que consiste en hacer reaccionar un compuesto de la fórmula 9

en presencia de fosgeno o cloroformiato de triclorometilo a temperaturas inferiores a 0ºC y en presencia de una base, para obtener los correspondientes compuestos de la fórmula I, en la que todos los sustituyentes de R1 a R5 tienen los significados definidos en la reivindicación 1.
Patentes similares o relacionadas:
Ureas cíclicas como inhibidores de ROCK, del 22 de Julio de 2020, de BRISTOL-MYERS SQUIBB COMPANY: Un compuesto de acuerdo con la Fórmula (I): **(Ver fórmula)** o un enantiómero, un diastereómero, un estereoisómero, un tautómero, una sal farmacéuticamente aceptable […]
Derivado de amina cíclica y utilización farmacéutica del mismo, del 20 de Mayo de 2020, de TORAY INDUSTRIES, INC.: Derivado de amina cíclica representado por una fórmula general (I) o sal aceptable farmacológicamente del mismo: **(Ver fórmula)** en la que n representa 1, […]
Compuestos con actividad antitumoral, del 8 de Abril de 2020, de AB SCIENCE: Un compuesto de fórmula (II): **(Ver fórmula)** o una sal farmacéuticamente aceptable del mismo, donde: R1 es un grupo alquilo; R4 es un grupo alcoxi […]
Medicamentos para el tratamiento o la prevención de enfermedades fibróticas, del 25 de Marzo de 2020, de BOEHRINGER INGELHEIM INTERNATIONAL GMBH: 3-Z-[1-(4-(N-((4-metil-piperazin-1-il)-metilcarbonil)-N-metil-amino)-anilino)-1-fenil-metilen]-6-metoxicarbonil-2- indolinona, los tautómeros, los diastereómeros,…
Compuestos espirocíclicos, del 26 de Febrero de 2020, de Recurium IP Holdings, LLC: Un compuesto de fórmula (I): **(Ver fórmula)** donde: R1 se selecciona del grupo que consiste en hidrógeno, un alquilo opcionalmente sustituido, un […]
Formulación compuesta, que comprende un comprimido esferoidal de múltiples unidades (MUST) encapsulado en una cápsula dura y un método para preparar el mismo, del 19 de Febrero de 2020, de HANMI PHARM. CO., LTD.: Una formulación compuesta de cápsula dura, que comprende dos o más principios farmacéuticamente activos, en donde cada principio farmacéuticamente […]
Derivado de amina cíclica y utilización farmacéutica del mismo, del 15 de Enero de 2020, de TORAY INDUSTRIES, INC.: Derivado de amina cíclica representado por una fórmula general (I) o una sal farmacológicamente aceptable del mismo: **(Ver fórmula)** en el que A representa […]
Métodos y composiciones farmacéuticas para tratar la rabdomiólisis, del 1 de Enero de 2020, de INSERM (INSTITUT NATIONAL DE LA SANTE ET DE LA RECHERCHE MEDICALE): Un compuesto seleccionado del grupo que consiste en antagonistas de TLR9 e inhibidores de la expresión de TLR9 para su uso en el tratamiento de la rabdomiólisis […]