HOMÓLOGOS DEL FACTOR DE CRECIMIENTO DE FIBROBLASTOS.
Un polipéptido seleccionado del grupo que consiste de: a) un polipéptido que comprende una secuencia de aminoácido como se muestra en la SEQ ID NO:
2 del residuo 28 (Glu) al residuo 175 (Met); y b) moléculas de polipéptido que son por lo menos 80% idénticas a la SEQ ID NO: 2 del residuo de aminoácido 28 (Glu) al residuo de aminoácido 175 (Met); para uso en promover la reparación de defectos y deficiencias óseas; para uso en promover la curación ósea en cirugía plástica; para uso en la estimulación del crecimiento óseo en articulaciones protésicas no cementadas e implantes dentales; para uso en incrementar la formación ósea durante osteogenia por distensión; para uso en el tratamiento de otros trastornos esqueléticos que se pueden tratar mediante la estimulación de actividad osteoblástica; para uso en la reparación congénita, inducida por trauma, osteoctomía; o para uso en curación ósea luego de osteonecrosis inducida por radiación
Tipo: Patente Europea. Resumen de patente/invención. Número de Solicitud: E05021714.
Solicitante: ZYMOGENETICS, INC..
Nacionalidad solicitante: Estados Unidos de América.
Dirección: 1201 EASTLAKE AVENUE EAST SEATTLE, WA 98102 ESTADOS UNIDOS DE AMERICA.
Inventor/es: SHEPPARD, PAUL, O., DEISHER, THERESA, A., CONKLIN, DARRELL, C., RAYMOND, FENELLA, C., BUKOWSKI, THOMAS, R., HANSEN, BRIGIT, Julien,Susan D.
Fecha de Publicación: .
Fecha Solicitud PCT: 16 de Octubre de 1997.
Clasificación Internacional de Patentes:
- A61K47/48R
- A61K47/48T4
- C07K14/50 QUIMICA; METALURGIA. › C07 QUIMICA ORGANICA. › C07K PEPTIDOS (péptidos que contienen β -anillos lactamas C07D; ipéptidos cíclicos que no tienen en su molécula ningún otro enlace peptídico más que los que forman su ciclo, p. ej. piperazina diones-2,5, C07D; alcaloides del cornezuelo del centeno de tipo péptido cíclico C07D 519/02; proteínas monocelulares, enzimas C12N; procedimientos de obtención de péptidos por ingeniería genética C12N 15/00). › C07K 14/00 Péptidos con más de 20 aminoácidos; Gastrinas; Somatostatinas; Melanotropinas; Sus derivados. › Factor de crecimiento de fibroblastos (FGF).
- C07K16/22 C07K […] › C07K 16/00 Inmunoglobulinas, p. ej. anticuerpos mono o policlonales. › contra factores de crecimiento.
- C12N5/06B6C
Clasificación PCT:
- A61K38/18 NECESIDADES CORRIENTES DE LA VIDA. › A61 CIENCIAS MEDICAS O VETERINARIAS; HIGIENE. › A61K PREPARACIONES DE USO MEDICO, DENTAL O PARA EL ASEO (dispositivos o métodos especialmente concebidos para conferir a los productos farmacéuticos una forma física o de administración particular A61J 3/00; aspectos químicos o utilización de substancias químicas para, la desodorización del aire, la desinfección o la esterilización, vendas, apósitos, almohadillas absorbentes o de los artículos para su realización A61L; composiciones a base de jabón C11D). › A61K 38/00 Preparaciones medicinales que contienen péptidos (péptidos que contienen ciclos beta-lactama A61K 31/00; dipéptidos cíclicos que no tienen en su molécula ningún otro enlace peptídico más que los que forman su ciclo, p. ej. piperazina 2,5-dionas, A61K 31/00; péptidos basados en la ergolina A61K 31/48; que contienen compuestos macromoleculares que tienen unidades aminoácido repartidas estadísticamente A61K 31/74; preparaciones medicinales que contienen antígenos o anticuerpos A61K 39/00; preparaciones medicinales caracterizadas por los ingredientes no activos, p. ej. péptidos como soportes de fármacos, A61K 47/00). › Factores de crecimiento; Reguladores de crecimiento.
- C07K14/50 C07K 14/00 […] › Factor de crecimiento de fibroblastos (FGF).
- C07K16/22 C07K 16/00 […] › contra factores de crecimiento.
- C07K19/00 C07K […] › Péptidos híbridos (Inmoglobulinas híbridas compuestas solamente de inmoglobulinas C07K 16/46).
- C12N15/18 C […] › C12 BIOQUIMICA; CERVEZA; BEBIDAS ALCOHOLICAS; VINO; VINAGRE; MICROBIOLOGIA; ENZIMOLOGIA; TECNICAS DE MUTACION O DE GENETICA. › C12N MICROORGANISMOS O ENZIMAS; COMPOSICIONES QUE LOS CONTIENEN; PROPAGACION, CULTIVO O CONSERVACION DE MICROORGANISMOS; TECNICAS DE MUTACION O DE INGENIERIA GENETICA; MEDIOS DE CULTIVO (medios para ensayos microbiológicos C12Q 1/00). › C12N 15/00 Técnicas de mutación o de ingeniería genética; ADN o ARN relacionado con la ingeniería genética, vectores, p. ej. plásmidos, o su aislamiento, su preparación o su purificación; Utilización de huéspedes para ello (mutantes o microorganismos modificados por ingeniería genética C12N 1/00, C12N 5/00, C12N 7/00; nuevas plantas en sí A01H; reproducción de plantas por técnicas de cultivo de tejidos A01H 4/00; nuevas razas animales en sí A01K 67/00; utilización de preparaciones medicinales que contienen material genético que es introducido en células del cuerpo humano para tratar enfermedades genéticas, terapia génica A61K 48/00; péptidos en general C07K). › Hormonas de crecimiento.
- C12N5/10 C12N […] › C12N 5/00 Células no diferenciadas humanas, animales o vegetales, p. ej. líneas celulares; Tejidos; Su cultivo o conservación; Medios de cultivo para este fin (reproducción de plantas por técnicas de cultivo de tejidos A01H 4/00). › Células modificadas por introducción de material genético extraño, p. ej. células transformadas por virus.
Clasificación antigua:
- A61K38/18 A61K 38/00 […] › Factores de crecimiento; Reguladores de crecimiento.
- C07K14/50 C07K 14/00 […] › Factor de crecimiento de fibroblastos (FGF).
- C07K16/22 C07K 16/00 […] › contra factores de crecimiento.
- C07K19/00 C07K […] › Péptidos híbridos (Inmoglobulinas híbridas compuestas solamente de inmoglobulinas C07K 16/46).
- C12N15/18 C12N 15/00 […] › Hormonas de crecimiento.
- C12N5/10 C12N 5/00 […] › Células modificadas por introducción de material genético extraño, p. ej. células transformadas por virus.
Países PCT: Austria, Bélgica, Suiza, Alemania, Dinamarca, España, Francia, Reino Unido, Grecia, Italia, Liechtensein, Luxemburgo, Países Bajos, Suecia, Mónaco, Portugal, Irlanda, Finlandia.
PDF original: ES-2357215_T3.pdf
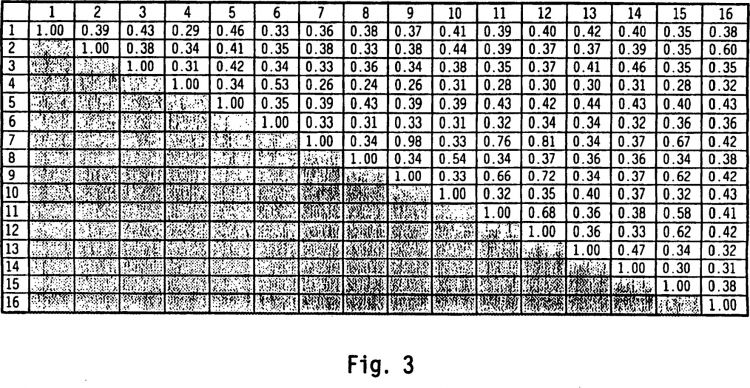

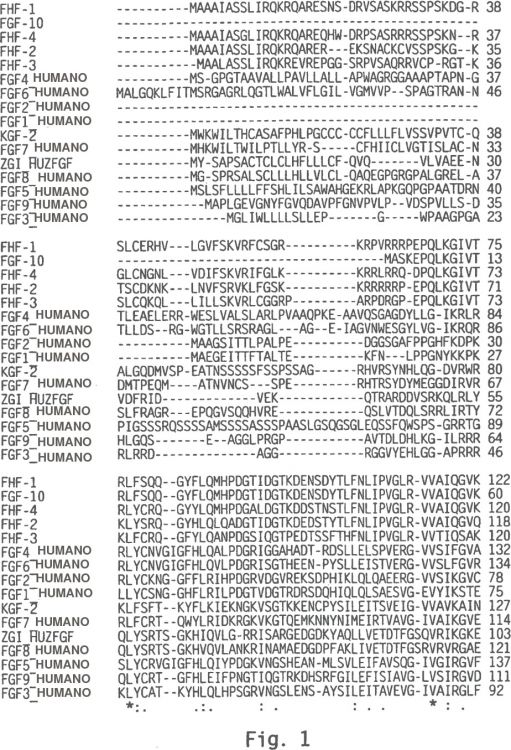
Fragmento de la descripción:
La familia del factor de crecimiento de fibroblasto (FGF) consiste de por lo menos nueve miembros distintos (Basilico et al., Adv. Cancer Res. 59:115-165, 1992 y Fernig et al., Prog. Growth Factor Res. 5(4):353-377, 1994) que actúan generalmente como mitógenos para un espectro amplio de tipos celulares. Por ejemplo, el FGF básico 5 (también conocido como FGF-2) es mitogénico in vitro para células endoteliales, células de músculo liso vascular, fibroblastos, y generalmente para células de origen mesodermo o neuroectodermo, que incluye miocitos esqueléticos y cardiacos (Gospodarowicz et al., J. Cell. Biol. 70:395-405, 1976; Gospodarowicz et al., J. Cell. Biol. 89:568-578, 1981 y Kardami, J. Mol. Cell. Biochem. 92:124-134, 1990). In vivo, se ha mostrado que el bFGF tiene una función en el desarrollo cardiaco aviar (Sugi et al., Dev. Biol. 168:567-574, 1995 y Mima et al., Proc. Nat'l. Acad. 10 Sci. 92: 467-471, 1995), e induce el desarrollo colateral coronario en perros (Lazarous et al., Circulation 94:1074-1082, 1996). Adicionalmente, las actividades no mitogénicas se han demostrado para varios miembros de la familia FGF. Las actividades no proliferativas asociadas con FGF acídico y/o básico incluyen: la liberación endotelial incrementada del activador de plasminógeno de tejido, estimulación de síntesis de matriz extracelular, quimiotaxis para células endoteliales, expresión inducida de genes contráctiles fetales en cardiomiocitos (Parker et al., J. Clin. 15 Invest. 85:507-514, 1990), y sensibilidad hormonal mejorada de pituitaria (Baird et al., J. Cellular Physiol. 5:101-106, 1987.)
Varios miembros de la familia FGF no tienen una secuencia de señal (aFGF, bFGF y posiblemente FGF-9) y así no se esperaría que se secretaran. Adicionalmente, varios de los miembros de la familia FGF tienen la capacidad de migrar al núcleo de la célula (Friesel et al., FASEB 9:919-925, 1995). Todos los miembros de la familia 20 FGF unen la heparina con base en similitudes estructurales. Las especies cruzadas en homología estructural, sugieren una conservación de su relación de estructura/función (Ornitz et al., J. Biol. Chem. 271(25):15292-15297, 1996.)
Existen cuatro receptores FGF extracelulares conocidos (FGFR), y ellos son todas las tirosina quinasas. En general, los miembros de la familia FGF se unen a todos los FGFR conocidos, sin embargo, los FGF específicos se 25 unen a receptores específicos con altos grados de afinidad. Otro medio para especificidad dentro de la familia FGF es la expresión espacial y temporal de los ligandos y sus receptores durante embriogenia. La evidencia sugiere que los FGF actúan más probablemente solo en forma autocrina y/o paracrina, debido a su afinidad de unión a heparina, que limita su difusión del sitio de liberación (Flaumenhaft et al., J. Cell. Biol. 111(4):1651-1659, 1990.) El FGF básico carece de una secuencia de señal, y por lo tanto se restringe a los modos de acción paracrino o autocrino. Se ha 30 postulado que el FGF se almacena intracelularmente y se libera luego del daño de tejido. Se ha mostrado que el FGF básico tiene dos regiones de unión de receptor que son distintas del sitio de unión a heparina (Abraham et al.,. EMBO J. 5(10):2523-2528, 1986.)
Se ha mostrado que el FGFR-3 tiene una función en el crecimiento óseo. Los ratones hechos homozigotos nulos para el FGFR-3 (-/-) resultan en anormalidades esqueléticas postnatales (Colvin et al., Nature Genet. 12: 309: 35 397, 1996 y Deng et al., Cell 84: 911-921, 1996). El fenotipo mutante sugiere que en ratones normales, el FGFR-3 tiene una función en la regulación de división celular de condrocito en la región de placa de crecimiento del hueso (Goldfarb, Cytokine and Growth Factor Rev. 7(4) :311-325, 1996). No se ha identificado el ligando para el FGFR-3 en la placa de crecimiento del hueso.
Aunque se han identificado cuatro FGFR, todos los cuales se ha mostrado por tener variantes de división 40 funcionales, la posibilidad que los receptores FGF novedosos existan es bastante probable. Por ejemplo, no se ha identificado el receptor para la isoforma FGF- 8a (MacArthur et al., J. Virol. 69(4):2501-2507, 1995.).
El FGF-8 es un miembro de la familia FGF que se aísla originalmente de células de carcinoma mamario como un mitógeno inducible de andrógeno. Se ha mapeado un cromosoma humano 10q25-q26 (White et al., Genomics 30:109-11, 1995.) El FGF-8 se involucra en el desarrollo de miembro embriónico (Vogel et al., 45 Development 122 :1737-1750, 1996 y Tanaka et al., Current Biology 5(6) :594-597, 1995.) La expresión del FGF-8 durante embriogenia en el tejido neuronal, urogenital y cardiaco indica que este puede tener una función en el desarrollo de estos tejidos (Crossley et al., Development 121:439-451, 1995.) Existe alguna evidencia que la acrocefalosindactilia, una afección congénita marcada por cabeza puntiaguda y dedos de las manos y los pies palmeados, se asocia con mutaciones de punto FGF-8 (White et al., 1995, ibid.) 50
El FGF-8 tiene cinco exones, en contraste con los otros FGF conocidos, que solo tienen tres exones. Los primeros tres exones de FGF-8 corresponden al primer exón de otros FGF (MacArthur et al., Development 121:3603-3613, 1995.) El gen humano para el FGF-8 codifica cuatro isoformas que difieren en sus regiones de terminal N: isoformas FGF a, b, e, y f; en contraste con el gen de murino que se eleva a ocho isoformas FGF-8 (Crossley et al., 1995, ibid.) El FGF-8a y FGF-8b humano tienen 100% de homología en las proteínas de murino, y las proteínas 55 FGF-8e y FGF-8f son 98% homólogas entre humano y ratón (Gemel et al., Genomics 35:253-257, 1996.)
La enfermedad cardiaca es la causa principal de muerte en los Estados Unidos, contando hasta 30% de todas las muertes. El infarto del miocardio (MI) cuenta con 750,000 admisiones en el hospital por año en los EE.UU., con más de 5 millones de personas diagnosticadas con enfermedad coronaria. Los factores de riesgo para el MI
incluyen diabetes melitus, hipertensión, obesidad truncal, fumar, altos niveles de lipoproteína de baja densidad en el plasma o predisposición genética.
La hiperplasia cardiaca es un incremento en la proliferación de miocito cardiaco, y ha demostrado que ocurre con el envejecimiento normal en el humano y ratas (Olivetti et al., J. Am. Coll. Cardiol. 24(1):140-9, 1994 y Anversa et al., Circ. Res. 67:871-885, 1990), y en cardiomiopatía inducida por catecolamina en ratas (Deisher et al., 5 Am. J. Cardiovasc. Pathol. 5 (1):79-88, 1994.) Sea el incremento de miocitos originados con algún progenitor, o sean un resultado de la proliferación de un tipo celular terminalmente más diferenciado, permanece en controversia.
Sin embargo, debido a que el infarto y otras causas de necrosis del miocardio parecen ser irreparables, parece que los mecanismos normales de hiperplasia cardiaca no compensan la muerte del miocito extensiva y subsiste una necesidad de factores exógenos que promueven la hiperplasia y finalmente resulten en la renovación 10 de la capacidad de funcionamiento del corazón.
El remodelamiento óseo es el proceso dinámico mediante el cual se mantienen la masa de tejido y la arquitectura esquelética. El proceso es un balance entre la resorción ósea y la formación ósea, con dos tipos de células que se consideran son los principales factores. Estas células son el osteoblasto y osteoclasto. Los osteoblastos sintetizan y depositan la matriz para llegar a ser hueso nuevo. Las actividades de los osteoblastos y 15 osteoclastos se regulan por muchos factores, sistémico y local, que incluye factores de crecimiento.
Aunque la interacción entre los factores sistémico y local no se ha aclarado completamente, parece haber consenso en que los factores de crecimiento jueguen un papel clave en la regulación del remodelamiento esquelético normal y la reparación de la fractura. Algunos de los factores de crecimiento que se han identificado en el hueso incluyen: IGF-I, IGF-II, TGF-β1, TGF-β2, bFGF, aFGF, PDGF y la familia de las proteínas morfogénicas del 20 hueso (Baylink et al., J. Bone Mineral Res. 8 (Supp. 2): S565-S572, 1993).
Cuando la resorción ósea excede la formación ósea, resulta una pérdida neta en el hueso, y se incrementa la propensión a las fracturas. La formación ósea reducida se asocia con el envejecimiento y ciertos estados patológicos. Solo en los Estados Unidos,, existen aproximadamente 1.5 millones de fracturas anualmente que son atribuidas a la osteoporosis. El impacto de estas fracturas en la calidad de vida del paciente es inmenso. Los costos 25 asociados con el sistema del cuidado de... [Seguir leyendo]
Reivindicaciones:
1. Un polipéptido seleccionado del grupo que consiste de:
a) un polipéptido que comprende una secuencia de aminoácido como se muestra en la SEQ ID NO: 2 del residuo 28 (Glu) al residuo 175 (Met); y
b) moléculas de polipéptido que son por lo menos 80% idénticas a la SEQ ID NO: 2 del residuo de 5 aminoácido 28 (Glu) al residuo de aminoácido 175 (Met); para uso en promover la reparación de defectos y deficiencias óseas; para uso en promover la curación ósea en cirugía plástica; para uso en la estimulación del crecimiento óseo en articulaciones protésicas no cementadas e implantes dentales; para uso en incrementar la formación ósea durante osteogenia por distensión; para uso en el tratamiento de otros trastornos esqueléticos que se pueden tratar 10 mediante la estimulación de actividad osteoblástica; para uso en la reparación congénita, inducida por trauma, osteoctomía; o para uso en curación ósea luego de osteonecrosis inducida por radiación.
2. Un polipéptido seleccionado del grupo que consiste de:
a) un polipéptido que comprende una secuencia de aminoácido como se muestra en la SEQ ID NO: 2 15 del residuo 28 (Glu) al residuo 196 (Lys); y
b) moléculas de polipéptido que son por lo menos 80% idénticas a la SEQ ID NO: 2 del residuo de aminoácido 28 (Glu) al residuo de aminoácido 196 (Lys); para uso en promover la reparación de defectos y deficiencias óseas; para uso en promover la curación ósea en cirugía plástica; para uso en la estimulación del crecimiento óseo en articulaciones protésicas no cementadas e 20 implantes dentales; para uso en incrementar la formación ósea durante osteogenia por distensión; para uso en el tratamiento de otros trastornos esqueléticos que se pueden tratar mediante la estimulación de actividad osteoblástica; para uso en la reparación congénita, inducida por trauma, osteoctomía; o para uso en curación ósea luego de osteonecrosis inducida por radiación. 25
3. Un polipéptido seleccionado del grupo que consiste de:
a) un polipéptido que comprende una secuencia de aminoácido como se muestra en la SEQ ID NO: 2 del residuo 28 (Glu) al residuo 207 (Ala); y
b) moléculas de polipéptido que son por lo menos 80% idénticas a la SEQ ID NO: 2 del residuo de aminoácido 28 (Glu) al residuo de aminoácido 207 (Ala); para uso en promover la reparación 30 de defectos y deficiencias óseas; para uso en promover la curación ósea en cirugía plástica; para uso en la estimulación del crecimiento óseo en articulaciones protésicas no cementadas e implantes dentales; para uso en incrementar la formación ósea durante osteogenia por distensión; para uso en el tratamiento de otros trastornos esqueléticos que se pueden tratar mediante la estimulación de actividad osteoblástica; para uso en la reparación congénita, 35 inducida por trauma, osteoctomía; o para uso en curación ósea luego de osteonecrosis inducida por radiación.
4. Un polipéptido para uso de acuerdo con cualquiera de las Reivindicaciones 1-3, en donde dicho polipéptido se selecciona del grupo que consiste de:
a) un polipéptido que consiste de una secuencia de aminoácido como se muestra en la SEQ ID NO: 2 40 del residuo 28 (Glu) al residuo 175 (Met);
b) un polipéptido que consiste de una secuencia de aminoácido como se muestra en la SEQ ID NO: 2 del residuo 28 (Glu) al residuo 196 (Lys);
c) un polipéptido que consiste de una secuencia de aminoácido como se muestra en la SEQ ID NO: 2 del residuo 28 (Glu) al residuo 207 (Ala). 45
5. Un polipéptido para uso de acuerdo con la Reivindicación 4, para uso en promover la reparación de un defecto o deficiencia ósea seleccionada de fracturas sin unión, abiertas y cerradas.
6. Un polipéptido para uso de acuerdo con cualquiera de las Reivindicaciones 1-5, en donde dicho polipéptido comprende adicionalmente un residuo metionina de terminal amino.
7. Un polipéptido para uso de acuerdo con cualquiera de las Reivindicaciones 1-5, en donde dicho 50 polipéptido comprende adicionalmente una secuencia de señal.
8. Un polipéptido para uso de acuerdo con la Reivindicación 7, en donde dicha secuencia de señal es como se muestra en la SEQ ID NO: 2 del residuo de aminoácido 1 (Met) al residuo de aminoácido 27 (Ala).
9. Un polipéptido para uso de acuerdo con la Reivindicación 6, en donde el trastorno esquelético es osteoporosis o artritis.
10. Un polipéptido aislado seleccionado del grupo que consiste de:
a) un polipéptido que consiste de una secuencia de aminoácido como se muestra en la SEQ ID NO: 2 del residuo 28 (Glu) al residuo 175 (Met); más un residuo metionina de terminal amino; 5
b) un polipéptido que consiste de una secuencia de aminoácido como se muestra en la SEQ ID NO: 2 del residuo 28 (Glu) al residuo 196 (Lys); más un residuo metionina de terminal amino;
c) un polipéptido que consiste de una secuencia de aminoácido como se muestra en la SEQ ID NO: 2 del residuo 28 (Glu) al residuo 207 (Ala); más un residuo metionina de terminal amino.
11. Un polipéptido de acuerdo con la Reivindicación 10, que comprende adicionalmente una secuencia de 10 señal.
12. Un polipéptido de acuerdo con la Reivindicación 11, en donde dicha secuencia de señal es como se muestra en la SEQ ID NO: 2 del residuo de aminoácido 1 (Met) al residuo de aminoácido 27 (Ala).
13. Un polipéptido de acuerdo con cualquiera de las Reivindicaciones 10-12 para uso como un medicamento. 15
14. Una composición farmacéutica que comprende un polipéptido homólogo FGF purificado de acuerdo con cualquiera de las Reivindicaciones 10-12, en combinación con un vehículo farmacéuticamente aceptable.
Patentes similares o relacionadas:
 Métodos para producir proteínas bicatenarias en bacterias, del 29 de Julio de 2020, de GENENTECH, INC.: Un método para producir un receptor de linfocitos T monoclonal de movilización inmunitaria contra el cáncer (ImmTAC) que comprende una cadena alfa del receptor de linfocitos […]
Métodos para producir proteínas bicatenarias en bacterias, del 29 de Julio de 2020, de GENENTECH, INC.: Un método para producir un receptor de linfocitos T monoclonal de movilización inmunitaria contra el cáncer (ImmTAC) que comprende una cadena alfa del receptor de linfocitos […]
Método para el tratamiento de la osteoporosis, del 22 de Julio de 2020, de AMGEN INC.: Un anticuerpo antiesclerostina que comprende una CDR-H1 de la SEQ ID NO: 245, una CDR-H2 de la SEQ ID NO: 246, una CDR-H3 de la SEQ ID NO: 247, […]
Anticuerpo anti-FGF23 y composición farmacéutica que comprende el mismo, del 15 de Julio de 2020, de Kyowa Kirin Co., Ltd: Anticuerpo o fragmento funcional del mismo que se une a la totalidad o a una parte del epítopo de FGF23 humano, al que se une un anticuerpo producido […]
Anticuerpos scFv que pasan las capas epitelial y/o endotelial, del 1 de Julio de 2020, de ESBATech, an Alcon Biomedical Research Unit LLC: Un anticuerpo monocatenario (scFv) que comprende: (a) un dominio variable de la cadena ligera (VL) que tiene tres regiones CDR de VL no […]
 Tratamiento del cáncer usando inhibidores de TGF-beta y PD-1, del 24 de Junio de 2020, de XOMA TECHNOLOGY LTD.: Un inhibidor del factor de crecimiento transformante beta (TGFβ) y un inhibidor de la proteina de muerte celular programada 1 (PD-1) para usar en un metodo […]
Tratamiento del cáncer usando inhibidores de TGF-beta y PD-1, del 24 de Junio de 2020, de XOMA TECHNOLOGY LTD.: Un inhibidor del factor de crecimiento transformante beta (TGFβ) y un inhibidor de la proteina de muerte celular programada 1 (PD-1) para usar en un metodo […]
Métodos para el tratamiento de la enfermedad ocular en sujetos humanos, del 10 de Junio de 2020, de Clearside Biomedical, Inc: Una formulación farmacéutica que comprende un fármaco para su uso en un método de tratamiento de un trastorno ocular posterior en un sujeto humano que […]
Método para tratar la pérdida de hueso alveolar mediante el uso de anticuerpos antiesclerostina, del 3 de Junio de 2020, de AMGEN INC.: Un anticuerpo antiesclerostina para su uso en un método para aumentar la altura del hueso alveolar en un sujeto que padece pérdida de hueso alveolar, donde […]
Proteínas de captura de la superficie celular recombinantes, del 13 de Mayo de 2020, de REGENERON PHARMACEUTICALS, INC.: Un método para detectar y aislar células que producen altos niveles de una proteína heterodimérica que tiene una primera subunidad y una segunda subunidad, […]