HIDROLIZADO PROTEICO DE SUERO BIOACTIVO MEJORADO.
Un proceso para preparar un hidrolizado mejorado de proteína de suero que contiene péptidos bioactivos,
que comprende hidrolizar un aislado de proteína de suero (WPI) con una o más enzimas que se caracteriza porque: i) la enzima es una proteasa termolábil; ii) la hidrólisis se lleva a cabo a una temperatura entre aproximadamente 30 °C y 65 °C a un pH entre aproximadamente 3.5 y aproximadamente 9.0 cuando dicha enzima es una proteasa neutra, a un pH entre aproximadamente
Tipo: Patente Internacional (Tratado de Cooperación de Patentes). Resumen de patente/invención. Número de Solicitud: PCT/NZ2001/000188.
Solicitante: NEW ZEALAND DAIRY BOARD.
Nacionalidad solicitante: Nueva Zelanda.
Dirección: PASTORAL HOUSE 25 THE TERRACE WELLINGTON 1 NUEVA ZELANDA.
Inventor/es: CARR,ALISTAIR, SCHLOTHAUER,Ralf-Christian, SCHOLLUM,Linda,May, REID,Julian,Robert, HARVEY,Stephanie,Adele, FANSHAWE,Rachel,Lois.
Fecha de Publicación: .
Fecha Solicitud PCT: 11 de Septiembre de 2001.
Clasificación Internacional de Patentes:
- A23J3/34B4
- A23L1/305B
- A61K38/01D6
- A61K38/06 NECESIDADES CORRIENTES DE LA VIDA. › A61 CIENCIAS MEDICAS O VETERINARIAS; HIGIENE. › A61K PREPARACIONES DE USO MEDICO, DENTAL O PARA EL ASEO (dispositivos o métodos especialmente concebidos para conferir a los productos farmacéuticos una forma física o de administración particular A61J 3/00; aspectos químicos o utilización de substancias químicas para, la desodorización del aire, la desinfección o la esterilización, vendas, apósitos, almohadillas absorbentes o de los artículos para su realización A61L; composiciones a base de jabón C11D). › A61K 38/00 Preparaciones medicinales que contienen péptidos (péptidos que contienen ciclos beta-lactama A61K 31/00; dipéptidos cíclicos que no tienen en su molécula ningún otro enlace peptídico más que los que forman su ciclo, p. ej. piperazina 2,5-dionas, A61K 31/00; péptidos basados en la ergolina A61K 31/48; que contienen compuestos macromoleculares que tienen unidades aminoácido repartidas estadísticamente A61K 31/74; preparaciones medicinales que contienen antígenos o anticuerpos A61K 39/00; preparaciones medicinales caracterizadas por los ingredientes no activos, p. ej. péptidos como soportes de fármacos, A61K 47/00). › Tripéptidos.
- A61K38/08 A61K 38/00 […] › Péptidos que tienen de 5 a 11 aminoácidos.
- A61K38/10 A61K 38/00 […] › Péptidos que tienen de 12 a 20 aminoácidos.
Clasificación PCT:
- A23J3/34 A […] › A23 ALIMENTOS O PRODUCTOS ALIMENTICIOS; SU TRATAMIENTO, NO CUBIERTO POR OTRAS CLASES. › A23J COMPOSICIONES A BASE DE PROTEINAS PARA LA ALIMENTACION; TRATAMIENTO DE PROTEINAS PARA LA ALIMENTACION; COMPOSICIONES A BASE DE FOSFATIDOS PARA LA ALIMENTACION. › A23J 3/00 Tratamiento de proteínas para la alimentación. › utilizando enzimas.
Clasificación antigua:
- A23J3/34 A23J 3/00 […] › utilizando enzimas.
Países PCT: Austria, Bélgica, Suiza, Alemania, Dinamarca, España, Francia, Reino Unido, Grecia, Italia, Liechtensein, Luxemburgo, Países Bajos, Suecia, Mónaco, Portugal, Irlanda, Eslovenia, Finlandia, Rumania, Chipre, Lituania, Letonia, Ex República Yugoslava de Macedonia, Albania.
PDF original: ES-2359789_T3.pdf
Fragmento de la descripción:
ÁREA TÉCNICA
Esta invención se refiere a un proceso para producir productos mejorados de proteína de suero lácteo hidrolizada que carecen de sabor amargo y que contienen péptidos bioactivos. Los productos del proceso tienen elevada digestibilidad y buenas propiedades organolépticas. Los productos tienen un sabor insípido y carecen de gusto a jabón o a caldo. Los productos mejorados de proteína de suero lácteo hidrolizada son fuentes útiles de péptidos bioactivos para la incorporación en alimentos funcionales.
ESTADO DE LA TÉCNICA
Una cantidad de ingredientes alimentarios y productos alimentarios fueron producidos a partir de la hidrólisis de una fuente de proteínas como las proteínas de la leche, la caseína y las proteínas del suero lácteo.[0003] Los productos alimentarios de proteína hidrolizada pueden presentar ventajas respecto a los productos alimentarios de proteína no hidrolizada en una serie de áreas del cuidado de la salud. Por ejemplo, se sabe que las proteínas hidrolizadas enzimáticamente son menos alergénicas. También se digieren y se absorben más rápidamente que las proteínas enteras. Los productos alimentarios que contienen proteínas hidrolizadas también son útiles en la alimentación de pacientes hospitalizados por ejemplo con enfermedades digestivas.
Se sabe que la hidrólisis de las proteínas del suero y las caseínas libera péptidos bioactivos que pueden tener una serie de efectos fisiológicos (Maubois et al, 1991; EP 4745506). Varias publicaciones describen dichos péptidos bioactivos, por ejemplo, se liberaron péptidos que inhiben la ECA, que tienen propiedades antihipertensivas, mediante un tratamiento enzimático de β-lactoglobulina y concentrados de proteínas de suero lácteo (Mullally et al, 1997). Los péptidos inhibidores de la ECA también se encuentran en la leche cortada y en hidrolizados de αs y β caseína (JP 4282400; Nakamura et al 1994, Yamamoto 1997).
EP 4745506 divulga la hidrólisis de la proteína de la leche lactoferrina en suero para liberar lactoferricina que actúa como antimicrobiano útil para el tratamiento de la diarrea, el pie de atleta, las infecciones oculares, la mastitis, etc. en humanos y animales
.[0006] No obstante, se sabe que la hidrólisis de la mayoría de las proteínas de los alimentos, especialmente la hidrólisis de los productos que contienen suero y caseína genera sabor amargo. Esto causa problemas de palatabilidad particularmente al intentar formular productos para ingerir oralmente que incorporan hidrolizados de proteínas lácteas como fuente de péptidos bioactivos
.[0007] En el campo de la hidrólisis de proteínas se usan comúnmente uno o dos métodos para controlar o eliminar el sabor amargo en los hidrolizados de proteínas a fin de aumentar la palatabilidad de los productos.
Se sabe que una hidrólisis extensa del sustrato proteico reduce el sabor amargo en los hidrolizados de proteínas lácteas (EP 065663; EP 0117047; US 3970520). Así se producen de manera relativamente fácil y económica productos menos amargos. Sin embargo, la hidrólisis extensa reduce las longitudes de las cadenas de todos los péptidos, inclusive los péptidos bioactivos de interés. La hidrólisis extensa del sustrato proteico destruye la actividad funcional y biológica del péptido de interés. Además a menudo se desarrollan gustos desabridos a jabón y a caldo, con la consecuencia de que la palatabilidad del producto final sigue siendo baja en comparación con el sustrato proteico insípido original. Una desventaja final es que para algunos hidrolizados el sabor amargo solo es eliminado parcialmente (Roy 1992 y 1997).
Un segundo método común para el control del sabor amargo en los hidrolizados de proteínas es usar enzimas de desamargado, en particular las provenientes de Aspergillus oryzae.
Se cree que la generación de "sabor amargo" en los hidrolizados de proteínas se debe a la presencia de péptidos "amargos" hidrófobos grandes. Las enzimas de desamargado hidrolizan selectivamente los péptidos amargos presentes en los hidrolizados de proteínas. Un experto en el tema puede, mediante la selección juiciosa de las enzimas de desamargado y las condiciones de tratamiento, desamargar eficazmente hidrolizados de proteínas lácteas dejando intactos los péptidos bioactivos particulares de interés. Sin embargo, el uso de enzimas de desamargado hace que el proceso sea más costoso y que la conservación de algunos de los péptidos bioactivos no se logre fácilmente o satisfactoriamente. Otra desventaja es que los tratamientos con enzimas de desamargado tienen la tendencia a liberar aminoácidos libres en el producto final y, como consecuencia, los hidrolizados desarrollan un desagradable gusto a caldo o a jabón.
Los diversos métodos de desamargado de los hidrolizados de proteínas crean pasos adicionales en el proceso y agregan costos a la fabricación del producto final. Además el producto final también pierde el equilibrio en cuanto al suministro de aminoácidos libres.
Sería más ventajoso si se pudiera desarrollar un proceso para hidrolizar proteínas que liberara péptidos bioactivos de interés y limitara la formación de péptidos amargos y aminoácidos libres, permitiendo de esta manera retener el sabor insípido de los sustratos que contienen proteínas lácteas.
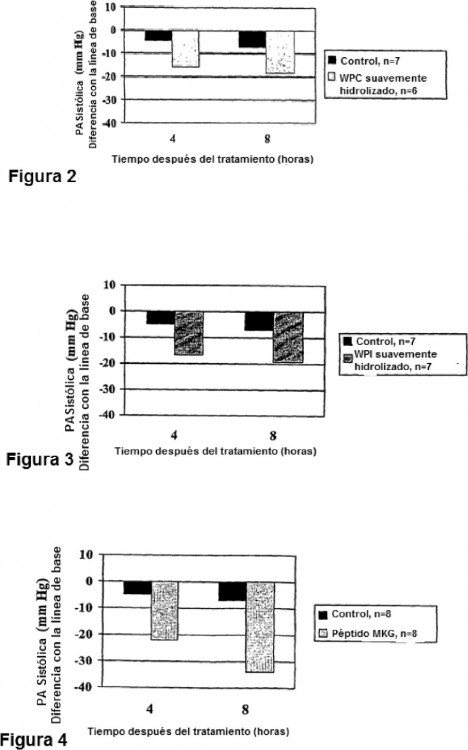
Algunos péptidos bioactivos, en particular los péptidos antihipertensivos, son relativamente estables durante la hidrólisis de las proteínas y se liberan muy precozmente durante la hidrólisis del sustrato que contiene proteínas lácteas como se muestra en la figura 1
.[0014] Los sabores amargos de los hidrolizados de proteínas lácteas se pueden mejorar agregando azúcares o hidrolizando azúcares naturales, como lactosa, que ya están presentes en el sustrato que contiene proteínas lácteas (Bernal y Jelen, 1989). Por ejemplo los sueros ácidos y los sueros de quesos se tornan más sabrosos cuando han sido edulcorados mediante hidrólisis de lactosa con β-galactosidasa y lactasa (FR 2309154; US 4358464; JP 8056568).
Para lograr una gran aceptación del sabor para un producto de proteína hidrolizada que contiene péptidos bioactivos, es necesario un preciso control de la hidrólisis para evitar que se produzca un sabor amargo
.[0016] Un método común de finalización de la hidrólisis es mediante la desactivación de las enzimas, generalmente mediante desactivación térmica a temperaturas elevadas, típicamente > 90-100°C durante un período prolongado. Sin embargo, este método no puede ser utilizado para detener la hidrólisis de las proteínas del suero puesto que todas las proteínas del suero intactas, sin hidrolizar, que permanecen en la mezcla se desnaturalizarían y precipitarían haciendo el producto final menos soluble y menos aceptable para el uso como un ingrediente alimentario.
Dicho problema fue resuelto en WO 99/65326 que da a conocer un proceso de hidrólisis suave de suero dulce o concentrado de proteína de suero dulce (WPC, por sus siglas en inglés) para producir hidrolizados que contienen péptidos bioactivos con una o más de las propiedades siguientes:
actividad antihipertensiva ECA-I
actividad de promoción de la proliferación de bifidus
sabor no pegajoso, no amargo
sabor agradable a ligeramente dulce
buenas propiedades organolépticas.
La presente invención usa un sustrato que contiene proteína de suero diferente al utilizado en WO 99/65326 aunque se utiliza un proceso de hidrólisis semejante. Sorprendentemente, el uso de este sustrato diferente da lugar a un hidrolizado que muestra mejorías impresionantes en las propiedades mencionadas antes de los hidrolizados de suero, particularmente en la actividad antihipertensiva ECA-I, el sabor y la funcionalidad del producto.
En términos generales la presente invención apunta al proceso de hidrólisis de un sustrato diferente que contiene proteína de suero y al nuevo hidrolizado producido mediante ese proceso.
RESUMEN DE LA INVENCIÓN
La presente invención proporciona un proceso para preparar un hidrolizado de proteína de suero mejorado que contiene péptidos bioactivos, que comprende hidrolizar un aislado de proteína de suero (WPI, por sus siglas en inglés) con una o más enzimas, caracterizado porque:
i) la enzima es una proteasa... [Seguir leyendo]
Reivindicaciones:
1. Un proceso para preparar un hidrolizado mejorado de proteína de suero que contiene péptidos bioactivos,
que comprende hidrolizar un aislado de proteína de suero (WPI) con una o más enzimas que se caracteriza porque:
i) la enzima es una proteasa termolábil;
ii) la hidrólisis se lleva a cabo a una temperatura entre aproximadamente 30 °C y 65 °C a un pH entre aproximadamente 3.5 y aproximadamente 9.0 cuando dicha enzima es una proteasa neutra, a un pH entre aproximadamente 2.5 y aproximadamente 6.0 cuando dicha enzima es una proteasa ácida;
iii) la hidrólisis se finaliza cuando se alcanza un grado de hidrólisis que no es superior a aproximadamente 10%; y
iv) la hidrólisis se finaliza desactivando dichas una o más enzimas en condiciones que evitan la desnaturalización sustancial de los péptidos o las proteínas residuales en dicho hidrolizado, donde dichas condiciones de desactivación se seleccionan del grupo que consiste en; desactivación por calor que comprende calentar dicho hidrolizado hasta diez segundos a una temperatura de hasta aproximadamente 100 °C;
o cuando dicha hidrólisis se lleva a cabo una temperatura por debajo de aproximadamente 65 °C, dicha desactivación por calor se lleva a cabo entre aproximadamente 65 °C y aproximadamente 70 °C durante entre aproximadamente 10 segundos y aproximadamente 15 minutos;o cuando dicha hidrólisis se lleva a cabo una temperatura por debajo de aproximadamente 60 °C, dicha desactivación por calor se lleva a cabo entre aproximadamente 60 °C y aproximadamente 65 °C durante entre aproximadamente 10 segundos y aproximadamente 30 minutos;o llevando el pH de dicho sustrato que contiene proteína de suero a un pH al cual dicha proteasa no es activa; o sometiendo dicho hidrolizado a ultrafiltración con una membrana de ultrafiltración con un corte de peso molecular nominal en el rango de aproximadamente 10-500 kDa, donde el producto del proceso es altamente soluble.
2. Un proceso de acuerdo con la reivindicación 1, donde la enzima se selecciona del grupo que consiste en proteasa P6, proteasa A, proteasa M, peptidasa, neutrasa, validasa, AFP 2000, y cualquier otra proteasa termolábil.
3. Un proceso como el que se reivindica en la reivindicación 1, donde dicha membrana de ultrafiltración tiene un corte de peso molecular nominal en el rango de aproximadamente 10-200 kDa.
4. Un proceso como el que se reivindica en cualquiera de las reivindicaciones precedentes, donde dicha enzima es inmovilizada sobre un soporte inerte durante dicho paso de hidrólisis ii).
5. Un proceso como el que se reivindica en la reivindicación 4, donde dicho soporte inerte es un polímero funcional a base de metacrilato, partículas de carragenina, partículas de quitosana o cualquier otro material de soporte inerte adecuado.
6. Un proceso como el que se reivindica en cualquiera de las reivindicaciones precedentes, donde el grado de hidrólisis es entre aproximadamente 3% y aproximadamente 10%.
7. Un proceso como el que se reivindica en la reivindicación 6, donde el grado de hidrólisis es entre aproximadamente 3% y aproximadamente 5%.
8. Un proceso como el que se reivindica en cualquiera de las reivindicaciones precedentes, donde el hidrolizado de proteína de suero producido de esa manera comprende uno o más péptidos bioactivos seleccionados del grupo que consiste en SAP (SEC. ID Nº: 1), VSLPEW (SEC. ID Nº: 5), INYWL (SEC. ID Nº: 6), LKPTPEGDLEIL (SEC. ID Nº: 7) y LKGYGGVSLPEW (SEC. ID Nº: 8).
9. Un proceso como el que se reivindica en cualquiera de las reivindicaciones precedentes, donde el hidrolizado de proteína de suero preparado de esa manera comprende al menos un péptido bioactivo seleccionado del grupo que consiste en LIVTQ (SEC. ID Nº: 4), MKG (SEC. ID Nº: 2) y ALPMH (SEC. ID Nº: 3), en combinación con al menos un péptido bioactivo seleccionado del grupo que comprende SAP (SEC. ID Nº: 1), VSLPEW (SEC. ID Nº: 5), INYWL (SEC. ID Nº: 6), LKPTPEGDLEIL (SEC. ID Nº: 7) y LKGYGGVSLPEW (SEC. ID Nº: 8).
10. Una composición farmacéutica que comprende al menos un péptido bioactivo seleccionado del grupo que consiste en SAP (SEC. ID Nº: 1), VSLPEW (SEC. ID Nº: 5), INYWL (SEC. ID Nº: 6), LKPTPEGDLEIL (SEC. ID Nº: 7) y LKGYGGVSLPEW (SEC. ID Nº: 8) en combinación con el péptido bioactivo MKG (SEC. ID Nº: 2) junto con un excipiente farmacéuticamente aceptable.
11. Un producto hidrolizado de WPI altamente soluble, no amargo, que contiene péptidos bioactivos, preparado por el proceso de la reivindicación 8 o 9.
12. Un producto como el que se reivindica en la reivindicación 11, donde el grado de hidrólisis del WPI es entre aproximadamente 3% y aproximadamente 5%.
13. Un producto como el que se reivindica en la reivindicación 12, donde el tamaño principal de partícula de las proteínas de suero en el producto es menor de aproximadamente 30 micrómetros.
14. Un producto como el que se reivindica la reivindicación 13, donde el tamaño principal de partícula es menor de aproximadamente 3 micrómetros. 15. Un producto como el que se reivindica en cualquiera de las reivindicaciones 11 a 14 que es transparente o blanco en solución.
16. Un producto como el que se reivindica en cualquiera de las reivindicaciones 11 a 15, donde uno o más de dichos péptidos bioactivos se seleccionan del grupo que consiste en SAP (SEC. ID Nº: 1), VSLPEW (SEC. ID Nº: 5), INYWL (SEC. ID Nº: 6), LKPTPEGDLEIL (SEC. ID Nº: 7) y LKGYGGVSLPEW (SEC. ID Nº: 8).
17. Un producto como el que se reivindica en cualquiera de las reivindicaciones 11 a 15 que comprende al menos un péptido bioactivo seleccionado del grupo que consiste en LIVTQ (SEC. ID Nº: 4), MKG (SEC. ID Nº: 2) y ALPMH (SEC. ID Nº: 3), en combinación con al menos un péptido bioactivo seleccionado del grupo que comprende SAP (SEC. ID Nº: 1), VSLPEW (SEC. ID Nº: 5), INYWL (SEC. ID Nº: 6), LKPTPEGDLEIL (SEC. ID Nº: 7) y LKGYGGVSLPEW (SEC. ID Nº: 8).
18. Un producto alimentario que contiene un producto hidrolizado de WPI como el que se reivindica en cualquiera de las reivindicaciones 11 a 17.
19. El uso de un producto como el que se reivindica en cualquiera de las reivindicaciones 11 a 17 en la fabricación de un medicamento para tratar o prevenir la hipertensión en un paciente que lo necesita.
20. Una composición farmacéutica que comprende el producto de cualquiera de las reivindicaciones 11 a 17 junto con un excipiente farmacéuticamente aceptable.
21. Un hidrolizado que comprende uno o más péptidos seleccionados entre SAP (SEC. ID Nº: 1), VSLPEW (SEC. ID Nº: 5), INYWL (SEC. ID Nº: 6), LKPTPEGDLEIL (SEC. ID Nº: 7) y LKGYGGVSLPEW (SEC. ID Nº: 8).
22. Un hidrolizado que comprende una mezcla de al menos un primer péptido y al menos un segundo péptido, donde el primer péptido se selecciona del grupo que consiste en LIVTQ (SEC. ID Nº:4), MKG (SEC. ID Nº: 2) y ALPMH (SEC. ID Nº: 3), y donde el segundo péptido se selecciona del grupo que comprende SAP (SEC. ID Nº: 1), VSLPEW (SEC. ID Nº: 5), INYWL (SEC. ID Nº:6), LKPTPEGDLEIL (SEC. ID Nº: 7) y LKGYGGVSLPEW (SEC. ID Nº: 8).
23. Una composición farmacéutica que comprende el hidrolizado que se reivindica en la reivindicación 21 o 22 junto con un excipiente farmacéuticamente aceptable.
24. El uso de un hidrolizado como el que se reivindica en la reivindicación 21 o 22 para la fabricación de un medicamento para tratar o prevenir la hipertensión en un paciente que necesita dicho tratamiento.
25. Un proceso de acuerdo con la reivindicación 8 o la reivindicación 9 que comprende además un paso de combinación con un excipiente farmacéuticamente aceptable para producir una composición farmacéutica.
Patentes similares o relacionadas:
Composiciones nutricionales que contienen un componente de péptido y sus usos, del 29 de Julio de 2020, de MJN U.S. Holdings, LLC: Una composición nutricional para su uso para reducir la incidencia de la diabetes mellitus, en donde dicha composición nutricional comprende: (i) […]
Inmunoterapia novedosa contra diversos tumores, entre ellos tumores cerebrales y neuronales, del 22 de Julio de 2020, de IMMATICS BIOTECHNOLOGIES GMBH: Péptido que comprende una secuencia de aminoácidos acorde con la SEQ ID N.º 19, en que dicho péptido tiene una longitud total de entre 9 y 16 aminoácidos.
Péptidos para inhibir la angiogénesis, del 15 de Julio de 2020, de The Board of Trustees of the University of Illionis: Un peptido aislado para su uso en la inhibicion de la angiogenesis en un paciente que lo necesita, en donde el peptido comprende la secuencia de aminoacidos de KFARLWTEIPTAIT […]
Péptido que tiene actividad antiinflamatoria, y uso del mismo, del 8 de Julio de 2020, de CAREGEN CO., LTD: Un péptido que consiste en una secuencia de aminoácidos de SEQ ID NO: 1, SEQ ID NO: 2 o SEQ ID NO: 3.
Péptido que tiene actividades antiinflamatoria, osteogénica y promotora del crecimiento del cabello, y uso del mismo, del 24 de Junio de 2020, de CAREGEN CO., LTD: Un péptido que tiene actividad antiinflamatoria, que consiste en la secuencia de aminoácidos SEQ ID NO: 2.
Combinaciones de inhibidores de puntos de control inmunitarios, del 24 de Junio de 2020, de LYTIX BIOPHARMA AS: Un compuesto que tiene la fórmula Lys Lys Trp Trp Lys Lys Trp Dip Lys, o una sal, éster o amida del mismo; para su uso en el tratamiento […]
Péptido con eficacia antiobesidad y antidiabética y uso del mismo, del 17 de Junio de 2020, de CAREGEN CO., LTD: Un péptido que consiste en la secuencia de aminoácidos de SEQ ID NO: 1 o SEQ ID NO: 2.
Péptido que tiene actividades antiinflamatoria, osteogénica y de fomento del crecimiento del pelo, y uso del mismo, del 17 de Junio de 2020, de CAREGEN CO., LTD: Péptido que tiene actividad antiinflamatoria, que consiste en secuencias de aminoácidos de SEQ ID NO: 3.