DERIVADOS DE AZAFENANTRIDONA Y SU USO COMO INHIBIDORES DE PARP.
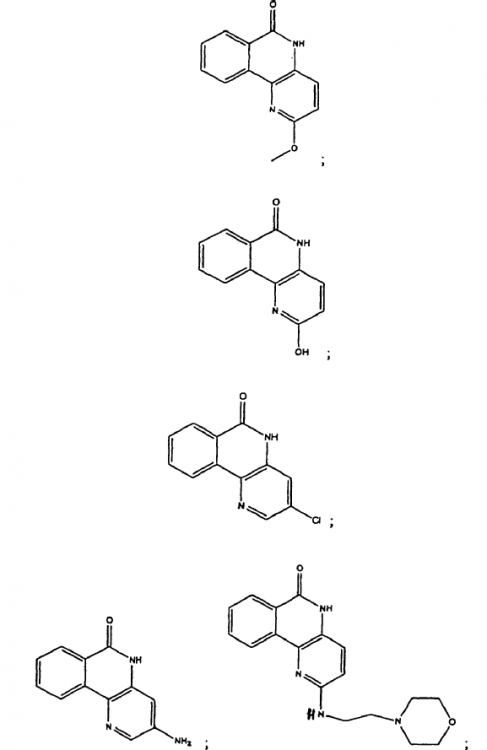
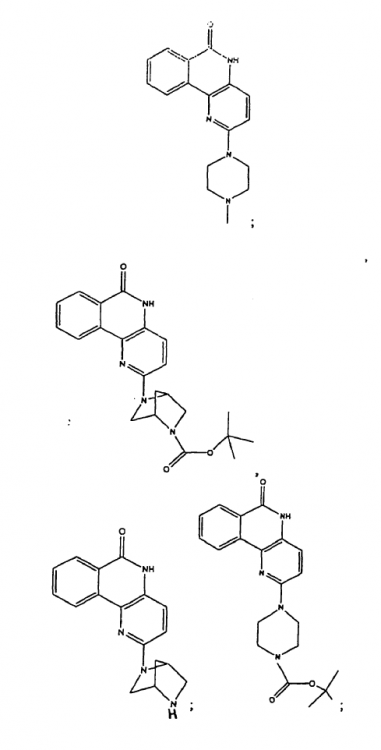
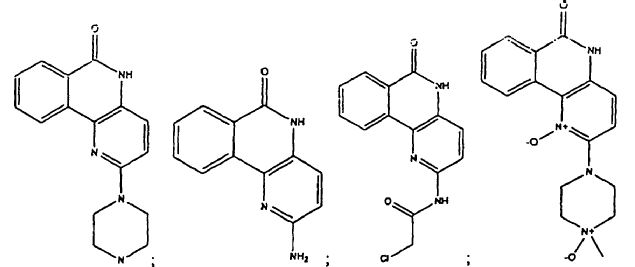
Compuesto seleccionado del grupo que consiste en:
Tipo: Patente Internacional (Tratado de Cooperación de Patentes). Resumen de patente/invención. Número de Solicitud: PCT/US2001/044815.
Solicitante: EISAI INC..
Nacionalidad solicitante: Estados Unidos de América.
Dirección: 100 TICE BOULEVARD WOODCLIFF LAKE, NJ 07677 ESTADOS UNIDOS DE AMERICA.
Inventor/es: ZHANG, JIE, KALISH, VINCENT J., LI,JIA-HE, FERRARIS,DANA,V.
Fecha de Publicación: .
Fecha Solicitud PCT: 30 de Noviembre de 2001.
Fecha Concesión Europea: 25 de Agosto de 2010.
Clasificación PCT:
- A61K31/33 NECESIDADES CORRIENTES DE LA VIDA. › A61 CIENCIAS MEDICAS O VETERINARIAS; HIGIENE. › A61K PREPARACIONES DE USO MEDICO, DENTAL O PARA EL ASEO (dispositivos o métodos especialmente concebidos para conferir a los productos farmacéuticos una forma física o de administración particular A61J 3/00; aspectos químicos o utilización de substancias químicas para, la desodorización del aire, la desinfección o la esterilización, vendas, apósitos, almohadillas absorbentes o de los artículos para su realización A61L; composiciones a base de jabón C11D). › A61K 31/00 Preparaciones medicinales que contienen ingredientes orgánicos activos. › Compuestos heterocíclicos.
Clasificación antigua:
- C07D495/00 QUIMICA; METALURGIA. › C07 QUIMICA ORGANICA. › C07D COMPUESTOS HETEROCICLICOS (Compuestos macromoleculares C08). › Compuestos heterocíclicos que contienen en el sistema condensado al menos un heterociclo que tiene átomos de azufre como únicos heteroátomos del ciclo.
Países PCT: Austria, Bélgica, Suiza, Alemania, Dinamarca, España, Francia, Reino Unido, Grecia, Italia, Liechtensein, Luxemburgo, Países Bajos, Suecia, Mónaco, Portugal, Irlanda, Eslovenia, Finlandia, Rumania, Chipre, Lituania, Letonia, Ex República Yugoslava de Macedonia, Albania.
Fragmento de la descripción:
Derivados de azafenantridona y su uso como inhibidores de PARP.
La presente invención se refiere a inhibidores de la enzima nuclear poli(adenosin-5'-difosfo-ribosa) polimerasa ["poli(ADP-ribosa) polimerasa" o "PARP", que también se denomina ADPRT (NAD:proteína (ADP-ribosil-transferasa (polimerizante)) y PARS (poli(ADP-ribosa) sintetasa) y proporciona compuestos y composiciones que contienen los compuestos dados a conocer. Además, la presente invención proporciona métodos de uso de los inhibidores de PARP dados a conocer para prevenir y/o tratar el daño tisular que resulta de la muerte o el daño celular debido a necrosis o apoptosis: daño tisular neural que resulta de, por ejemplo, lesión por isquemia y reperfusión, tal como ictus isquémico cerebral, traumatismo craneal o lesión de la médula espinal; trastornos neurológicos y enfermedades neurodegenerativas, tales como, por ejemplo, enfermedades de Alzheimer o Parkinson y esclerosis múltiple; para prevenir o tratar ictus vascular; para tratar o prevenir trastornos cardiovasculares, tales como, por ejemplo, infarto de miocardio; para tratar otros estados y/o trastornos tales como, por ejemplo, degeneración muscular relacionada con la edad, SIDA y otras enfermedades de senescencia inmunitaria, inflamación, artritis, gota, aterosclerosis, caquexia, cáncer, enfermedades degenerativas del músculo esquelético que implican senescencia replicativa, diabetes (tal como diabetes mellitus), trastornos inflamatorios del intestino (tales como colitis y enfermedad de Crohn), pancreatitis aguda, mucositis, choque hemorrágico, choque por oclusión de la arteria esplácnica, insuficiencia multiorgánica (tal como la que implica cualquiera de los sistemas del riñón, hígado, renal, pulmonar, retiniano, pancreático y/o músculo esquelético), tiroiditis autoinmunitaria aguda, distrofia muscular, artrosis, osteoporosis, dolor agudo y crónico (tal como dolor neuropático), insuficiencia renal, isquemia retiniana, choque septicémico (tal como choque endotóxico), disfunción celular endotelial local y/o remota (tales se reconocen mediante respuestas relajantes dependientes de endotelio y regulación por incremento de moléculas de adhesión), inflamación y envejecimiento de la piel; para extender el tiempo de vida y la capacidad proliferativa de las células, tal como, por ejemplo, como mediadores generales en la generación de compuestos oxidantes, mediadores proinflamatorios y/o citocinas, y mediadores generales de la infiltración de leucocitos, sobrecarga de iones calcio, peroxidación de fosfolípidos, metabolismo de óxido nítrico alterado y/o producción de ATP reducida; para alterar la expresión génica de células senescentes; o para radiosensibilizar células tumorales hipóxicas.
PARP (EC 2.4.2.30), también conocida como PARS (para poli(ADP-ribosa) sintetasa), o ADPRT (para NAD:proteína (ADP-ribosil) transferasa (polimerizante)) es una proteína nuclear principal de 116 kDa. Está presente principalmente en casi todos los eucariotas. La enzima sintetiza poli(ADP-ribosa), un polímero ramificado que puede consistir en más de 200 unidades de ADP-ribosa a partir de NAD. Los aceptores proteicos de poli(ADP-ribosa) están implicados directa o indirectamente en el mantenimiento de la integridad del ADN. Incluyen histonas, topoisomerasas, ADN y ARN polimerasas, ADN ligasas y endonucleasas dependientes de Ca2+ y Mg2+. La proteína PARP se expresa a un alto nivel en muchos tejidos, lo más notablemente en el sistema inmunitario, corazón, cerebro y células de la línea germinal. En condiciones fisiológicas normales, existe una actividad PARP mínima. Sin embargo, el daño del ADN provoca una activación inmediata de PARP en hasta 500 veces. Entre las muchas funciones atribuidas a PARP está su papel principal en la facilitación de la reparación del ADN mediante ADP-ribosilación y por tanto la coordinación de varias proteínas para la reparación del ADN. Como resultado de la activación de PARP, los niveles de NAD disminuyen significativamente. Aunque se ha demostrado que muchos agentes endógenos y exógenos dañan el ADN y activan PARP, el peroxinitrito, formado a partir de una combinación de óxido nítrico (NO) y superóxido, parece que es un autor principal responsable de diversos estados patológicos notificados in vivo, por ejemplo, durante choque, ictus e inflamación.
La extensa activación de PARP conduce a un grave agotamiento de NAD en células que padecen daño masivo del ADN. La corta vida de la poli(ADP-ribosa) (semivida < 1 min.) da como resultado una tasa de recambio rápida. Una vez que se forma la poli(ADP-ribosa), se degrada rápidamente por la poli(ADP-ribosa) glicohidrolasa (PARG) activa constitutivamente, junto con fosfodiesterasa y (ADP-ribosa) proteína liasa. PARP y PARG forman un ciclo que convierte una gran cantidad de NAD en ADP-ribosa. En menos de una hora, la sobreestimulación de PARP puede provocar una caída de NAD y ATP hasta menos del 20% del nivel normal. Un escenario de este tipo es especialmente perjudicial durante la isquemia cuando la privación de oxígeno ya ha comprometido drásticamente la producción de energía celular. Se supone que la posterior producción de radicales libres durante la reperfusión es una causa principal de daño tisular. Parte de la caída de ATP, que es típica en muchos órganos durante la isquemia y reperfusión, puede estar ligada al agotamiento de NAD debido al recambio de poli(ADP-ribosa). Por tanto, se espera que la inhibición de PARP o PARG conserve el nivel de energía celular para potenciar la supervivencia de tejidos isquémicos tras el ataque.
La síntesis de poli(ADP-ribosa) también está implicada en la expresión inducida de varios genes esenciales para la respuesta inflamatoria. Los inhibidores de PARP suprimen la producción de óxido nítrico sintasa inducible (iNOS) en macrófagos, selectina de tipo P y molécula de adhesión intercelular-1 (ICAM-1) en células endoteliales. Tal actividad subyace a los fuertes efectos antiinflamatorios mostrados por los inhibidores de PARP. La inhibición de PARP puede reducir la necrosis impidiendo la translocación e infiltración de neutrófilos en los tejidos lesionados. (Zhang, J. "PARP inhibition: a novel approach to treat ischaemia/reperfusion and inflammation-related injuries", capítulo 10 en Emerging Drugs (1999) 4: 209-221 Ashley Publications Ltd., y referencias citadas en el mismo).
Los fragmentos de ADN dañado activan la producción de PARP la cual, una vez activada, cataliza la unión de hasta 100 unidades de ADP-ribosa a una variedad de proteínas nucleares, incluyendo histonas y la propia PARP.
Durante tensiones celulares importantes, la extensa activación de PARP puede conducir rápidamente a muerte o daño celular a través del agotamiento de las reservas de energía. Puesto que se consumen cuatro moléculas de ATP por cada molécula de NAD (la fuente de ADP-ribosa y el sustrato de PARP) regenerada, se agota el NAD por una activación de PARP masiva y, en los esfuerzos para volver a sintetizar NAD, también puede agotarse el ATP.
Se ha notificado que la activación de PARP desempeña un papel clave en la neurotoxicidad inducida tanto por NMDA como por NO. Esto se ha demostrado en cultivos corticales y en cortes de hipocampo en los que la prevención de la toxicidad se correlaciona directamente con la potencia de la inhibición de PARP (Zhang et al., "Nitric Oxide Activation of Poly(ADP-Ribose) Synthetase in Neurotoxicity", Science, 263: 687-89 (1994) y Wallis et al. "Neuroprotection Against Nitric Oxide Injury with Inhibitors of ADP-Ribosylation", NeuroReport, 5:3, 245-48 (1993)). Por tanto, se ha reconocido el posible papel de los inhibidores de PARP en el tratamiento de enfermedades neurodegenerativas y traumatismo craneal incluso si el mecanismo de acción exacto todavía no se ha aclarado (Endres et al., "Ischemic Brain Injury is Mediated by the Activation of Poly(ADP-Ribose)Polymerase", J. Cereb. Blood Flow Metabol., 17: 1143-51 (1997) y Wallis et al., "Traumatic Neuroprotection with Inhibitors of Nitric Oxide and ADP-Ribosylation", Brain Res., 710: 169-77 (1996)).
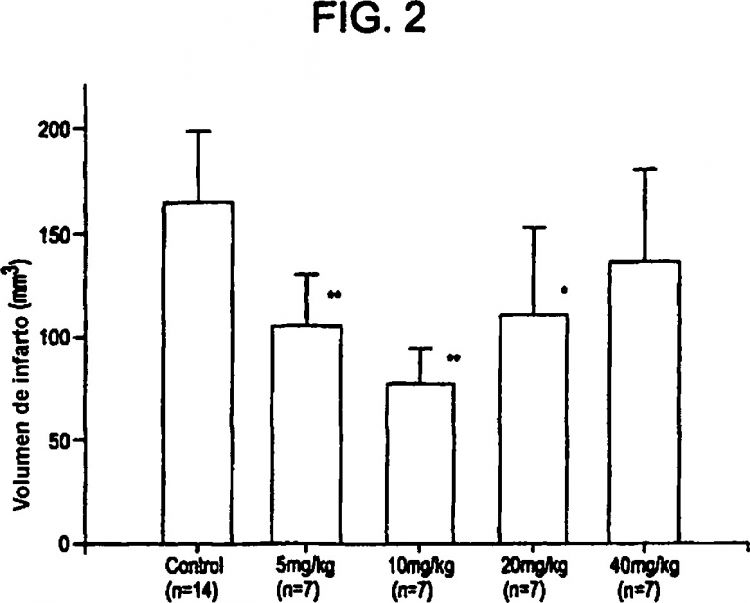
De manera similar, se ha demostrado que inyecciones únicas de los inhibidores de PARP han reducido el tamaño de infarto provocado por la isquemia y reperfusión del corazón o músculo esquelético en conejos. En estos estudios, una única inyección de 3-amino-benzamida (10 mg/kg), o bien un minuto antes de la oclusión o bien un minuto antes de la reperfusión, provocó reducciones similares en el tamaño de infarto en el corazón (32-42%) mientras que 1,5-dihidroxiisoquinolina...
Reivindicaciones:
1. Compuesto seleccionado del grupo que consiste en:


2. Uso de un compuesto según la reivindicación 1 para la preparación de un medicamento para inhibir la actividad de PARP en un mamífero.
3. Uso de un compuesto según la reivindicación 1 para la preparación de un medicamento para el tratamiento de enfermedades o estados seleccionados del grupo que consiste en daño tisular que resulta de la muerte o el daño celular debido a necrosis o apoptosis, enfermedades o daño tisular mediados neuronalmente, daño tisular neural que resulta de lesión por isquemia y reperfusión, degeneración macular relacionada con la edad, SIDA y otras enfermedades de senescencia inmunitaria, artritis, gota, caquexia, cáncer, enfermedades degenerativas del músculo esquelético que implican senescencia replicativa, diabetes, senescencia inmunitaria, distrofia muscular, artrosis, osteoporosis, dolor neuropático, ataque nervioso, lesión de nervio periférico, insuficiencia renal, isquemia retiniana, choque septicémico y envejecimiento de la piel, enfermedades o trastornos que se relacionan con el tiempo de vida o la capacidad proliferativa de las células, y enfermedades o estados patológicos inducidos o exacerbados por la senescencia celular.
4. Composición farmacéutica que comprende un portador farmacéuticamente aceptable y al menos un compuesto según la reivindicación 1.
5. Uso de un compuesto según la reivindicación 1 para la preparación de un medicamento para tratar al menos uno de tejido neural de un mamífero dañado como resultado de una lesión por isquemia o reperfusión, o trastornos neurológicos o enfermedades neurodegenerativas; tratar ictus vascular; tratar trastornos cardiovasculares; tratar al menos un estado seleccionado de degeneración muscular relacionada con la edad, SIDA, una enfermedad de senescencia inmunitaria, inflamación, gota, artritis, aterosclerosis, caquexia, cáncer o enfermedad degenerativa del músculo esquelético que implica senescencia replicativa, diabetes, traumatismo craneal, senescencia inmunitaria, inflamación, gota, trastornos inflamatorios del intestino (tales como colitis y enfermedad de Crohn), distrofia muscular, artrosis, osteoporosis, dolor agudo y/o crónico (tal como dolor neuropático), insuficiencia renal, isquemia retiniana, choque septicémico (tal como choque endotóxico) o envejecimiento de la piel; extender el tiempo de vida y/o la capacidad proliferativa de las células; alterar la expresión génica de células senescentes; radiosensibilizar células tumorales hipóxicas, o tratar una enfermedad cardiovascular en un animal, tal como angina de pecho, infarto de miocardio, isquemia cardiovascular o daño tisular cardiovascular relacionado con la activación de PARP.
6. Uso según la reivindicación 5, en el que dicho trastorno neurológico se selecciona del grupo que consiste en neuropatía periférica provocada por un estado patológico o una lesión física, tal como síndrome de Guillain-Barre, lesión cerebral traumática, daño físico a la médula espinal, ictus asociado con daño cerebral, isquemia focal, isquemia global, lesión por reperfusión, enfermedad desmielinizante, tal como esclerosis múltiple, y trastorno neurológico relacionado con neurodegeneración, tal como enfermedad de Alzheimer, enfermedad de Parkinson y esclerosis lateral amiotrófica; siendo dicha lesión por reperfusión un ictus vascular.
7. Uso según la reivindicación 3, en el que dicho cáncer se selecciona del grupo que consiste en tumores productores de ACTH, leucemia linfocítica aguda, leucemia no linfocítica aguda, cáncer de la corteza suprarrenal, cáncer de vejiga, cáncer de cerebro, cáncer de mama, cáncer cervical, leucemia linfocítica crónica, leucemia mielocítica crónica, cáncer colorrectal, linfoma cutáneo de células T, cáncer endometrial, cáncer de esófago, sarcoma de Ewing, cáncer de vesícula biliar, leucemia de células pilosas, cáncer de cabeza y cuello, linfoma de Hodgkin, sarcoma de Kaposi, cáncer de riñón, cáncer de hígado, cáncer de pulmón (de células pequeñas y/o no pequeñas), derrame peritoneal neoplásico, derrame pleural neoplásico, melanoma, mesotelioma, mieloma múltiple, neuroblastoma, linfoma de no Hodgkin, osteosarcoma, cáncer ovárico, cáncer de ovario (célula germinal), cáncer de próstata, cáncer pancreático, cáncer de pene, retinoblastoma, cáncer de piel, sarcoma de tejidos blandos, carcinomas de células escamosas, cáncer de estómago, cáncer testicular, cáncer de tiroides, neoplasmas trofoblásticos, cáncer uterino, cáncer vaginal, cáncer de la vulva y tumor de Wilm.
8. Uso según la reivindicación 7, en el que dichos cánceres se seleccionan del grupo que consiste en cáncer ovárico, cáncer de próstata, cáncer pancreático, cáncer testicular y cáncer de tiroides.
9. Uso según la reivindicación 7, que comprende además irradiar dicho cáncer con una dosis terapéuticamente eficaz de radiación.
10. Uso según la reivindicación 9, en el que dicha radiación comprende rayos X, y que comprende además administrar a dicho cáncer un radiosensibilizador activado por rayos X seleccionado del grupo que consiste en metronidazol, misonidazol, desmetilmisonidazol, pimonidazol, etanidazol, nimorazol, mitomicina C, RSU 1069, SR4233, E09, RB 6145, nicotinamida, 5-bromodesoxiuridina (BUdR), 5-yododesoxiuridina (IUdR), bromodesoxicitidina, fluorodesoxiuridina (FudR), hidroxiurea, cisplatino y mezclas de los mismos.
11. Uso según la reivindicación 9, en el que dicha radiación comprende luz visible, y que comprende además administrar a dicho cáncer un radiosensibilizador activado por luz visible seleccionado del grupo que consiste en derivados de hematoporfirina, Photofrin, derivados de benzoporfirina, NPe6, etioporfirina de estaño SnET2, feoforbida-a, bacterioclorofila-a, naftalocianinas, ftalocianinas, ftalocianina de cinc y mezclas de los mismos.
12. Uso según la reivindicación 9, que comprende además administrar a dicho cáncer un agente terapéutico adicional seleccionado del grupo que consiste en 5-fluorouracilo, leucovorina, 5'-amino-5'desoxitimidina, oxígeno, carbógeno, transfusiones de glóbulos rojos, perfluorocarbonos (por ejemplo, Fluosol-DA), 2,3-DPG, BW12C, bloqueantes de canales de calcio, pentoxifilina, compuestos antiangiogénesis, hidralazina, LBSO y mezclas de los mismos.
Patentes similares o relacionadas:
Anticuerpo anti-Notch 4 humano, del 1 de Julio de 2020, de EISAI R&D MANAGEMENT CO., LTD: Un anticuerpo anti-Notch4 o un fragmento de unión a Notch4 de este, donde dicho anticuerpo o un fragmento de unión a Notch4 de este comprende cadenas pesadas y ligeras y […]
Administración de gamma-hidroxibutirato con transportadores de monocarboxilato, del 11 de Diciembre de 2019, de Jazz Pharmaceuticals Ireland Limited: Gamma-hidroxibutirato (GHB) o una sal del mismo para su uso en un método de administración de forma segura de GHB o una sal del mismo para tratar la somnolencia […]
Tratamiento de NAFLD y NASH, del 23 de Octubre de 2019, de Cymabay Therapeutics, Inc: Un compuesto que es ácido (R)-2-(4-((2-etoxi-3-(4-(trifluorometil)fenoxi)propil)tio)-2-metilfenoxi)acético (MBX- 8025) o una sal del mismo para su uso en el tratamiento […]
Uso de agonistas de TLR y agente anti-CD47 para mejorar la fagocitosis de las células cancerosas, del 18 de Septiembre de 2019, de THE BOARD OF TRUSTEES OF THE LELAND STANFORD JUNIOR UNIVERSITY: Un método in vitro para aumentar la fagocitosis de las células cancerosas, el método comprendiendo: poner en contacto una población de células fagocíticas […]
Métodos de movilización de células progenitoras/madre, del 7 de Agosto de 2019, de GENZYME CORPORATION: Un compuesto que es 1,1'-[1,4-fenilen-bis-(metilen)]-bis-1,4,8,11-tetraazaciclotetradecano o una sal o complejo metálico farmacéuticamente aceptable del mismo, para su uso en […]
Derivados de pririmidina útiles como inhibidores selectivos de JAK3 y/o JAK1, del 7 de Agosto de 2019, de Shenzhen Chipscreen Biosciences Ltd: Un compuesto de fórmula general (I),**Fórmula** o un estereoisómero, sal farmacéuticamente aceptable o hidrato de la misma, en el que R1 es halógeno […]
Compuestos como moduladores de ror gamma, del 12 de Junio de 2019, de BOEHRINGER INGELHEIM INTERNATIONAL GMBH: Un compuesto de fórmula (I) **Fórmula** en la que: R1 es: -CN; -S(O)nR6; -S(O)nNR7R8; -S(O)(NR9)R 6; -N(R9)C(O)R6; -N(R9)C(O)OR6; […]
Moduladores de ROR gamma de sulfona carbocíclica, del 23 de Mayo de 2019, de BRISTOL-MYERS SQUIBB COMPANY: El compuesto que tiene la siguiente fórmula (I): **Fórmula** o un estereoisómero o una sal farmacéuticamente aceptable del mismo, en donde: […]