CITOQUINAS MULTIFUNCIONALES.
Composición farmacéutica que comprende una cantidad (i) una proteína de fusión con la fórmula:
Y-X, en la que X representa IL-2 e Y representa IL-7, o (ii) un vector que contiene una molécula de ácido nucleico que codifica una proteína de fusión según (i); o (iii) una partícula viral infecciosa que comprende una molécula de ácido nucleico que codifica una proteína de fusión según (i) o un vector según (ii), o (iv) una célula huésped que comprende una molécula ácido nucleico que codifica una proteína de fusión según (i) o un vector según (ii) o una partícula viral infecciosa según (iii); o cualquier combinación de los mismos y, de manera opcional, un vehículo farmacéuticamente aceptable, para la utilización como medicamento
Tipo: Patente Internacional (Tratado de Cooperación de Patentes). Resumen de patente/invención. Número de Solicitud: PCT/EP2004/008114.
Solicitante: TRANSGENE S.A..
Nacionalidad solicitante: Francia.
Dirección: BOULEVARD GONTHIER D'ANDERNACH PARC D'INNOVATION, CS80166 67405 ILLKIRCH GRAFFENSTADEN C FRANCIA.
Inventor/es: PAUL, STEPHANE.
Fecha de Publicación: .
Fecha Solicitud PCT: 20 de Julio de 2004.
Clasificación PCT:
- A61K38/19 NECESIDADES CORRIENTES DE LA VIDA. › A61 CIENCIAS MEDICAS O VETERINARIAS; HIGIENE. › A61K PREPARACIONES DE USO MEDICO, DENTAL O PARA EL ASEO (dispositivos o métodos especialmente concebidos para conferir a los productos farmacéuticos una forma física o de administración particular A61J 3/00; aspectos químicos o utilización de substancias químicas para, la desodorización del aire, la desinfección o la esterilización, vendas, apósitos, almohadillas absorbentes o de los artículos para su realización A61L; composiciones a base de jabón C11D). › A61K 38/00 Preparaciones medicinales que contienen péptidos (péptidos que contienen ciclos beta-lactama A61K 31/00; dipéptidos cíclicos que no tienen en su molécula ningún otro enlace peptídico más que los que forman su ciclo, p. ej. piperazina 2,5-dionas, A61K 31/00; péptidos basados en la ergolina A61K 31/48; que contienen compuestos macromoleculares que tienen unidades aminoácido repartidas estadísticamente A61K 31/74; preparaciones medicinales que contienen antígenos o anticuerpos A61K 39/00; preparaciones medicinales caracterizadas por los ingredientes no activos, p. ej. péptidos como soportes de fármacos, A61K 47/00). › Citoquinas; Linfoquinas; Interferones.
- A61K48/00 A61K […] › Preparaciones medicinales que contienen material genético que se introduce en las células del cuerpo vivo para tratar enfermedades genéticas; Terapia génica.
- C07K14/54 QUIMICA; METALURGIA. › C07 QUIMICA ORGANICA. › C07K PEPTIDOS (péptidos que contienen β -anillos lactamas C07D; ipéptidos cíclicos que no tienen en su molécula ningún otro enlace peptídico más que los que forman su ciclo, p. ej. piperazina diones-2,5, C07D; alcaloides del cornezuelo del centeno de tipo péptido cíclico C07D 519/02; proteínas monocelulares, enzimas C12N; procedimientos de obtención de péptidos por ingeniería genética C12N 15/00). › C07K 14/00 Péptidos con más de 20 aminoácidos; Gastrinas; Somatostatinas; Melanotropinas; Sus derivados. › Interleuquinas (IL).
- C07K14/55 C07K 14/00 […] › IL-2.
- C07K14/57 C07K 14/00 […] › IFN gamma.
- C12N15/62 C […] › C12 BIOQUIMICA; CERVEZA; BEBIDAS ALCOHOLICAS; VINO; VINAGRE; MICROBIOLOGIA; ENZIMOLOGIA; TECNICAS DE MUTACION O DE GENETICA. › C12N MICROORGANISMOS O ENZIMAS; COMPOSICIONES QUE LOS CONTIENEN; PROPAGACION, CULTIVO O CONSERVACION DE MICROORGANISMOS; TECNICAS DE MUTACION O DE INGENIERIA GENETICA; MEDIOS DE CULTIVO (medios para ensayos microbiológicos C12Q 1/00). › C12N 15/00 Técnicas de mutación o de ingeniería genética; ADN o ARN relacionado con la ingeniería genética, vectores, p. ej. plásmidos, o su aislamiento, su preparación o su purificación; Utilización de huéspedes para ello (mutantes o microorganismos modificados por ingeniería genética C12N 1/00, C12N 5/00, C12N 7/00; nuevas plantas en sí A01H; reproducción de plantas por técnicas de cultivo de tejidos A01H 4/00; nuevas razas animales en sí A01K 67/00; utilización de preparaciones medicinales que contienen material genético que es introducido en células del cuerpo humano para tratar enfermedades genéticas, terapia génica A61K 48/00; péptidos en general C07K). › Secuencias de ADN que codifican proteínas de fusión.
- C12N15/861 C12N 15/00 […] › Vectores adenovirales.
Clasificación antigua:
- A61K38/19 A61K 38/00 […] › Citoquinas; Linfoquinas; Interferones.
- A61K48/00 A61K […] › Preparaciones medicinales que contienen material genético que se introduce en las células del cuerpo vivo para tratar enfermedades genéticas; Terapia génica.
- C07K14/54 C07K 14/00 […] › Interleuquinas (IL).
- C07K14/55 C07K 14/00 […] › IL-2.
- C12N15/62 C12N 15/00 […] › Secuencias de ADN que codifican proteínas de fusión.
- C12N15/861 C12N 15/00 […] › Vectores adenovirales.
Países PCT: Austria, Bélgica, Suiza, Alemania, Dinamarca, España, Francia, Reino Unido, Grecia, Italia, Liechtensein, Luxemburgo, Países Bajos, Suecia, Mónaco, Portugal, Irlanda, Eslovenia, Finlandia, Rumania, Chipre.
PDF original: ES-2356154_T3.pdf


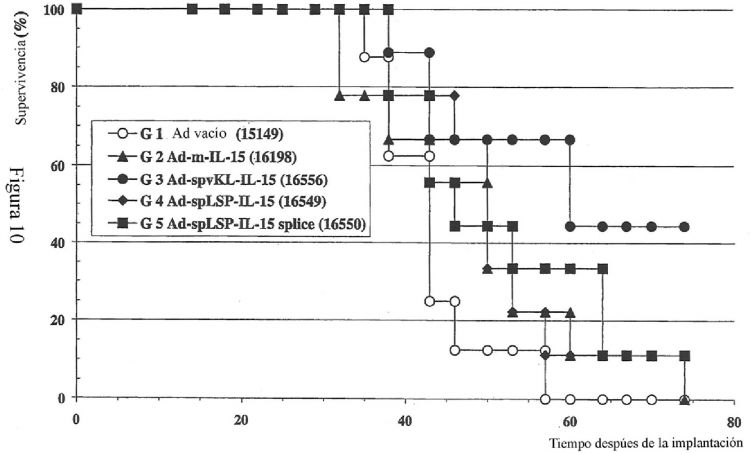
Fragmento de la descripción:
La presente invención se refiere a una composición farmacéutica que comprende una cantidad eficaz de (i) una proteína de fusión con fórmula: Y-X, en la que X representa IL-2 e Y representa IL-7; o (ii) un vector que contiene una molécula de ácido nucleico que codifica una proteína de fusión según (i); o
(iii) una partícula viral infecciosa que comprende una molécula de ácido nucleico que codifica una proteína de fusión según (i) o un vector según (ii); o (iv) una célula huésped que comprende una molécula de ácido nucleico que codifica una proteína de fusión según (i) o un vector según (ii) o una partícula viral infecciosa según (iii); o cualquier combinación de los mismos y, de manera opcional, un vehículo farmacéuticamente aceptable, para la utilización como medicamento. La presente invención también se refiere a la utilización, tal como se define en las reivindicaciones, de dicha proteína de fusión y un vector que comprende una molécula de ácido nucleico que codifica dicha proteína de fusión. La presente invención también da a conocer la utilización, tal como se define en las reivindicaciones, de partículas virales infecciosas y células huésped que comprenden una molécula de ácido nucleico que codifica dicha proteína de fusión o dicho vector. La presente descripción también se refiere a un método para producir de manera recombinante dicha proteína de fusión. Finalmente, la presente invención también da a conocer una composición farmacéutica que comprende dicha proteína de fusión, una molécula de ácido nucleico, un vector, partículas virales infecciosas y una célula huésped, así como la utilización terapéutica de los mismos.
La presente invención es útil, de manera particular, en el campo de la terapia génica y la inmunoterapia, especialmente para el tratamiento o la prevención de un conjunto de enfermedades, que incluyen cánceres y enfermedades infecciosas (infecciones por bacterias y virus).
De forma general, las respuestas inmunes del huésped se encuentran en dos categorías: no específicas (o innatas) o específicas (o adaptativas o adquiridas). La diferencia entre éstas es que una respuesta inmune especifica es altamente específica para un antígeno concreto, mientras que una respuesta no específica no depende de la exposición repetida a un patógeno/antígeno determinado. Las redes que controlan el sistema inmune dependen de las proteínas secretadas (por ejemplo, citoquinas) para activar y desactivar las funciones de las células inmunes, así como para regular su proliferación y para controlar la magnitud de la respuesta inmune. De manera específica, dos tipos de linfocitos – células B y células T – se encuentran en el núcleo de la inmunidad específica. Después de la liberación por un antígeno, las células B se dividen y las células hija sintetizan y secretan moléculas de anticuerpo (inmunidad humoral). La activación de las células T implica el desarrollo de la inmunidad mediada por células, mediada entre otros por linfocitos T citotóxicos (CTL) que eliminan de manera específica células diana no portadoras de auto-antígenos (por ejemplo, células infectadas o tumorales). La activación de una respuesta inmune específica (o adaptativa) está orquestada por numerosas citoquinas. Particularmente importantes son las interleuquinas (IL)-1, IL-2, IL-6, IL-7, IL-15 e interferón gamma (IFNg). Por otro lado, las respuestas no específicas (innatas) implican diferentes tipos de células inmunes, incluyendo células asesinas (“killer”) naturales (NK), células T Asesinas Naturales (NKT), células dendríticas (DCs) y macrófagos, y están, entre otras, mediadas por la secreción de citoquinas, tales como IL-2, IL-12, IL-15, IL-18 e IL-21. En realidad, sin embargo, la diferencia estricta entre las respuestas inmunes específica y no específica es algo arbitraria, ya que la eliminación de patógenos y tumores in vivo es probable que implique que ambos tipos de respuesta inmune actúan de manera conjunta. Además, a través de los mecanismos de señalización de las citoquinas, los efectores específicos pueden jugar un papel principal en la inducción y activación de efectores no específicos y viceversa. Por ejemplo, una propiedad sorprendente de las células NKT es su capacidad de producir rápidamente grandes cantidades de citoquinas en respuesta al acoplamiento de receptores de células T, sugiriendo que las células NKT activadas también pueden modular respuestas inmunes específicas. Para una discusión general de la respuesta inmune, células efectoras inmunes y mediadores inmunes, véase, por ejemplo, las ediciones más actualizadas de “Encyclopedia of Immunology” (Enciclopedia de Inmunología) (Editada por Ivan Roitt y Peter Delves; Academic Press Limited) y “Fundamental Immunology” (Inmunología Fundamental) (por ejemplo, 2ª Edición, editada por W. Paul; Raven Press).
En general, se acepta que el cáncer es un proceso de múltiples etapas que resulta de una pérdida del control de la multiplicación celular. Existe un gran cúmulo de investigaciones que apoyan la implicación de antígenos asociados a tumores (TAA) en la aparición del fenotipo maligno. Estos antígenos incluyen productos de oncogenes (por ejemplo, p53, ras, neu, erb), productos génicos embrionarios reactivados (por ejemplo, P91A hallado en el mastocitoma P815), autoantígenos modificados (por ejemplo, MUC-1 hiperglicosilado), genes virales oncogénicos (por ejemplo, antígenos tempranos del virus del papiloma) y un conjunto de otros. Con respecto al mecanismo que actúa en el reconocimiento y la eliminación de células tumorales, se ha observado que los linfocitos T desempeñan un papel clave para conferir especificidad al rechazo del tumor. En particular, se identificaron los linfocitos T citotóxicos (CTL) CD8+ como células efectoras importantes para reconocer antígenos tumorales específicos. Los CTL pueden eliminar tumores sólo después de haber sido sensibilizados previamente para un antígeno tumoral y sólo cuando son presentados en la superficie celular por productos génicos de MHC de clase I. En muchos casos, la inducción de la respuesta antitumoral también depende de la presencia de células T CD4+. Además de estas células efectoras inmunes específicas, se han identificado funciones en el rechazo tumoral para las células NK y otras células efectoras no específicas, tales como NKT y macrófagos, que pueden lisar células tumorales de una manera que no es dependiente de antígeno y no está limitada a MHC.
A pesar del hecho de que la amplia mayoría de antígenos asociados a tumores son capaces de ser reconocidos como exógenos por el sistema inmune del paciente y la abundancia de mecanismos inmunes tumoricidas, la mayoría de cánceres no provocan respuestas inmunológicas suficientes para controlar el crecimiento de células malignas. Las células tumorales han desarrollado diversos mecanismos que les permiten escapar de la inmunidad del huésped debido a una reducción en la presentación de antígenos por las células tumorales o debido a una disminución generalizada en la inmunidad del paciente. Como la expresión de los determinantes de MHC de clase I en la superficie celular es esencial para el reconocimiento de antígenos exógenos por los CTL, la supresión o fracaso en la expresión de antígenos de MHC de clase I es uno de los mecanismos descritos utilizados por las células tumorales para eludir el sistema inmune (Tanaka y otros, 1988, Ann. Rev. Immunol. 6, 359-380). Otro mecanismo de la anergia inmune implica la liberación de antígenos tumorales, evitando de este modo la interacción de las células inmunes con la propia célula diana tumoral. Además, los tumores pueden activar moléculas inmunosupresoras para disminuir la fuerza de las respuestas inmunes a los antígenos tumorales o para activar la apoptosis de células efectoras inmunes. Por ejemplo, IL-2 puede tener en algunas circunstancias, un papel crítico en el mantenimiento de la tolerancia periférica. Como resultado de su papel fundamental en la muerte celular inducida por activación (AICD), las células T generadas en respuesta a vacunas tumorales que contienen IL-2 pueden interpretar las células tumorales como propias y las células T reactivas al tumor pueden ser eliminadas por la apoptosis inducida por AICD (Lenardo, 1996, J. Exp. Med. 183, 721-724). Además, la IL-2 mantiene las células T reguladoras negativas CD4+CD25+ y se ha descrito que terminan la persistencia de células T de memoria CD8+ (Shevach, 2000, Ann. Rev. Immunol. 18, 423-449).
Un conjunto de estudios han descrito un papel crítico para las células CD4(+) específicas de tumor en el... [Seguir leyendo]
Reivindicaciones:
1. Composición farmacéutica que comprende una cantidad
eficaz de
(i) una proteína de fusión con la fórmula: Y-X, en la que X representa IL-2 e Y representa IL-7, o
(ii) un vector que contiene una molécula de ácido nucleico que codifica una proteína de fusión según (i); o
(iii) una partícula viral infecciosa que comprende una molécula de ácido nucleico que codifica una proteína de fusión según (i) o un vector según (ii), o
(iv) una célula huésped que comprende una molécula ácido nucleico que codifica una proteína de fusión según (i) o un vector según (ii) o una partícula viral infecciosa según (iii);
o cualquier combinación de los mismos y, de manera opcional, un vehículo farmacéuticamente aceptable, para la utilización como medicamento.
2. Composición farmacéutica, según la reivindicación 1, en la que dicha IL-2 es una variante de IL-2 seleccionada del grupo que consiste en:
(i) la variante F42K que tiene el residuo de fenilalanina en la posición 42 de la IL-2 nativa sustituido por un residuo de lisina;
(ii) la variante R38A que tiene el residuo de arginina en la posición 38 de la IL-2 nativa sustituido por un residuo de alanina;
(iii) la variante D20I que tiene el residuo de ácido aspártico en la posición 20 de la IL-2 nativa sustituido por un residuo de isoleucina;
(iv) la variante N88G que tiene el residuo de asparagina en la posición 88 de la IL-2 nativa sustituido por un residuo de glicina;
(v) la variante N88R que tiene el residuo de asparagina en la posición 88 de la IL-2 nativa sustituido por un residuo de arginina;
(vi) la variante Q126M que tiene el residuo de glutamina en la posición 126 de la IL-2 nativa sustituido por un residuo de metionina; y
(vii) cualquier combinación de (i) a (vi).
3. Composición farmacéutica, según la reivindicación 1 ó 2, en la que dicha proteína de fusión comprende una secuencia de
aminoácidos que es, como mínimo, el 70% idéntica con la secuencia de aminoácidos indicada en la SEC ID NO: 1 ó 2.
4. Composición farmacéutica, según la reivindicación 3, en la que dicha proteína de fusión comprende una secuencia de aminoácidos que es el 100% idéntica con la secuencia de aminoácidos indicada en la SEC ID NO: 1 ó 2.
5. Composición farmacéutica, según cualquiera de las reivindicaciones 1 a 4, en la que dicho vector es un plásmido bacteriano, bacteriófago, episoma de levadura, cromosoma artificial, o un virus seleccionado del grupo que consiste en baculovirus, papovavirus, virus del herpes, adenovirus, virus asociados a adenovirus (AAV), poxvirus, virus espumosos y retrovirus.
6. Composición farmacéutica, según la reivindicación 5, en la que dicho vector es un vector adenoviral.
7. Composición farmacéutica, según la reivindicación 6, en la que dicho vector es un vector adenoviral defectuoso en la replicación con E1 y E3 eliminadas que comprende la molécula de ácido nucleico que codifica dicha proteína de fusión insertada en sustitución de la región E1 y situada bajo el control del promotor de CMV.
8. Composición farmacéutica, según cualquiera de las reivindicaciones 1 a 7, en la que dicho vector comprende además uno
o más transgenes que codifican (i) un inhibidor de la proliferación de tumores y/o (ii) como mínimo, un antígeno contra el que se desea una respuesta inmune.
9. Composición farmacéutica, según la reivindicación 8, en la que dicho inhibidor de la proliferación de tumores es una proteína de fusión que codifica una enzima de dos dominios que posee las actividades de citosín desaminasa y uracil fosforibosil transferasa.
10. Composición farmacéutica, según la reivindicación 8 ó 9, en la que dicho antígeno específico es un antígeno de HPV seleccionado del grupo que consiste en E5, E6, E7, L1 y L2, ya sea de forma individual o en combinación.
11. Composición farmacéutica, según la reivindicación 10, en la que dicho antígeno de HPV es una forma anclada a membrana de una variante no oncogénica del antígeno temprano E6 y/o E7 de HPV-16.
12. Utilización de:
(i) una proteína de fusión con la fórmula: Y-X, en la que X representa IL-2 e Y representa IL-7, o
(ii) un vector que contiene una molécula de ácido nucleico que codifica una proteína de fusión según (i); o
(iii) una partícula viral infecciosa que comprende una molécula de ácido nucleico que codifica una proteína de fusión según (i) o un vector según (ii), o
(iv) una célula huésped que comprende una molécula ácido nucleico que codifica una proteína de fusión según (i) o un vector según (ii) o una partícula viral infecciosa según (iii);
o cualquier combinación de los mismos para la preparación de una composición farmacéutica para el tratamiento o la prevención del cáncer o una enfermedad infecciosa.
13. Proteína de fusión, vector, partícula viral infecciosa o célula huésped, tal como se define en la reivindicación 12, para la utilización en el tratamiento o la prevención del cáncer o una enfermedad infecciosa.
14. Utilización, según la reivindicación 12, o proteína de fusión, vector, partícula viral infecciosa o célula huésped, según la reivindicación 13, en los que dicha IL-2 es una variante de IL-2 seleccionada del grupo que consiste en:
(i) la variante F42K que tiene el residuo de fenilalanina en la posición 42 de la IL-2 nativa sustituido por un residuo de lisina;
(ii) la variante R38A que tiene el residuo de arginina en la posición 38 de la IL-2 nativa sustituido por un residuo de alanina;
(iii) la variante D20I que tiene el residuo de ácido aspártico en la posición 20 de la IL-2 nativa sustituido por un residuo de isoleucina;
(iv) la variante N88G que tiene el residuo de asparagina en la posición 88 de la IL-2 nativa sustituido por un residuo de glicina;
(v) la variante N88R que tiene el residuo de asparagina en la posición 88 de la IL-2 nativa sustituido por un residuo de arginina;
(vi) la variante Q126M que tiene el residuo de glutamina en la posición 126 de la IL-2 nativa sustituido por un residuo de metionina; y
(vii) cualquier combinación de (i) a (vi).
15. Utilización, según la reivindicación 12 ó 14, o proteína de fusión, vector, partícula viral infecciosa o célula huésped, según la reivindicación 13 ó 14, en los que dicha proteína de fusión comprende una secuencia de aminoácidos que es, como mínimo, el 70% idéntica con la secuencia de aminoácidos indicada en la SEC ID NO: 1 ó 2.
16. Utilización, según la reivindicación 15, o proteína de fusión, vector, partícula viral infecciosa o célula huésped, según la reivindicación 15, en los que dicha proteína de fusión comprende una secuencia de aminoácidos que es el 100% idéntica con la secuencia de aminoácidos indicada en la SEC ID NO: 1 ó 2.
17. Utilización, según cualquiera de las reivindicaciones 12 y 14 a 16, o proteína de fusión, vector, partícula viral infecciosa o célula huésped, según cualquiera de las reivindicaciones 13 a 16, en los que dicho vector es un plásmido bacteriano, bacteriófago, episoma de levadura, cromosoma artificial, o un virus seleccionado del grupo que consiste en baculovirus, papovavirus, virus del herpes, adenovirus, virus asociados a adenovirus (AAV), poxvirus, virus espumosos y retrovirus.
18. Utilización, según la reivindicación 17, o proteína de fusión, vector, partícula viral infecciosa o célula huésped, según la reivindicación 17, en los que dicho vector es un vector adenoviral.
19. Utilización, según la reivindicación 18, o proteína de fusión, vector, partícula viral infecciosa o célula huésped, según la reivindicación 18, en los que dicho vector es un vector adenoviral defectuoso en la replicación con E1 y E3 eliminadas que comprende la molécula de ácido nucleico que codifica dicha proteína de fusión insertada en sustitución de la región E1 y situada bajo el control del promotor de CMV.
20. Utilización, según cualquiera de las reivindicaciones 12 y 14 a 19, o proteína de fusión, vector, partícula viral infecciosa o célula huésped, según cualquiera de las reivindicaciones 13 a 19, en los que dicho vector comprende además uno o más transgenes que codifican (i) un inhibidor de la proliferación de tumores y/o (ii) como mínimo, un antígeno contra el que se desea una respuesta inmune.
21. Utilización, según la reivindicación 20, o proteína de fusión, vector, partícula viral infecciosa o célula huésped,
según la reivindicación 20, en los que dicho inhibidor de la proliferación de tumores es una proteína de fusión que codifica una enzima de dos dominios que posee las actividades de citosín desaminasa y uracil fosforibosil transferasa.
22. Utilización, según la reivindicación 20 ó 21, o proteína de fusión, vector, partícula viral infecciosa o célula huésped, según la reivindicación 20 ó 21, en los que dicho antígeno específico es un antígeno de HPV seleccionado del grupo que consiste en E5, E6, E7, L1 y L2, ya sea de forma individual o en combinación.
23. Utilización, según la reivindicación 22, o proteína de fusión, vector, partícula viral infecciosa o célula huésped, según la reivindicación 22, en los que dicho antígeno de HPV es una forma anclada a membrana de una variante no oncogénica del antígeno temprano E6 y/o E7 de HPV-16.
24. Utilización, según cualquiera de las reivindicaciones 12 y 14 a 23, o proteína de fusión, vector, partícula viral infecciosa o célula huésped, según cualquiera de las reivindicaciones 13 a 23, en los que dicha composición farmacéutica, proteína de fusión, vector, partícula viral infecciosa o célula huésped se administran en un tumor sólido o próximo al mismo.
25. Utilización, según cualquiera de las reivindicaciones 12 y 14 a 24, o proteína de fusión, vector, partícula viral infecciosa o célula huésped, según cualquiera de las reivindicaciones 13 a 24, en los que dicha composición farmacéutica, proteína de fusión, vector, partícula viral infecciosa o célula huésped se administran en combinación con uno o más transgenes o productos de transgenes.
26. Utilización de una proteína de fusión, un vector, una partícula viral infecciosa o una célula huésped, tal como se define en cualquiera de las reivindicaciones 12 y 14 a 23, para la preparación de una composición farmacéutica para aumentar una respuesta inmune.
27. Proteína de fusión, vector, partícula viral infecciosa o célula huésped, tal como se define en cualquiera de las reivindicaciones 13 a 23, para la utilización en un medicamento para aumentar una respuesta inmune.
28. Utilización de una proteína de fusión, un vector, una partícula viral infecciosa o una célula huésped, tal como se
define en cualquiera de las reivindicaciones 12 y 14 a 23, para la preparación de una composición farmacéutica para activar la maduración de células dendríticas en un animal u organismo humano.
29. Proteína de fusión, vector, partícula viral
5 infecciosa o célula huésped, tal como se define en cualquiera de las reivindicaciones 13 a 23, para la utilización en un medicamento para activar la maduración de células dendríticas en un animal u organismo humano.
30. Utilización de una proteína de fusión, un vector,
10 una partícula viral infecciosa o una célula huésped, tal como se define en cualquiera de las reivindicaciones 12 y 14 a 23, para la preparación de una composición farmacéutica para activar células NKT en un animal u organismo humano.
31. Proteína de fusión, vector, partícula viral
15 infecciosa o célula huésped, tal como se define en cualquiera de las reivindicaciones 13 a 23, para la utilización en un medicamento para activar células NKT en un animal u organismo humano.
Patentes similares o relacionadas:
Composiciones útiles en el tratamiento de la deficiencia de ornitina transcarbamilasa (OTC), del 8 de Julio de 2020, de THE TRUSTEES OF THE UNIVERSITY OF PENNSYLVANIA: Un vector vírico recombinante que comprende una secuencia de ácido nucleico que codifica la proteína ornitina transcarbamilasa humana (hOTC) y secuencias […]
Terapia génica para la diabetes, del 8 de Julio de 2020, de UCL Business Ltd: Una molécula de ácido nucleico que comprende una secuencia de nucleótidos que codifica una proteína preproinsulina funcional en donde la secuencia de nucleótidos tiene al menos […]
Vacuna de ADN que contiene un epítopo específico de VEGF y/o un epítopo específico de angiopoyetina-2, del 1 de Julio de 2020, de OSAKA UNIVERSITY: Un vector de expresión que codifica un polipéptido del antígeno del núcleo del virus de la hepatitis B quimérico con una inserción para uso en el tratamiento o la profilaxis […]
Composiciones para modular la expresión de SOD-1, del 24 de Junio de 2020, de Biogen MA Inc: Un compuesto antisentido según la siguiente fórmula: mCes Aeo Ges Geo Aes Tds Ads mCds Ads Tds Tds Tds mCds Tds Ads mCeo Aes Geo mCes Te (secuencia […]
Ácido nucleico antisentido, del 24 de Junio de 2020, de NIPPON SHINYAKU CO., LTD.: Un oligómero antisentido de 14 a 32 bases de longitud, que comprende dos unidades de oligómeros conectadas seleccionadas del grupo que consiste […]
Plekhg5 como diana farmacéutica para trastornos neurológicos, del 15 de Junio de 2020, de CONSEJO SUPERIOR DE INVESTIGACIONES CIENTIFICAS (CSIC): Plekhg5 como diana farmacéutica para trastornos neurológicos. La invención hace referencia al uso del gen Plekhg5 como diana farmacológica para el cribado, […]
Vectores de AAV dirigidos a oligodendrocitos, del 10 de Junio de 2020, de THE UNIVERSITY OF NORTH CAROLINA AT CHAPEL HILL: Un ácido nucleico que codifica una cápside de AAV, comprendiendo el ácido nucleico una secuencia codificante de la cápside de AAV que es al menos el 96 % idéntica […]
Método para activar células T auxiliares, del 10 de Junio de 2020, de OTSUKA PHARMACEUTICAL CO., LTD.: Una composición para su uso en el tratamiento o prevención del cáncer mediante la activación de células T auxiliares en un sujeto, en donde dicha composición […]