ANÁLOGOS DE NUCLEÓSIDOS DE PURINA PARA EL TRATAMIENTO DE ENFERMEDADES CAUSADAS POR FLAVIRIDAE INCLUYENDO HEPATITIS C.
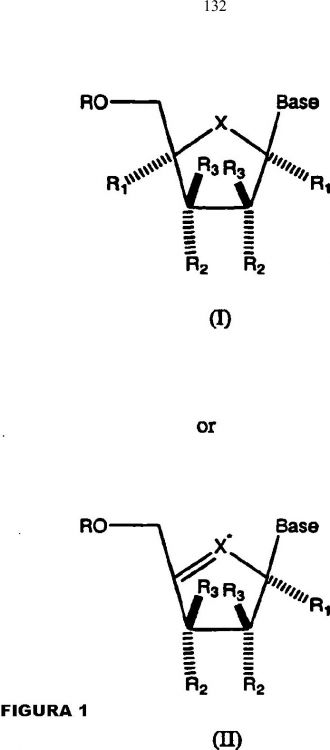
Un compuesto de la estructura general de la Fórmula (I): **(Ver fórmula)**o una sal farmacológicamente aceptable del mismo,
donde: R es H; mono-, di- o trifosfato; o fosfonato; X es O; R1 y R1' son independientemente H, alquilo, ácido, ciano, alquenilo, alquinilo, -C(O)-(alquilo), -C(O)(O)(alquenilo), -C(O) (O)(alquinilo), C(O) NH2,-C(O)NH(alquilo), -C(O)N(alquilo)2, -C(H)=N-NH2, C(S)NH(alquilo), o C(S)N(alquilo)2; donde alquilo, alquenilo, y/o alquinilo puede sustituirse de manera opcional; R2 y R3 es independientemente H, OH, NH2, SH, F, Cl, Br, I, CN, NO2, -C(O)NH2, -C(O)NH(alquilo), y -C(O)N(alquilo)2, N3, alquilo opcionalmente sustituido, alquenilo or alquinilo opcionalmente sustituido, -C(O)O-(alquilo), C(O)O-(alquenilo), -C(O)O-(alquinilo), O(acilo), -O(alquilo), -O(alquenilo), -O(alquinilo), -OC(O)NH2, NC, C(O)OH, SCN, OCN, -S(alquilo), -S(alquenilo), -S(alquinilo), NH(alquilo), -N(alquilo)2, -NH(alquenilo), -NH(alquinilo), un residuo de aminoácido o un derivado, o un anillo heterocíclico de 3-7 miembros opcionalmente sustituido que tiene O, S y/o N independientemente como un heteroátomo tomado solo o en combinación; R2' es alquilo, alquenilo, o alquinilo opcionalmente sustituido; halógeno, ácido o ciano; R3' es H; alquilo, alquenilo, o alquinilo opcionalmente sustituido; C(O)O-(alquilo), -C(O)O-(alquenilo), -C(O)O-(alquinilo), -C(O)NH2, C(O)NH(alquilo), halógeno, ácido, ciano, NO2, -S(alquilo), S(alquenilo), -S(alquinilo), NH2, -NH(alquilo), -N(alquilo)2, NH(alquenilo),-NH(alquinilo), -NH(acilo) o N(acilo)2; y Base se selecciona del grupo consistente en: **(Ver fórmula)**donde cada R' and R independientemente es H, C1-6 alquilo, C2-6 alquenilo, C2-6 alquinilo, halógeno, alquilo halogenado, OH, CN, N3, carboxi, C1-4 alcoxicarbonilo,NH2, C1-4 alquiloamino, di(C1-4 alquilo)amino,C16 alcoxi,C1-6 alquilosulfonilo, o (C1-4 alquilo)0-2 aminometilo; cada W es independientemente H, Cl, Br, I, F, alquilo halogenado, alcoxi, OH, SH, O-alquilo, S-alquilo, O-alquenilo, O-alquinilo, Salquenilo, S-alquinilo, -OC(O)NR4R4, O-acilo, S-acilo, CN, SCN, OCN, NO2, N3, NH2, NH(alquilo), N(alquilo)2, NH-cicloalquilo, NHacilo, NH=NH, CONH2, CONH(alquilo), o CON(alquilo)2; y cada R4 es independientemente H, acilo, o C1-6 alquilo; y cada Z es independientemente O, S, NH, N-OH, N-NH2, N(alquilo), N(alquilo)2, N-cicloalquilo, alcoxi, CN, SCN, OCN, SH, NO2, N3, NH=NH, CONH2, CONH(alquilo), o CON(alquilo)2
Tipo: Patente Internacional (Tratado de Cooperación de Patentes). Resumen de patente/invención. Número de Solicitud: PCT/IB2004/002703.
Solicitante: IDENIX PHARMACEUTICALS, INC.
CENTRE NATIONAL DE LA RECHERCHE SCIENTIFIQUE (CNRS)
L'UNIVERSITE MONTPELLIER II.
Nacionalidad solicitante: Estados Unidos de América.
Dirección: ONE KENDALL SQUARE, BUILDING 1400 CAMBRIDGE, MA 02139 ESTADOS UNIDOS DE AMERICA.
Inventor/es: GOSSELIN, GILLES, LEROY, FREDERIC, STORER, RICHARD, DUKHAN,DAVID.
Fecha de Publicación: .
Fecha Solicitud PCT: 26 de Julio de 2004.
Fecha Concesión Europea: 25 de Agosto de 2010.
Clasificación Internacional de Patentes:
- A61K31/00 NECESIDADES CORRIENTES DE LA VIDA. › A61 CIENCIAS MEDICAS O VETERINARIAS; HIGIENE. › A61K PREPARACIONES DE USO MEDICO, DENTAL O PARA EL ASEO (dispositivos o métodos especialmente concebidos para conferir a los productos farmacéuticos una forma física o de administración particular A61J 3/00; aspectos químicos o utilización de substancias químicas para, la desodorización del aire, la desinfección o la esterilización, vendas, apósitos, almohadillas absorbentes o de los artículos para su realización A61L; composiciones a base de jabón C11D). › Preparaciones medicinales que contienen ingredientes orgánicos activos.
- A61K31/706 A61K […] › A61K 31/00 Preparaciones medicinales que contienen ingredientes orgánicos activos. › conteniendo ciclos de seis eslabones con el nitrógeno como heteroatomo de un ciclo.
- C07H19/044 QUIMICA; METALURGIA. › C07 QUIMICA ORGANICA. › C07H AZUCARES; SUS DERIVADOS; NUCLEOSIDOS; NUCLEOTIDOS; ACIDOS NUCLEICOS (derivados de ácidos aldónicos o sacáricos C07C, C07D; ácidos aldónicos, ácidos sacáricos C07C 59/105, C07C 59/285; cianohidrinas C07C 255/16; glicales C07D; compuestos de constitución indeterminada C07G; polisacáridos, sus derivados C08B; ADN o ARN concerniente a la ingeniería genética, vectores, p. ej. plásmidos o su aislamiento, preparación o purificación C12N 15/00; industria del azúcar C13). › C07H 19/00 Compuestos que contienen un heterociclo que comparten un heteroátomo del ciclo con un radical sacárido; Nucleósidos; Mononucleótidos; Sus anhidro-derivados. › Radicales pirrol.
- C07H19/052 C07H 19/00 […] › Radicales imidazol.
- C07H19/056 C07H 19/00 […] › Radicales triazol o tetrazol.
Clasificación PCT:
- A61K31/706 A61K 31/00 […] › conteniendo ciclos de seis eslabones con el nitrógeno como heteroatomo de un ciclo.
- A61P31/14 A61 […] › A61P ACTIVIDAD TERAPEUTICA ESPECIFICA DE COMPUESTOS QUIMICOS O DE PREPARACIONES MEDICINALES. › A61P 31/00 Antiinfecciosos, es decir antibióticos, antisépticos, quimioterápicos. › para virus ARN.
- C07H19/044 C07H 19/00 […] › Radicales pirrol.
- C07H19/052 C07H 19/00 […] › Radicales imidazol.
- C07H19/056 C07H 19/00 […] › Radicales triazol o tetrazol.
Clasificación antigua:
- A61K31/706 A61K 31/00 […] › conteniendo ciclos de seis eslabones con el nitrógeno como heteroatomo de un ciclo.
- A61P31/14 A61P 31/00 […] › para virus ARN.
- C07H19/044 C07H 19/00 […] › Radicales pirrol.
- C07H19/052 C07H 19/00 […] › Radicales imidazol.
- C07H19/056 C07H 19/00 […] › Radicales triazol o tetrazol.
Países PCT: Austria, Bélgica, Suiza, Alemania, Dinamarca, España, Francia, Reino Unido, Grecia, Italia, Liechtensein, Luxemburgo, Países Bajos, Suecia, Mónaco, Portugal, Irlanda, Eslovenia, Finlandia, Rumania, Chipre, Lituania, Letonia, Ex República Yugoslava de Macedonia, Albania.
Fragmento de la descripción:
Esta solicitud reivindica prioridad de la Solicitud Provisional de U.S.A. Nº 60/490,216 presentada el 25 de julio del 2003. CAMPO DE LA INVENCIÓN
Esta invención se sitúa en el área de química farmacéutica y, en particular, en el área de nucleósidos de purina, su síntesis, y su uso como agentes anti-Flaviviridae en el tratamiento de huéspedes infectados por Flaviviridae y en especial por Hepatitis C. CONTEXTO DE LA INVENCIÓN Virus Flaviviridae
La familia de virus Flaviviridae comprende al menos tres géneros distintos: pestivirus, que provocan enfermedades en ganado y cerdos; flavivirus, que son la principal causa de enfermedades como fiebre dengue y fiebre amarilla; y hepacivirus como hepatitis C (HCV). El género flavivirus incluyen más de 68 miembros separados en grupos en base a su relación serológica (Calisher et al., J. Gen. Virol., 1993, 70, 37-43). Los síntomas clínicos varían e incluyen fiebre, encefalitis y fiebre hemorrágica (Fields Virology, Editors: Fields, B. N., Knipe, D. M., and Howley, P. M., Lippincott-Raven Publishers, Philadelphia, PA, 1996, Capítulo 31, 931-959). Los flavivirus de preocupación global que se asocian con enfermedades humanas incluyen el virus Dengue, virus de fiebre hemorrágica como Lassa, Ebola, virus de fiebre amarilla, síndrome del shock y virus de encefalitis japonesa (Halstead, S. B., Rev. Infect. Dis., 1984, 6, 251-264; Halstead, S. B., Science, 239:476-481, 1988; Monath, T. P., New Eng. J. Med, 1988, 319, 641643).
El género pestivus inclujyen virus de la diarrea viral bovina (BVDV), virus de fiebre porcina clásica (CSFV, también llamado virus de fiebre porcina) y virus de la enfermedad de la frontera (BDV) de ovejas (Moennig, V. et al., Adv. Vir. Res. 1992, 41, 53-98). Las infecciones de pestvirus de animales domesticados (vacas, cerdos y ovejas) causan importantes pérdidas económicas en todo el mundo. BVDV causa enfermedad en las mucosas en el ganado y tiene gran importancia económica en la industria ganadera (Meyer, G. y Thiel, H-J., Advances in Virus Research, 1996, 47, 53-118; Moenning V., et al., Adv. Vir. Res. 1992, 41, 53-98). Los pestivirus humanos no se han caracterizado de manera tan extensa como los pestvirus animales. Sin embargo, los estudios serológicos indican una considerable exposición a pestvirus en humanos.
Los pestvirus y hepacivirus son grupos de virus muy relacionados dentro de la familia Flaviviridae. Otros virus muy relacionados en esta familia incluyen el virus A GB, agentes del tipo de virus A GB, virus B GB, virus C GB (también llamado virus de hepatitis G, HGV). El grupo hepacivirus (virus de hepatitis C; HCV) consiste en un número de virus muy relacionados pero genotípicamente distinguibles que infectan a humanos. Hay aproximadamente 6 genotipos HCV y más de 50 subtipos. Debido a las similitudes entre pestivirus y hepacivirus, en combinación con la poca habilidad del hepacivirus para crecer de manera eficiente en cultivo celular, con frecuencia se usa el virus de la diarrea viral bovina (BVDV) como un surrogado para estudiar el virus HCV.
La organización genética de pestivirus y hepacivirus es muy similar. Estos virus con ARN de cadena positiva poseen un único marco de lectura abierto y grande (ORF) que codifica todas las proteínas virales necesarias para la réplica de virus. Estas proteínas se expresan como una poliproteína que es co-y posttraslacionalmente procesadas por proteinasas celulares y codificadas por virus para producir las proteínas virales maduras. Las proteínas virales responsables de la réplica de ARN de genoma rial se localizan aproximadamente en el interior de la terminal de carboxi. Dos tercios del ORF se denominan proteínas no estructurales (NS). La organización genética y el proceso de la poliproteínas de la porción de de proteína no estructural de ORF para pestivirus y hepacivirus es muy similar. Para ambos, pestivirus y hepacivirus, las proteínas maduras no estructurales (NS), en orden secuencial desde la terminal amino de la proteína no estructural codificadora de región hasta la terminal carboxi del ORF, consiste en p7, NS1, NS2A, NS2B, NS3, NS4A, NS4B, NS5A, y NS5B.
Las proteínas NS de pestivirus y hepacivirus comparten los dominios secuenciales que son característicos de las funciones específicas de las proteínas. Por ejemplo, la glicoproteína NS1 es una proteína con superficie celular que se desplaza al lumen ER. NS1 se caracteriza inicialmente por ser un antígeno soluble de fijado complementado que se encuentra en el suero y tejidos de animales infectados, y ahora se le conoce por provocar respuestas inmune humorales en su forma extracelular. Los anticuerpos para NS1 pueden usarse para dar inmunidad pasiva a ciertos pestivirus y flavivirus. NS1 has estado implicado en el proceso de réplica de ARN donde se cree que tiene un papel funcional en el proceso citoplásmico de ARN. NS2A es una proteína pequeña (aproximadamente 22 kd) de función desconocida. Los estudios sugieren que se enlaza con NS3 y NS5, por lo que podría ser un reclutador de plantillas de ARN para las réplicas que se unen a la membrana. NS2B también es una proteína pequeña (aproximadamente 14 kd) que se asocia a la membrana, y es un cofactor necesario para la función de proteasa de serina de NS3, con el que forma un complejo.
Las proteínas NS3 de virus en ambos grupos son grandes (aproximadamente 70 kd), son proteínas asociadas a la membrana que poseen motivos de secuencia de aminoácido característicos de proteinasas y de helicasas (Gorbalenya et al. (1988) Nature 333: 22; Bazan and Fletterick (1989) Virology 171:637-639; Gorbalenya et al. (1989) Nucleic Acid Res. 17.3889-3897). Por lo tanto, las proteínas NS3 tienen actividad enzimática necesaria para procesar poliproteínas para la réplica de ARN. El extremo de la terminal C de las proteínas NS3 tienen una actividad de trifosfotasa ARN que parece modificar el extremo 5' del genoma antes de la adición del tope 5' por parte de guanililtransferasa.
NS4A y NS4B se asocian con la membrana, son pequeñas (aproximadamente 16kd y aproximadamente 27kd, respectivamente), y son proteínas hidrofóbicas que parecen funcionar en la réplica de ARN anclando componentes de réplica en membranas celulares (Fields, Virology, 4ª Edición, 2001, p. 1001).
Las proteínas NS5 son las más grandes (aproximadamente 103 kd) y las mejor conservadas, con homología secuencial con otros virus ARN de cadena (+). También juega un papel fundamental en la réplica viral. Las proteínas NS5B de pestivirus y hepacivirus son las enzimas necesarias para la síntesis de ARN intermedio con cadena negativa que es complementario al genoma viral, y del ARN con cadena positiva que es complementario al ARN intermedio con cadena negativa. El producto gen NS5B tiene Gly-Asp-Asp (GDD) como secuencia distintiva, que comparte con transcriptasas inversas y otras polimerasas virales y que es predictiva de actividad de polimerasa ARN dependiente de ARN (RdRP) (DeFrancesco et al., Antiviral Research, 2003, 58:1-16). Resulta interesante destacar el hecho de que se haya descubierto que la cola hidrofóbica larga del residuo 21 de la terminal C en NS5B es necesaria para alcanzar NS5B para la membrana ER, pero su retirada no tiene ningún otro efecto y, de hecho, lleva a una mayor solubilidad y actividad enzimática (Tomei et al., J. Gen. Virol., 2000, 81:759-767; Lohmann et al., J. Virol., 1997, 71: 8416-28; Ferrari et al., J. Virol., 1999, 73:1649-54).
Los productos de enzima NS5B tiene los rasgos característicos de las polimerasas de ARN dirigidas a ARN, y además, comparten homología con enzimas de metiltransferasa que participan en la formación del tapón de ARN (Koonin, E.V. and Dolja, V.V. (1993) Crit. Rev. Biochem. Molec. Biol. 28:375-430; Behrens et al.(1996) EMBO J. 15:12-22; Lchmannet al.(1997) J. Virol. 71:8416-8428; Yuan et al.(1997) Biochem. Biophys. Res. Comm. 232:231-235; Hagedorn, PCT WO 97/12033; Zhong et al.(1998) J. Virol. 72.9365-9369). La estructura de cristal que no pertenece al ligandos de NS5B muestra la única característica estructural de plegarse en una clásica forma de “mano derecha”, en cuyos dedos, palmas y subdominios del pulgar pueden reconocerse (una característica que comparte con otras polimerasas), pero difiere de otras polimerasas “mano derecha medio abierta” al tener una forma más compacta debido a dos curvas extendidas que abarcan los dominios del dedo y pulgar en la parte superior de la cavidad activa (DeFrancesco et al., en 9). Los subdominios del dedo, pulgar y palma rodean la cavidad activa a la que la plantilla de ARN y los sustratos de NTP tienen acceso por medio de dos túneles con carga positiva (Bressanelli...
Reivindicaciones:
1ª. – Un compuesto de la estructura general de la Fórmula (I):
**(Ver fórmula)**
o una sal farmacológicamente aceptable del mismo, donde: R es H; mono-, di- o trifosfato; o fosfonato; X es O; R1 y R1' son independientemente H, alquilo, ácido, ciano, alquenilo, alquinilo, -C(O)-(alquilo), -C(O)(O)(alquenilo), -C(O) (O)(alquinilo), C(O) NH2,-C(O)NH(alquilo), -C(O)N(alquilo)2, -C(H)=N-NH2, C(S)NH(alquilo), o C(S)N(alquilo)2; donde alquilo, alquenilo, y/o alquinilo puede sustituirse de manera opcional; R2 y R3 es independientemente H, OH, NH2, SH, F, Cl, Br, I, CN, NO2, -C(O)NH2, -C(O)NH(alquilo), y -C(O)N(alquilo)2, N3, alquilo opcionalmente sustituido, alquenilo or alquinilo opcionalmente sustituido, -C(O)O-(alquilo), C(O)O-(alquenilo), -C(O)O-(alquinilo), O(acilo), -O(alquilo), -O(alquenilo), -O(alquinilo), -OC(O)NH2, NC, C(O)OH, SCN, OCN, -S(alquilo), -S(alquenilo), -S(alquinilo), NH(alquilo), -N(alquilo)2, -NH(alquenilo), -NH(alquinilo), un residuo de aminoácido o un derivado, o un anillo heterocíclico de 3-7 miembros opcionalmente sustituido que tiene O, S y/o N independientemente como un heteroátomo tomado solo o en combinación; R2' es alquilo, alquenilo, o alquinilo opcionalmente sustituido; halógeno, ácido o ciano; R3' es H; alquilo, alquenilo, o alquinilo opcionalmente sustituido; C(O)O-(alquilo), -C(O)O-(alquenilo), -C(O)O-(alquinilo), -C(O)NH2, C(O)NH(alquilo), halógeno, ácido, ciano, NO2, -S(alquilo),
S(alquenilo), -S(alquinilo), NH2, -NH(alquilo), -N(alquilo)2, NH(alquenilo),-NH(alquinilo), -NH(acilo) o N(acilo)2; y Base se selecciona del grupo consistente en:
**(Ver fórmula)**
donde cada R' and R" independientemente es H, C1-6 alquilo, C2-6 alquenilo, C2-6 alquinilo, halógeno, alquilo halogenado, OH, CN, N3, carboxi, C1-4 alcoxicarbonilo,NH2, C1-4 alquiloamino, di(C1-4 alquilo)amino,C16 alcoxi,C1-6 alquilosulfonilo, o (C1-4 alquilo)0-2 aminometilo; cada W es independientemente H, Cl, Br, I, F, alquilo halogenado, alcoxi, OH, SH, O-alquilo, S-alquilo, O-alquenilo, O-alquinilo, Salquenilo, S-alquinilo, -OC(O)NR4R4, O-acilo, S-acilo, CN, SCN,
OCN, NO2, N3, NH2, NH(alquilo), N(alquilo)2, NH-cicloalquilo, NHacilo, NH=NH, CONH2, CONH(alquilo), o CON(alquilo)2; y cada R4 es independientemente H, acilo, o C1-6 alquilo; y cada Z es independientemente O, S, NH, N-OH, N-NH2, N(alquilo), N(alquilo)2, N-cicloalquilo, alcoxi, CN, SCN, OCN, SH, NO2, N3, NH=NH, CONH2, CONH(alquilo), o CON(alquilo)2.
2ª. Un compuesto de la estructura general de la Fórmula (I):
**(Ver fórmula)**
o una sal farmacológicamente aceptable del mismo, donde: R es H; mono-, di- o trifosfato; o fosfonato; X es O; R1 y R1' son independientemente H, alquilo, ácido, ciano, alquenilo, alquinilo, -C(O)-(alquilo), -C(O)(O)(alquenilo), -C(O) (O)(alquinilo), C(O) NH2,-C(O)NH(alquilo), -C(O)N(alquilo)2, -C(H)=N-NH2, C(S)NH(alquilo), o C(S)N(alquilo)2; donde alquilo, alquenilo, y/o alquinilo puede sustituirse de manera opcional; R2 y R3 es independientemente H, OH, NH2, SH, F, Cl, Br, I, CN, NO2, -C(O)NH2, -C(O)NH(alquilo), y -C(O)N(alquilo)2, N3, alquilo opcionalmente sustituido, alquenilo or alquinilo opcionalmente sustituido, -C(O)O-(alquilo), C(O)O-(alquenilo), -C(O)O-(alquinilo), O(acilo), -O(alquilo), -O(alquenilo), -O(alquinilo), -OC(O)NH2, NC, C(O)OH, SCN, OCN, -S(alquilo), -S(alquenilo), -S(alquinilo), NH(alquilo), -N(alquilo)2, -NH(alquenilo), -NH(alquinilo), un residuo de aminoácido o un derivado, o un anillo heterocíclico de 3-7 miembros opcionalmente sustituido que tiene O, S y/o N independientemente como un heteroátomo tomado solo o en combinación; R2' es H; alquilo, alquenilo, o alquinilo opcionalmente sustituido; C(O)O-(alquilo), -C(O)O-(alquenilo), -C(O)O-(alquinilo), -C(O)NH2, C(O)NH(alquilo), halógeno, ácido, ciano, NO2, -S(alquilo), S(alquenilo), -S(alquinilo), NH2, -NH(alquilo), -N(alquilo)2, NH(alquenilo),-NH(alquinilo), -NH(acilo) o N(acilo)2;
R3'
es alquilo, alquenilo, o alquinilo opcionalmente sustituido; halógeno, ácido o ciano; y Base se selecciona del grupo consistente en:
**(Ver fórmula)**
donde cada R' and R" independientemente es H, C1-6 alquilo, C2-6 alquenilo, C2-6 alquinilo, halógeno, alquilo halogenado, OH, CN, N3, carboxi,C1-4 alcoxicarbonilo,NH2, C1-4 alquiloamino, di(C1-4 alquilo)amino,C1-6 alcoxi,C1-6 alquilosulfonilo, o (C1-4 alquilo)0-2 aminometilo; cada W es independientemente H, Cl, Br, I, F, alquilo halogenado, alcoxi, OH, SH, O-alquilo, S-alquilo, O-alquenilo, O-alquinilo, Salquenilo, S-alquinilo, -OC(O)NR4R4, O-acilo, S-acilo, CN, SCN, OCN, NO2, N3, NH2, NH(alquilo), N(alquilo)2, NH-cicloalquilo, NHacilo, NH=NH, CONH2, CONH(alquilo), o CON(alquilo)2; y cada R4 es independientemente H, acilo, o C1-6 alquilo; y cada Z es independientemente O, S, NH, N-OH, N-NH2, N(alquilo), N(alquilo)2, N-cicloalquilo, alcoxi, CN, SCN, OCN, SH, NO2, N3, NH=NH, CONH2, CONH(alquilo), o CON(alquilo)2.
10 3ª. – Un compuesto de la estructura general de Fórmula (III)
**(Ver fórmula)**
20 o una sal farmacológicamente aceptable del mismo, donde: cada R, R2*, y R3* son independientemente H; mono-, di-, o trifosfato; o fosfonato; alquilo opcionalmente sustituido, alquenilo o alquinilo opcionalmente sutituido, acilo, -C(O)-(alquilo), -C(O)(alquenilo), -C(O)-(alquinilo), lípido, fosfolípido, carbohidrato, péptido, colesterol, un residuo o derivado de aminoácido; X es O;
R2'
es alquilo, alquenilo, o alquinilo opcionalmente sustituido; halógeno, ácido o ciano; y Base se selecciona del grupo consistente en:
**(Ver fórmula)**
**(Ver fórmula)**
donde cada R' and R" independientemente es H, C1-6 alquilo, C2-6 alquenilo, C2-6 alquinilo, halógeno, alquilo halogenado, OH, CN, N3, carboxi,C1-4 alcoxicarbonilo,NH2, C1-4 alquiloamino, di(C1-4 alquilo)amino,C1-6 alcoxi,C1-6 alquilosulfonilo, o (C1-4 alquilo)0-2 aminometilo; cada W es independientemente H, Cl, Br, I, F, alquilo halogenado, alcoxi, OH, SH, O-alquilo, S-alquilo, O-alquenilo, O-alquinilo, Salquenilo, S-alquinilo, -OC(O)NR4R4, O-acilo, S-acilo, CN, SCN, OCN, NO2, N3, NH2, NH(alquilo), N(alquilo)2, NH-cicloalquilo, NHacilo, NH=NH, CONH2, CONH(alquilo), o CON(alquilo)2; y cada R4 es independientemente H, acilo, o C1-6 alquilo; y cada Z es independientemente O, S, NH, N-OH, N-NH2, N(alquilo), N(alquilo)2, N-cicloalquilo, alcoxi, CN, SCN, OCN, SH, NO2, N3, NH=NH, CONH2, CONH(alquilo), o CON(alquilo)2.
4ª. – El compuesto de la reivindicación 1 ó 3, donde R2' es alquilo, alquenilo o alquinilo opcionalmente sustituido; o halógeno. 5ª. – El compuesto de la reivindicación 4, donde R2' es CH3 o CF3. 6ª. – Un compuesto de la estructura general de la Fórmula
(IV):
**(Ver fórmula)**
o una sal farmacológicamente aceptable del mismo, donde: cada R, R2*, y R3* son independientemente H; mono-, di-, o trifosfato; o fosfonato; alquilo opcionalmente sustituido, alquenilo o alquinilo opcionalmente sutituido, acilo, -C(O)-(alquilo), -C(O)(alquenilo), -C(O)-(alquinilo), lípido, fosfolípido, carbohidrato, péptido, colesterol, un residuo o derivado de aminoácido; X es O;
R2'
es alquilo, alquenilo, o alquinilo opcionalmente sustituido; halógeno, ácido o ciano; y 20 Base se selecciona del grupo consistente en:
**(Ver fórmula)**
**(Ver fórmula)**
donde cada R' and R" independientemente es H, C1-6 alquilo, C2-6 alquenilo, C2-6 alquinilo, halógeno, alquilo halogenado, OH, CN, N3, carboxi,C1-4 alcoxicarbonilo,NH2, C1-4 alquiloamino, di(C1-4 alquilo)amino,C1-6 alcoxi,C1-6 alquilosulfonilo, o (C1-4 alquilo)0-2 aminometilo; cada W es independientemente H, Cl, Br, I, F, alquilo halogenado, alcoxi, OH, SH, O-alquilo, S-alquilo, O-alquenilo, O-alquinilo, Salquenilo, S-alquinilo, -OC(O)NR4R4, O-acilo, S-acilo, CN, SCN, OCN, NO2, N3, NH2, NH(alquilo), N(alquilo)2, NH-cicloalquilo, NHacilo, NH=NH, CONH2, CONH(alquilo), o CON(alquilo)2; y cada R4 es independientemente H, acilo, o C1-6 alquilo; y cada Z es independientemente O, S, NH, N-OH, N-NH2, N(alquilo), N(alquilo)2, N-cicloalquilo, alcoxi, CN, SCN, OCN, SH, NO2, N3, NH=NH, CONH2, CONH(alquilo), o CON(alquilo)2.
7ª. – El compuesto de la reivindicación 2 ó 6, donde R3' es alquilo, alquenilo o alquinilo opcionalmente sustituido; o halógeno. 8ª. – El compuesto de la reivindicación 7, donde R3' es CH3 o CF3.
9ª. – El compuesto de cualquiera de las reivindicaciones 3 a 8, donde R, R2*, y R3* son independientemente H, mono-, di-, o trifosfato o fosfonato.
10ª. – El compuesto de cualquiera de las reivindicaciones 3 a 9, donde R, R2*, y R3* son independientemente H.
11ª. – El compuesto de cualquiera de las reivindicaciones 3 a 8, donde R, R2*, y R3* son independientemente H, acilo, o un residuo acilo de aminoácido.
12ª. – El compuesto de cualquiera de las reivindicaciones 1 a 11, donde la Base se selecciona del grupo consistente en:
**(Ver fórmula)**
13ª. -Una composición farmacéutica que contiene una cantidad antiviralmente efectiva de un compuesto de cualquiera de las reivindicaciones 1 a 12, opcionalmente con un portador, diluyente
o excipiente farmacéuticamente aceptable. 14ª. – La composición farmacéutica de la reivindicación 13, donde la composición tiene forma de una unidad de dosis.
15ª. – La composición farmacéutica de la reivindicación 14, donde la unidad de dosis contiene desde aproximadamente 0.01 a aproximadamente 50 mg del compuesto.
16ª. – La composición farmacéutica de la reivindicación 14 ó 15, donde la unidad de dosis es un comprimido o cápsula.
17ª. – La composición farmacéutica de cualquiera de las reivindicaciones 13 a 16, que además contiene uno o más agentes adicionales antiviralmente efectivos.
18ª. – La composición farmacéutica de la reivindicación 17, donde el agente antiviral se selecciona del grupo consistente en un interferón, ribavirina, una interleuquina, un inhibidor de proteasa NS3, un inhibidor de proteasa cisteína, un derivado de tiazolidina, una tiazolidina, una benzanilida, fenantrenoquinona, un inhibidor de helicasa, un inhibidor de polimerasa, un análogo nucleótido, gliotoxina, cerulenina, un oligodeoxinucleótido antisentido, un inhibidor de translación dependiente de IRES, y una ribozima.
19ª. – La composición farmacéutica de la reivindicación 17 ó 18, donde el agente adicinal antiviralmente efectivo es un interferón.
20ª. – La composición farmacéutica de cualquiera de las reivindicaciones 17 a 19, donde el agente adicional antiviralmente efectivo se selecciona del grupo consistente en inferferón alfa 2a pegilado, inteferón alfacón-1, interferón natural, albuferón, interferón beta-1a, interferón omega, interferón gamma, interferón tau, interferón delta e interferón gamma-1b.
21ª. – La composición farmacéutica de cualquiera de las reivindicaciones 13 a 20, donde el compuesto está en forma sustancialmente pura.
22ª. – La composición farmacéutica de la reivindicación 21, donde el compuesto tiene al menos 90% por peso del isómero β-D.
23ª. – La composición farmacéutica de la reivindicación 21, donde el compuesto tiene al menos 95% por peso del isómero β-D.
24ª. – La composición farmacéutica de la reivindicación 21, donde el compuesto tiene al menos 90% por peso del isómero β-L.
25ª. – La composición farmacéutica de la reivindicación 21, donde el compuesto tiene al menos 95% por peso del isómero β-L.
26ª. – Uso de un compuesto de cualquiera de las reivindicaciones 1 a 12 en la fabricación de un medicamento para el tratamiento de un huésped infectado por Flaviviridae.
27ª. – El uso de la reivindicación 26, donde el huésped es un mamífero.
28ª. – El uso de la reivindicación 27, donde el mamífero es un humano.
29ª. – Un compuesto de cualquiera de las reivindicaciones 1 a 12 para uso en el tratamiento de un huésped infectado por Flaviviridae, donde el el huésped es opcionalmente como el establecido en la reivindicación 27 o reivindicación 28.
Patentes similares o relacionadas:
Uso de inhibidores de la PDE4 para la profilaxis y/o la terapia de la dislipoproteinemia y trastornos relacionados, del 27 de Mayo de 2020, de Albert-Ludwigs-Universität Freiburg: Inhibidor específico de la fosfodiesterasa 4 (PDE 4) para uso en el tratamiento profiláctico o terapéutico de la dislipoproteinemia, en donde el inhibidor […]
Métodos y composiciones para trastornos relacionados con la proliferación celular, del 27 de Mayo de 2020, de Agios Pharmaceuticals, Inc: Un método in vitro para diagnosticar a un sujeto que tiene un trastorno relacionado con la proliferación celular o que se sospecha que tiene un trastorno relacionado con […]
Un canal catiónico no selectivo en células neurales y compuestos que bloquean el canal para su uso en el tratamiento de la inflamación del cerebro, del 6 de Mayo de 2020, de UNIVERSITY OF MARYLAND, BALTIMORE: Un antagonista de SUR1 que bloquea el canal de NCCa-ATP para su uso en (a) la prevención o el tratamiento de la inflamación de las células neurales […]
Inhibidores de ERK y sus usos, del 8 de Abril de 2020, de Celgene CAR LLC: Un compuesto de fórmula VIII: **(Ver fórmula)** o una de sus sales farmacéuticamente aceptables, en donde: el anillo A se selecciona de **(Ver fórmula)** […]
Procedimiento de uso de inmunoconjugados anti-CD79b, del 8 de Abril de 2020, de F. HOFFMANN-LA ROCHE AG: Un inmunoconjugado que comprende un anticuerpo anti-CD79b unido a un agente citotóxico para su uso en un procedimiento para tratar un trastorno proliferativo […]
IMIPRAMINA PARA USO COMO INHIBIDOR DE LA SOBREXPRESIÓN DE LA FASCINA 1, del 2 de Abril de 2020, de FUNDACION UNIVERSITARIA SAN ANTONIO: La presente invención se refiere a imipramina para su uso como inhibidor de la sobreexpresión de la fascina 1, preferiblemente dicha sobreexpresión de la fascina 1 está asociada […]
Mutación novedosa del receptor de andrógenos, del 25 de Marzo de 2020, de NOVARTIS AG: Una composicion terapeutica para su uso en el tratamiento de un paciente que padece cancer de prostata o de mama, asociado con una mutacion del receptor de […]
Composiciones y métodos para la distribución de moléculas en células vivas, del 25 de Marzo de 2020, de THE TEXAS A & M UNIVERSITY SYSTEM: Un compuesto que tiene la fórmula: **(Ver fórmula)** En donde X es un resto de unión, Y es un residuo de aminoácido acoplado de forma covalente […]