USO DE QUIMIOQUINA CXCL6 EN LA PREVENCION O REPARACION DE DEFECTOS DEL CARTILAGO.
Uso de CXCL6 para la preparación de un medicamento para la promoción de la formación de cartílago y/o hueso
Tipo: Patente Internacional (Tratado de Cooperación de Patentes). Resumen de patente/invención. Número de Solicitud: PCT/BE2004/000117.
Solicitante: TIGENIX N.V.
Nacionalidad solicitante: Bélgica.
Dirección: TECHNOLOGIELAAN 3,3001 LEUVEN.
Inventor/es: LUYTEN, FRANK, DE BARI, COSIMO, DELL\'ACCIO, FRANCESCO.
Fecha de Publicación: .
Fecha Concesión Europea: 25 de Noviembre de 2009.
Clasificación Internacional de Patentes:
- A61K38/19 NECESIDADES CORRIENTES DE LA VIDA. › A61 CIENCIAS MEDICAS O VETERINARIAS; HIGIENE. › A61K PREPARACIONES DE USO MEDICO, DENTAL O PARA EL ASEO (dispositivos o métodos especialmente concebidos para conferir a los productos farmacéuticos una forma física o de administración particular A61J 3/00; aspectos químicos o utilización de substancias químicas para, la desodorización del aire, la desinfección o la esterilización, vendas, apósitos, almohadillas absorbentes o de los artículos para su realización A61L; composiciones a base de jabón C11D). › A61K 38/00 Preparaciones medicinales que contienen péptidos (péptidos que contienen ciclos beta-lactama A61K 31/00; dipéptidos cíclicos que no tienen en su molécula ningún otro enlace peptídico más que los que forman su ciclo, p. ej. piperazina 2,5-dionas, A61K 31/00; péptidos basados en la ergolina A61K 31/48; que contienen compuestos macromoleculares que tienen unidades aminoácido repartidas estadísticamente A61K 31/74; preparaciones medicinales que contienen antígenos o anticuerpos A61K 39/00; preparaciones medicinales caracterizadas por los ingredientes no activos, p. ej. péptidos como soportes de fármacos, A61K 47/00). › Citoquinas; Linfoquinas; Interferones.
Clasificación PCT:
Clasificación antigua:

Fragmento de la descripción:
Uso de quimioquina CXCL6 en la prevención o reparación de defectos del cartílago.
Campo de la invención
La presente invención se refiere a la formación de cartílago y hueso in vitro e in vivo y especialmente a la reparación de defectos del cartílago u osteocondrales o a la formación de hueso o cartílago en cirugía cosmética. Más particularmente, la invención se refiere a la reparación y la prevención de defectos articulares, tales como los que se producen en osteoartritis. La invención también se refiere a la modulación o a la diferenciación de células progenitoras en células condrogénicas.
Antecedentes de la invención
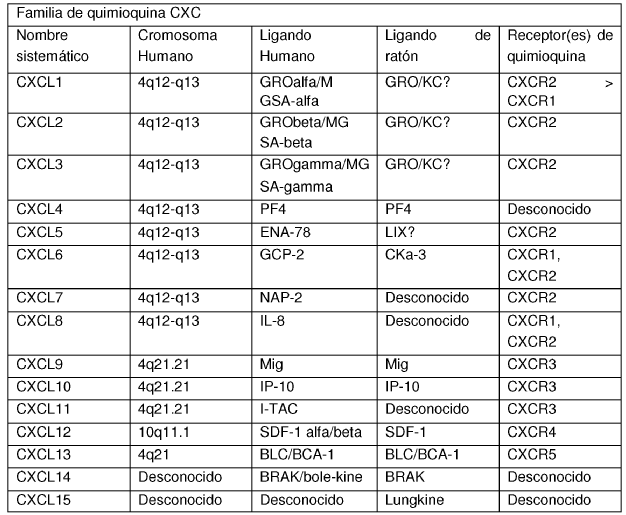
Las quimioquinas son un grupo de moléculas pequeñas (de aproximadamente 8 a 14 kD), en su mayoría básicas, estructuralmente relacionadas que regulan el tráfico celular de diversos tipos de leucocitos mediante interacciones con un subconjunto de receptores con dominios 7-transmembrana acoplados a proteínas G. Las quimioquinas desempeñan papeles fundamentales en el desarrollo, homeostasis y función del sistema inmune, y tienen efectos sobre células del sistema nervioso central así como sobre células endoteliales que están implicadas en angiogénesis o angiostasis. Las quimioquinas se dividen en 2 principales subfamilias, CXC y CC, en base a la disposición de los 2 primeros de los 4 restos de cisteína conservados que aparecen en las secuencias de proteínas de quimioquina; las 2 cisteínas están separadas por un único aminoácido en quimioquinas CXC y son adyacentes en quimioquinas CC. Las quimioquinas CXC se subdividen además en los tipos ELR y no ELR en base a la presencia o ausencia de una secuencia glu-leu-arg (motivo ELR) adyacente y N-terminal respecto al motivo CXC. Un nuevo sistema de clasificación que agrupa a las diferentes quimioquinas fue presentado por Zlotnik y Yoshie (2000, Immunity 12, 121-127) y se presenta en la Tabla 1.
La quimioquina humana GCP 2 se descubrió originalmente como una proteína que se expresaba en cantidades mínimas junto con interleuquina 8(IL-8) por células de osteosarcoma humano estimuladas (Proost et al. (1993) Biochemistry 32, 10170-10177). El gen humano para GCP-2 codifica una proteína de 114 aminoácidos.
GCP-2, denominada anteriormente "SCYB6" y, de acuerdo con la terminología más reciente, "CXCL6", muestra la mayor similitud de secuencia en la secuencia codificante y no codificante respecto a CXCL5 (SCYB5/ENA-78 (Atrayente de Neutrófilos 78 derivado de Células Epiteliales [Epithelial cell-derived Neutrophil Attractant 78])).
En seres humanos y en vacas, la proteína CXCL6 se produce en varias formas truncadas en el extremo N que parecen no tener actividad diferente en un ensayo de migración in vitro convencional (Proost et al. (1993) mencionado anteriormente). Se aislaron hasta 28 versiones con escisión N-terminal y/o C-terminal de CXCL6 murina de fibroblastos y células epiteliales (Wuyts et al. (1999) J. Immunol. 163, 6155-6163; Van Damme et al. (1997) J Leukoc Biol 6, 563-569). Estas versiones con truncamiento N-terminal de CXCL6 murina muestran diferencias espectaculares en la potencia quimiotáctica específica hacia neutrófilos humanos y murinos in vitro e in vivo. CXCL6 se ha presentado como un atrayente de granulocitos específico que no tiene ningún efecto quimiotáctico sobre los monocitos (Van Damme et al. (1997) mencionado anteriormente).
Como su nombre indica, CXCL6 es una quimioquina CXC. Ésta pertenece al subgrupo de quimioquinas que activan neutrófilos que actúan a través de CXCR1, que se caracterizan por la secuencia Glu-Leu-Arg situada en el extremo N-terminal (motivo ELR). Junto con IL-8, CXCL6 es la única quimioquina que contiene ELR que tiene un aminoácido básico en la sexta posición después de la segunda cisteína del motivo CXC. Wolf et al. ((1998) Eur. J. immunol. 28, 164-170) han demostrado que este aminoácido básico es un importante determinante para la activación de CXCR1. Wuyts et al. ((1997) mencionado anteriormente) demostraron además que CXCL6 se une a receptores de CXCR1 y de CXCR2. El uso de receptores de CXCR1 y de CXCR2 está documentado en US2002/123483.
Las quimioquinas en general se han relacionado con la degradación de cartílago en el contexto de la reacción inflamatoria observada en artritis reumatoide. Borzi et al. ((1999) Febs Lett. 455, 235-242) y Pulsatelli et al. ((1999) J. Rheumatol. 26, 1992-2001) describen la expresión de IL-8, Gro-alfa, MCP-1, RANTES, MIP-1 alfa y MlP1beta en condrocitos obtenidos de individuos normales, pacientes de osteoartritis (OA) y artritis reumatoide (RA). Borzi et al. ((2002) Arthritis Rheum. 46, 3201-3211) sugieren la existencia de una nueva ruta catabólica iniciada por las quimioquinas y sus receptores que conduce a la disolución de los componentes de la matriz de cartílago. La regulación positiva de quimioquinas, de acuerdo con estos autores, se relaciona con la patogénesis y la persistencia de la enfermedad articular. Votta et al. ((2000) J Cell Physiol. 183, 196-207) sugieren que la quimioquina CC Ckbeta 8 desempeña un papel en el reclutamiento de precursores de osteoclastos a puntos de resorción ósea. Por otro lado, los osteoblastos no responden a esta quimioquina. Alaaeddine et al. ((2001) Arthritis Rheum. 44, 1633-1643) estudiaron la expresión de la quimioquina RANTES (un miembro de la familia CC) y sus receptores en cartílago normal y en OA, y asignaron una actividad patogénica a esta quimioquina. Kanbe et al. ((2002) Arthritis Rheum. 46, 130-137) sugirieron un papel para la quimioquina CXC SDF-1 en la degradación de la matriz de cartílago mediada por células sinoviales en RA y OA. Wuyts et al. ((2003) Lab Invest. 83, 23-34) demostraron que citoquinas inflamatorias tales como IL-1 inducen la expresión de CXCL6 en condrocitos, aunque este nivel de expresión es aproximadamente 100 veces menor que el de IL-8.
Silvestri et al. ((2003) Rheumatology 42, 14-18) describen la expresión de receptores de quimioquina, pero no de las propias quimioquinas, en artritis inflamatoria y osteoartritis. Se ha postulado que la actividad de quimioquinas inclina el equilibrio de la homeostasis del cartílago hacia la degradación. El documento EP 08044865 sugiere el uso de CXCL6 como medicamento para afecciones inflamatorias, mientras que la Patente de Estados Unidos Nº 6.410.268 indica el posible uso de antagonistas de GCP2 en el tratamiento de enfermedades inflamatorias tales como RA. Este último sugiere además el uso de GCP-2 para estimular la cicatrización de heridas en el tratamiento de enfermedades fibróticas tales como OA. Otras aplicaciones médicas de CXCL6 y células que expresan CXCL6 se han descrito en el documento EP1312614.
Un papel de las quimioquinas en la migración de tipos celulares que no están relacionados con leucocitos ha aparecido recientemente. Como se ha mencionado anteriormente, se ha descrito un efecto quimiotáctico de Ckbeta 8 sobre precursores de osteoclastos (Votta et al. (2000) J Cell Physio. 183, 196-207). Doitsidou et al. ((2003) Cell 11, 647-59) y Wright et al. ((2002) J Exp Med. 195, 1145-1154) demuestran el papel de SDF-1 y su receptor CXCR4 en la migración de células germinales primordiales y células madre hematopoyéticas respectivamente. King et al. ((2000) Blood 97, 1534-1542 y (2001) J. Immunol. 164, 3774-3782) describen un espectacular aumento de la actividad hematopoyética después del truncamiento amino-terminal de CXCL2 (GroBeta) y demuestran que esta versión truncada puede movilizar células madre hematopoyéticas. La Patente de Estados Unidos Nº 6.410.268 especula sobre un posible papel en la movilización de células madre usando CXCL6, en particular de células madre de médula ósea, que podría aplicarse en el tratamiento de cáncer y leucemia.
Las presentes terapias en la reparación de cartílago incluyen la administración de células condrogénicas (US5786217). Los condrocitos, que se usan para la promoción de cartílago pueden modificarse adicionalmente mediante la expresión de factores de crecimiento (US6413511).
Sumario de la invención
La presente invención se refiere a la implicación de quimioquina CXCL6 en la formación de hueso o cartílago in...
Reivindicaciones:
1. Uso de CXCL6 para la preparación de un medicamento para la promoción de la formación de cartílago y/o hueso.
2. El uso de acuerdo con la reivindicación 1, en el que dicho medicamento es para la prevención o el tratamiento de un defecto del cartílago u osteocondral.
3. El uso de acuerdo con la reivindicación 1 ó 2, en el que la fuente de CXCL6 es una población de células que expresan CXCL6.
4. El uso de acuerdo con cualquiera de las reivindicaciones 1 a 3, en el que dicha CXCL6 se administra al defecto osteocondral en un gradiente.
5. El uso de acuerdo con una cualquiera de las reivindicaciones 1 a 4, en el que dicho medicamento comprende además células condrogénicas o células precursoras de las mismas.
6. Uso de células que expresan CXCL6 para la preparación de un medicamento para la promoción de la formación de cartílago o hueso, en el que dichas células comprenden un ADN extraño que codifica dicha CXCL6, bajo el control de un promotor.
7. El uso de acuerdo con la reivindicación 6, en el que dicho medicamento es para la prevención o el tratamiento de un defecto del cartílago u osteocondral.
8. El uso de acuerdo con las reivindicaciones 6 ó 7, en el que dichas células que expresan CXCL6 son células condrogénicas.
9. El uso de acuerdo con una cualquiera de las reivindicaciones 6 a 8, en el que dichas células que expresan CXCL6 están embebidas en una matriz.
10. Uso de acuerdo con las reivindicaciones 2 ó 7, en el que el defecto del cartílago es un defecto de la superficie articular no relacionado con la inflamación.
11. El uso de CXCL6 expresada como marcador para estabilidad fenotípica de condrocitos in vitro.
12. El uso de CXCL6 para la promoción de la formación de cartílago y/o hueso in vitro.
13. Un método in vitro para inducir o restaurar la estabilidad fenotípica de condrocitos en una población de células progenitoras, comprendiendo dicho método la etapa de administrar CXCL6 a dicha población de células progenitoras.
14. Un método in vitro para inducir o restaurar la diferenciación de una población de células precursoras en condrocitos, comprendiendo dicho método la etapa de administrar CXCL6 a dicha población de células precursoras.
Patentes similares o relacionadas:
Composiciones farmacéuticas que contienen una leucocidina E mutada, del 22 de Julio de 2020, de NEW YORK UNIVERSITY: Una composición que comprende: una proteína Leucocidina E (LukE) aislada que comprende la secuencia de aminoácidos de la SEQ ID NO: 4, o un polipéptido […]
Terapia génica y electroporación para el tratamiento de neoplasias malignas, del 27 de Mayo de 2020, de OncoSec Medical Incorporated: Un plasmido que codifica para una forma soluble de un agonista de GITR, CD137, CD134, CD40L o CD27 para usar en un metodo de tratamiento de un sujeto con un […]
Tratamiento extracorporal del pulmón con un péptido cíclico de formula x1-gqretpegaeakpwy-x2, del 27 de Mayo de 2020, de APEPTICO FORSCHUNG UND ENTWICKLUNG GMBH: Un método para mejorar las funciones de un pulmón donante extracorpóreamente, que comprende tratar un pulmón ex vivo con un compuesto ciclado de la […]
Implantación de embriones, del 22 de Abril de 2020, de Ostara Biomedical Ltd: Un método no terapéutico para mejorar las tasas de preñez en hembras no humanas antes de la implantación de un embrión o antes de la inseminación, que […]
Métodos y composiciones para suministrar agentes activos con propiedades farmacológicas potenciadas, del 11 de Marzo de 2020, de DUKE UNIVERSITY: Una formulación farmacéutica que comprende una cantidad efectiva de un agente terapéutico conjugado con un péptido similar a la elastina (ELP), […]
Método para modular el apetito, del 11 de Marzo de 2020, de ST VINCENT'S HOSPITAL SYDNEY LIMITED: Agente de inhibición de MIC-1 que disminuye el nivel en suero o actividad de MIC-1 endógena, para uso en un método para incrementar el peso corporal […]
Uso de composiciones inmunomoduladoras eficaces para el tratamiento inmunoterápico de pacientes que padecen leucemias mielógenas, del 11 de Marzo de 2020, de Modiblast Pharma GmbH: Combinación de agentes activos para administración en tratamiento parenteral, individual y/o prevención de leucemia mielógena en pacientes en […]
Proteína de unión a vitamina D desglicosilada de manera selectiva (Gcmaf) y colecalciferol (calciol) así como procedimiento de preparación, del 26 de Febrero de 2020, de HG Pharma GmbH: Complejo dimerico de proteina de union a vitamina D desglicosilada de manera selectiva (GcMAF) y colecalciferol (calciol).