UN METOOD PARA LA FABRICACION DE GRANULOS QUE CONTIENEN ENTACAPONA PARA FORMAS DE DOSIFICACION ORAL.
Una forma, de dosificación oral que comprende una cantidad farmacológicamente eficaz de entacapona como la única sustancia medicamentosa,
en donde la cantidad de entacapona en una porción de la forma de dosificación oral es de 35% a 99% en peso de la porción
Tipo: Resumen de patente/invención. Número de Solicitud: W06000182FI.
Solicitante: ORION CORPORATION.
Nacionalidad solicitante: Finlandia.
Dirección: ORIONINTIE 1,02200 ESPOO.
Inventor/es: VAHERVUO, KARI.
Fecha de Publicación: .
Clasificación Internacional de Patentes:
- A61K31/195 NECESIDADES CORRIENTES DE LA VIDA. › A61 CIENCIAS MEDICAS O VETERINARIAS; HIGIENE. › A61K PREPARACIONES DE USO MEDICO, DENTAL O PARA EL ASEO (dispositivos o métodos especialmente concebidos para conferir a los productos farmacéuticos una forma física o de administración particular A61J 3/00; aspectos químicos o utilización de substancias químicas para, la desodorización del aire, la desinfección o la esterilización, vendas, apósitos, almohadillas absorbentes o de los artículos para su realización A61L; composiciones a base de jabón C11D). › A61K 31/00 Preparaciones medicinales que contienen ingredientes orgánicos activos. › que tienen un grupo amino.
- A61K31/275 A61K 31/00 […] › Nitrilos; Isonitrilos.
- A61K45/06 A61K […] › A61K 45/00 Preparaciones medicinales que contienen ingredientes activos no previstos en los grupos A61K 31/00 - A61K 41/00. › Mezclas de ingredientes activos sin caracterización química, p. ej. compuestos antiflojísticos y para el corazón.
- A61K9/16H6D
- A61K9/16H6F
- A61K9/28H6D
- A61K9/48 A61K […] › A61K 9/00 Preparaciones medicinales caracterizadas por un aspecto particular. › Preparaciones en cápsulas, p. ej. de gelatina, de chocolate.
Clasificación PCT:
- A61K31/195 A61K 31/00 […] › que tienen un grupo amino.
- A61K31/275 A61K 31/00 […] › Nitrilos; Isonitrilos.
- A61K9/16 A61K 9/00 […] › Aglomerados; Granulados; Microbolitas.
- A61K9/28 A61K 9/00 […] › Grageas; Píldoras o comprimidos con revestimientos.
- A61K9/48 A61K 9/00 […] › Preparaciones en cápsulas, p. ej. de gelatina, de chocolate.
Fragmento de la descripción:
Un método para la fabricación de gránulos que contienen entacapona para formas de dosificación oral.
Campo de la invención
La presente invención se relaciona con un método para la preparación de gránulos que contienen entacapona.
Antecedentes de la invención
La entacapona, ((E)- 2-ciano-3-(3,4-dihidroxi-5-nitrofenil)-N-dietil-2 propenamida), es un inhibidor de la catecol-O-metil transferasa (inhibidor de COMD que se utiliza en combinación con la levodopa y una dopa descarboxilasa (DDC) para tratar la enfermedad de Parkinson (PD). Es disponible comercialmente como una formulación autónoma bajo las marcas comerciales Comtess® y Comtan® y bajo la marca comercial Stalevo® como una combinación fija (levodopa: carbidopa: entacapona: 50 mg:12.5 mg:200 mg, 100 mg:25 mg:200 mg y 150 mg:37.5 mg:200 mg).
Especial atención se necesita en la gestión de los síntomas de pacientes con PD de fase tardía, que experimentan severas fluctuaciones de tipo on-off. Generalmente los doctores les prescriben la forma de dosificación integrada, debido a su flexibilidad en la dosificación. Aquellos pacientes, especialmente los que tienen problemas para tragar, se beneficiarían si una dosificación más pequeña estuviera disponible.
EP 1112 065 B (WO 00/15196) revela el comprimido de entacapona integrada actualmente en el mercado bajo las marcas comerciales Comtess® y Comtan®, y EP 1189 608 B (WO 01/01984) revela el producto de combinación fija comercializado bajo la marca comerciales Stalevo®. US 2003/017 201A describe una composición de dosis fija sólida, oral que comprende entacapona, levodopa y carbidopa.
Resumen de la invención
Los solicitantes han descubierto que es posible hacer una forma de dosificación oral de entacapona que se traga más fácilmente mientras que se mantiene la biodisponibilidad oral de la entacapona.
Es un aspecto de la invención proporcionar una forma de dosificación oral que comprende una cantidad de entacapona farmacológicamente efectiva como el principio activo solo, en donde la cantidad de entacapona en una porción de la forma de dosificación oral es de 35% a 99%, por ejemplo de 48% a 85%, por ejemplo de 50% a 65 en peso de la porción.
Es otro aspecto de la invención, proporcionar un comprimido que comprende una cantidad de entacapona farmacológicamente efectiva como la sustancia farmacéutica sola.
Es otro aspecto de la invención, proporcionar un núcleo de comprimido que comprende una cantidad de entacapona farmacológicamente efectiva como la sustancia farmacéutica sola.
Es otro aspecto de la invención, proporcionar gránulos que comprenden una cantidad de entacapona farmacológicamente efectiva como la sustancia farmacéutica sola.
Es otro aspecto de la invención, proporcionar una mezcla de gránulos que comprende gránulos que tienen una cantidad de entacapona farmacológicamente efectiva como la sustancia farmacéutica sola, y uno o más excipientes extragranulares.
Es otro aspecto de la invención, proporcionar una cápsula que comprende una cantidad de entacapona farmacológicamente efectiva como la sustancia farmacéutica sola.
Es otro aspecto de la invención, proporcionar cualquier condición de USG para la fabricación de un medicamento en donde los inhibidores COMT se encuentran que son útiles, condiciones particularmente en donde la potenciación de la levodopa se necesita, por ejemplo enfermedad de Parkinson y síndrome de piernas inquietas (RLS, una condición caracterizada por un deseo irresistible de mover las piernas, acompañado por otras sensaciones desagradables profundas dentro de las piernas).
Los aspectos adicionales y las ventajas de la invención serán publicados en parte en la descripción que sigue, y en parte serán obvias a partir de la descripción; o se puede aprender por la práctica de la invención. Los objetos y las ventajas de la invención serán realizados y logrados por medio de los elementos y combinaciones particularmente indicadas en las reivindicaciones anexas.
Se debe entender que tanto la descripción general precedente y la siguiente descripción detallada son ejemplares y explicativas solamente y no restringen la invención, según se reivindica.
Breve descripción de los dibujos
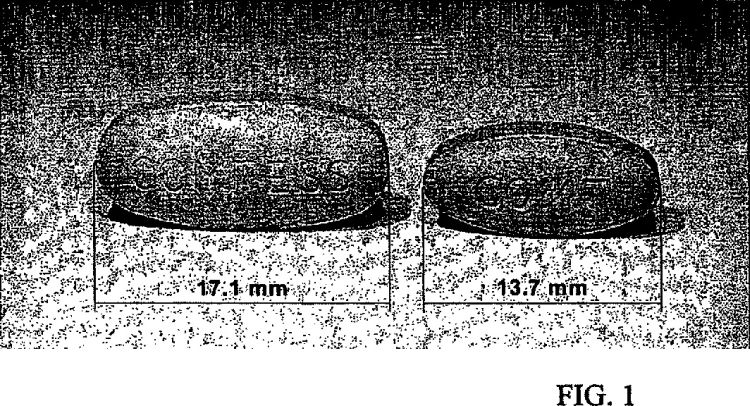
Fig.-1 muestra las fotografías del presente comprimido integrado en el mercado (vendido bajo las marcas comerciales Comtess® y Comtan®) y un comprimido de acuerdo con la invención, respectivamente.
Descripción detallada de la invención
La invención se relaciona con una nueva forma de dosificación de entacapona, que no solo cumple con las necesidades de los pacientes (tales como aquellos que tienen síntomas de Enfermedad de Parkinson de fase tardía con severas fluctuaciones del tipo on-off y pacientes que tienen dificultad para tragar), sino también permite la fabricación simple y rentable, sin que se comprometa la calidad técnica del producto.
La preparación de las composiciones farmacéuticas de entacapona se ha comprobado que es problemática. La entacapona se absorbe rápidamente en el tracto gastrointestinal, sin embargo, la solubilidad en agua de entacapona es muy baja. Debido a la pobre solubilidad, la velocidad de disolución de la entacapona puede ser un factor limitante para la absorción de entacapona en el tracto gastrointestinal. Los aspirantes han encontrado que, con el fin de facilitar la absorción con el paciente, la entacapona que tiene un cierto tamaño de partícula reducido, según se discute a continuación se utiliza preferiblemente en las formas de dosificación de la invención.
Las partículas de entacapona de tamaño de partícula reducido, sin embargo, tienen la tendencia a causar problemas de fabricación, provocando con ello retrasos innecesarios en la producción. Los problemas potenciales relacionados con el tamaño de partícula reducido incluyen fluidez y aglomeración pobres que pueden resultar en comprometer la uniformidad de contenido (i.e. una cantidad de entacapona reproducible entre diferentes unidades).
Como una solución a este problema, una forma de dosificación oral de entacapona así como métodos para la preparación de estos se han inventado por los aspirantes, lo que reduce o evita los problemas de fabricación tales como aquellos descritos anteriormente y mejora la uniformidad de contenido mientras que reduce el tamaño de la forma de dosificación final.
En una realización de la invención, se proporciona una forma de dosificación oral que comprende una cantidad de entacapona farmacológicamente efectiva como la sustancia farmacéutica sola, en donde la cantidad de entacapona en una porción de la forma de dosificación oral es del 35% al 99% en peso de la porción.
En una realización de la invención, se proporciona una forma de dosificación oral que comprende una cantidad de entacapona farmacológicamente efectiva como la sustancia farmacéutica sola en una porción de la forma de dosificación oral del 48% al 85% en peso de la porción.
En una realización de la invención, se proporciona una forma de dosificación oral que comprende una cantidad de entacapona farmacológicamente efectiva como la sustancia farmacéutica sola en una porción de la forma de dosificación oral del 50% al 65% en peso de la porción.
El término "porción" de una forma de dosificación puede representar, por ejemplo, la forma de dosificación excluyendo cualquier recubrimiento exterior hecho de excipientes farmacéuticamente aceptables. El término "porción" de una forma de dosificación también puede representar, por ejemplo, la forma de dosificación excluyendo cualquier cubierta de la cápsula que contiene, es residuo de la forma de dosificación.
Así, si la forma de dosificación es un núcleo de comprimido, una "porción" de la forma de dosificación puede representar, por ejemplo, la forma de dosificación total. Cuando la forma de dosificación es un comprimido que comprende a núcleo de comprimido recubierto con excipientes farmacéuticamente aceptables, una "porción" de la forma de dosificación puede representar, por ejemplo, el comprimido excluyendo el recubrimiento hecho de excipientes farmacéuticamente aceptables. Cuando la forma de dosificación es una cápsula, una "porción" de la forma de dosificación puede representar, por ejemplo, los contenidos adjuntos por la cubierta de la cápsula.
La referencia a la entacapona como "la sustancia farmacéutica sola," indica que ninguna otra sustancia está presente en una cantidad...
Reivindicaciones:
1. Un método para la preparación de gránulos de entacapona que comprende (i) la preparación de una mezcla de entacapona como la sustancia farmacéutica sola con un aglutinante y opcionalmente uno o más otros excipientes y la granulación de la mezcla con un líquido de granulación o la granulación del entacapona junto con uno o más otros excipientes opcionales con un líquido de granulación que comprende un aglutinante o por granulación por fusión; (ii) secado o enfriamiento, respectiva y opcionalmente tamizado de los gránulos de la etapa (i).
2. El método de la reivindicación 1, en donde la proporción del aglutinante con la masa de granulación es de 0.5:99.5 al 64.5:35.5 en peso seco.
3. El método de la reivindicación 1, en donde la proporción del aglutinante con la masa de granulación es de 1:99 al 35:65 en peso seco.
4. El método de acuerdo con cualquiera de las reivindicaciones 1 al 3, en donde el aglutinante es uno o más de acacia, ácido algínico, carbómero, carboximetilcelulosa de sodio, ceratonia, aceite de semilla de algodón, dextrina, dextrosa, gelatina, goma guar, aceite vegetal hidrogenado tipo I, hidroxietil celulosa, hidroxietilmetil celulosa, hidroxipropil celulosa, hidroxipropil celulosa sustituida inferior, hipromelosa, silicato de aluminio de magnesio, maltodextrina, maltosa, metilcelulosa, celulosa microcristalina, polidextrosa, óxido de polietileno, polimetacrilatos, povidona, alginato de sodio, almidón, almidón pregelatinado, ácido esteárico, sacarosa y zeína.
5. El método de acuerdo con la reivindicación 4, en donde el aglutinante es uno o más de povidona, hipromelosa, hidroxipropil celulosa, metilcelulosa y gelatina.
6. El método de acuerdo con la reivindicación 1, en donde el líquido de granulación es agua, un alcohol inferior o una mezcla de estos.
7. El método de acuerdo con cualquiera de las reivindicaciones 1 al 6, que comprende la granulación del entacapona en la presencia de un excipiente, en donde el excipiente es un disgregante.
8. El método de acuerdo con la reivindicación 7, en donde el disgregante es uno o más del ácido algínico, fosfato de calcio, tribásico, carboximetilcelulosa de calcio, carboximetilcelulosa de sodio, dióxido de silicio coloidal, sodio croscarmelosa, crospovidona, docusato sódico, goma guar, hidroxipropil celulosa sustituida inferior, silicato de magnesio aluminio, metilcelulosa, celulosa microcristalina, povidona, alginato de sodio, almidón glicolato de sodio, polacrilina de potasio, celulosa microcristalina silificada, almidón y almidón pre-gelatinizado.
9. El método de acuerdo con la reivindicación 8, en donde el disgregante es uno o más de sodio croscarmelosa, crospovidona, hidroxipropil celulosa sustituida inferior, celulosa microcristalina y almidón glicolato de sodio.
10. El método de acuerdo con la reivindicación 8, en donde el disgregante es sodio croscarmelosa y el líquido de granulación es agua, y la cantidad de agua adicionada durante la granulación es de 50% a 120% en comparación con el peso seco de la masa de granulación.
11. El método de acuerdo con la reivindicación 8, en donde el disgregante es L-HPC y la cantidad de agua adicionada durante la granulación es de 30% a 100% en comparación con el peso seco de la masa de granulación.
12. El método de acuerdo con la reivindicación 10, en donde el disgregante es sodio croscarmelosa y la cantidad de agua adicionada durante la granulación es de 70% a 100% en comparación con el peso seco de la masa de granu- lación.
13. El método de acuerdo con cualquiera de las reivindicaciones 1 a 12, en donde la granulación se lleva a cabo en tres etapas: 1) una etapa de premezcla, 2) adición del líquido de granulación y 3) la etapa de mezclado.
14. El método de acuerdo con la reivindicación 13, en donde la premezlca se realiza por mezclado por difusión, mezclado por convección o utilizando granulación continua.
15. El método de acuerdo con la reivindicación 13, en donde la adición del líquido de granulación se lleva a cabo utilizando un mezclador de cizallamiento alto, un procesador de recipiente único o granulación continua.
16. El método de acuerdo con la reivindicación 13, en donde la etapa de premezcla se lleva a cabo utilizando un mezclador de cizallamiento vertical alto y el tiempo de mezclado es de 0.5 a 5.5 min, velocidad de impulso de 50 al 200 rpm y velocidad del cortador de 0 a 800 rpm.
17. El método de la reivindicación 13, en donde el líquido de granulación es agua y la adición de agua se lleva a cabo utilizando una mezclador de cizallamiento vertical alto, utilizando un tiempo de mezclado de 5 a 20 min, velocidad de impulso de 50 a 200 rpm y velocidad del cortador de 0 a 800 rpm.
18. El método de la reivindicación 13, en donde la etapa de mezclado se lleva a cabo utilizando un mezclador de cizallamiento vertical alto, utilizando un tiempo de mezclado de 0.5 a 15 min, velocidad de impulso de 50 al 200 rpm y la velocidad del cortador de 0 a 800 rpm.
19. El método de acuerdo con cualquiera de las reivindicaciones precedentes, en donde los gránulos se secan en un procesador de recipiente único, en un lecho fluidizado o en una cámara de secado.
20. El método de acuerdo con cualquiera de las reivindicaciones precedentes, en donde los gránulos se secan directamente en el equipo de granulación.
21. El método de acuerdo con cualquiera de las reivindicaciones precedentes, en donde los gránulos se secan utilizando un secador de lecho fluidizado y el equipo se pre-calienta antes del secado.
22. El método de acuerdo con cualquiera de las reivindicaciones precedentes, en donde los gránulos se tamizan.
23. El método de acuerdo con la reivindicación 22, en donde los gránulos se tamizan a una distribución del tamaño de gránulo por volumen, en el cual el percentil del 10% es de 7 µm al 60 µm, el percentil del 90% es de 600 µm a 1200 µm, y la media proporcional es de 80 µm al 600 µm.
24. El método de acuerdo con la reivindicación 22, en donde los gránulos se tamizan a una distribución del tamaño de gránulo por volumen, en el cual el percentil del 10% es de 10 µm a 40 µm, el percentil del 90% es de 750 µm a 1100 µm, y la media proporcional es de 100 µm al 300 µm.
25. El método de cualquiera de las reivindicaciones precedentes, en donde los gránulos comprenden el polimorfo A del isómero (E) de la entacapona.
26. El método de cualquiera de las reivindicaciones 1 al 24, en donde los gránulos comprenden el polimorfo D del isómero (E) de la entacapona.
27. El método de cualquiera de las reivindicaciones precedentes, en donde la entacapona utilizada en la preparación de los gránulos es en la forma particulada y al menos 90% de partículas de la entacapona tienen un diámetro menor de 55 µm.
28. El método como se reivindica en cualquiera de las reivindicaciones precedentes en donde la entacapona utilizada en la preparación de los gránulos es en la forma particulada y al menos 90% de las partículas de entacapona tienen un diámetro menor de 35 µm.
29. El método como se reivindica en cualquiera de las reivindicaciones precedentes en donde la entacapona utilizada en la preparación de los gránulos es en la forma particulada y no más del 20% de partículas de entacapona tienen un diámetro menor de 2 µm.
30. Los gránulos obtenibles por un método de acuerdo con cualquiera de las reivindicaciones 1 al 29.
31. Un método para la preparación de un núcleo de comprimido que comprende
(i) la preparación de una mezcla de entacapona como la sustancia farmacéutica sola con un aglutinante y opcionalmente uno o más otros excipientes y la granulación de la mezcla con un líquido de granulación o la granulación de la entacapona junto con uno o más otros excipientes opcionales con un líquido de granulación, que comprenden un aglutinante o por granulación por fusión;
(ii) secado o enfriamiento, respectiva y opcionalmente tamizado de los gránulos de la etapa (i), que opcionalmente pone en contacto los gránulos con uno o más excipientes extragranulares y
(iii) compresión de los gránulos y los excipientes extragranulares opcionales en un núcleo de comprimido, y opcionalmente
(iv) recubrimiento del núcleo de comprimido.
32. Un método para la preparación de una mezcla de gránulos de entacapona que comprende la preparación de los gránulos de acuerdo con cualquiera de las reivindicaciones 1 al 29 y que pone en contacto los gránulos con uno o más excipientes extragranulares.
33. Un método para la preparación de una cápsula de entacapona mediante,
(i) la preparación de una mezcla de entacapona como la sustancia farmacéutica sola con un aglutinante y opcionalmente uno o más otros excipientes y la granulación de la mezcla con un líquido de granulación de la granulación del entacapona junto con uno o más otros excipientes opcionales con un líquido de granulación que comprende un aglutinante o por granulación por fusión;
(ii) secado o enfriamiento, respectiva y opcionalmente tamizado de los gránulos de la etapa (i), que opcionalmente pone en contacto los gránulos con uno o más excipientes extragranulares y
(iii) llenado de los gránulos y excipientes extragranulares opcionales dentro de una cápsula apropiada.
34. Los gránulos que comprenden una cantidad de entacapona farmacológicamente efectiva como la sustancia farmacéutica sola que tiene la distribución del tamaño de gránulo por volumen en la cual el percentil del 10% es de 7 µm a 60 µm, el percentil del 90% es de 600 µm a 1200 µm, y la media proporcional es de 80 µm al 600 µm.
35. Los gránulos como se reivindica en la reivindicación 34, en el cual el percentil del 10% es de 10 µm a 40 µm, el percentil del 90% es de 750 µm a 1100 µm, y la media proporcional es de 100 µm a 300 µm.
36. Los gránulos que comprenden 35% a 99% en peso de la entacapona como la sustancia farmacéutica sola, en donde la entacapona es en forma particulada y al menos 90% de las partículas de entacapona tienen un diámetro menor de 55 µm.
37. Los gránulos como se reivindica en la reivindicación 36, que comprenden del 50% al 65% en peso de entacapona.
38. Los gránulos como se reivindica en la reivindicación 36 o 37 en donde al menos 90% de las partículas de entacapona tienen un diámetro menor de 35 µm.
39. Los gránulos como se reivindica en cualquiera de las reivindicaciones 36 al 38, en donde no más del 20% de las partículas de entacapona tienen un diámetro menor de 2 µm.
40. Una forma de dosificación oral, que comprende los gránulos como se reivindica en cualquiera de las reivindicaciones 30 o 34 al 39.
41. Los gránulos como se reivindica en cualquiera de las reivindicaciones 30 o 34 al 39 o una forma de dosificación como se reivindica en la reivindicación 40, para emplear en el tratamiento de la enfermedad de Parkinson.
42. Los gránulos como se reivindica en cualquiera de las reivindicaciones 30 o 34 al 39 o una forma de dosificación como se reivindica en la reivindicación 40, para emplear en el tratamiento del Síndrome de las Piernas Inquietas.
Patentes similares o relacionadas:
Preparación sólida que contiene colorante, del 29 de Julio de 2020, de DAIICHI SANKYO COMPANY, LIMITED: Preparación farmacéutica sólida que comprende monobencenosulfonato de ácido [(1R,5S,6S)-6-(aminometil)-3- etilbiciclo[3.2.0]hept-3-en-6-il]acético […]
Materiales y procedimientos para mejorar la función gastrointestinal, del 22 de Abril de 2020, de UNIVERSITY OF FLORIDA RESEARCH FOUNDATION, INC.: Una composición terapéutica estéril para su uso en un procedimiento para tratar a un sujeto que tiene atrofia de las vellosidades producida por radiación o quimioterapia, […]
Composiciones para mejorar la viabilidad celular y los métodos de uso de las mismas, del 15 de Abril de 2020, de Amylyx Pharmaceuticals Inc: Una composición que comprende una cantidad efectiva de ácido tauroursodesoxicólico (TUDCA) o una sal farmacéuticamente aceptable del mismo, […]
Composiciones sólidas que comprenden un agonista del GLP-1 y una sal del ácido N-(8-(2-hidroxibenzoil)amino)caprílico, del 4 de Marzo de 2020, de NOVO NORDISK A/S: Una composición sólida para administración oral que comprende semaglutida y una sal del ácido N-(8-(2- hidroxibenzoil)amino)caprílico, en donde dicha composición comprende […]
Nuevos enfoques terapéuticos para tratar la enfermedad de Alzheimer, del 4 de Marzo de 2020, de Pharnext: Una composición para uso en el tratamiento de la enfermedad de Alzheimer (EA) o un trastorno relacionado, que comprende al menos levosimendán, o una sal […]
Administración continua de L-dopa, inhibidores de dopa descarboxilasa, inhibidores de catecol-o-metil transferasa y composiciones para ello, del 8 de Enero de 2020, de Neuroderm Ltd: Composición líquida farmacéuticamente aceptable que comprende carbidopa, de 4% a 12% en peso de levodopa; y de 9% a 30% en peso de arginina, en donde dicha composición tiene […]
Utilización de la taurina o derivados para el tratamiento de la alopecia, del 25 de Diciembre de 2019, de L'OREAL: Utilización cosmética de la taurina y/o de la hipotaurina y/o de sus sales aceptables, en asociación con al menos un polifenol y/o un extracto que lo […]
Nuevo inhibidor de la fosfodiesterasa de tipo 5 y su aplicación, del 4 de Diciembre de 2019, de Chongqing Dikang Erle Pharma Co. Ltd: Un compuesto o una sal farmacéuticamente aceptable del mismo, **(Ver fórmula)**