SNS-595 Y METODOS DE USO DEL MISMO.
Una combinación que comprende: a) una cantidad terapéuticamente eficaz de ácido (+)-1,
4-dihidro-7-((3S,4S)-3-metoxi-4-(metilamino)-1-pirrolidinil)-4-oxo-1-(2-tiazolil)-1,8-naftiridin-3-carboxílico y b) una cantidad terapéuticamente eficaz de un inhibidor de Hsp90 o de un agente que es capaz de impedir la síntesis de DNA seleccionado de un antibiótico anti-neoplásico, un anti-metabolito, un complejo de coordinación del platino y un inhibidor de topoisomerasa II
Tipo: Resumen de patente/invención. Número de Solicitud: W05008036US.
Solicitante: SUNESIS PHARMACEUTICALS, INC..
Nacionalidad solicitante: Estados Unidos de América.
Dirección: 395 OYSTER POINT BLVD., SUITE 400,SOUTH SAN FRANCISCO, CA 94080.
Inventor/es: ARKIN,MICHELLE, HYDE,JENNIFER, WALKER,DUNCAN, WRIGHT,JASMINE.
Fecha de Publicación: .
Fecha Concesión Europea: 16 de Diciembre de 2009.
Clasificación Internacional de Patentes:
- A61K31/44 NECESIDADES CORRIENTES DE LA VIDA. › A61 CIENCIAS MEDICAS O VETERINARIAS; HIGIENE. › A61K PREPARACIONES DE USO MEDICO, DENTAL O PARA EL ASEO (dispositivos o métodos especialmente concebidos para conferir a los productos farmacéuticos una forma física o de administración particular A61J 3/00; aspectos químicos o utilización de substancias químicas para, la desodorización del aire, la desinfección o la esterilización, vendas, apósitos, almohadillas absorbentes o de los artículos para su realización A61L; composiciones a base de jabón C11D). › A61K 31/00 Preparaciones medicinales que contienen ingredientes orgánicos activos. › Piridinas no condensadas; Sus derivados hidrogenados.
- A61K38/18B
- A61K45/06 A61K […] › A61K 45/00 Preparaciones medicinales que contienen ingredientes activos no previstos en los grupos A61K 31/00 - A61K 41/00. › Mezclas de ingredientes activos sin caracterización química, p. ej. compuestos antiflojísticos y para el corazón.
- A61K9/00M5
Clasificación PCT:
- A61K31/44 A61K 31/00 […] › Piridinas no condensadas; Sus derivados hidrogenados.
Clasificación antigua:
- A61K31/44 A61K 31/00 […] › Piridinas no condensadas; Sus derivados hidrogenados.
Fragmento de la descripción:
SNS-595 y métodos de uso del mismo.
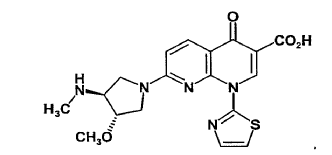
SNS-595 es un nuevo agente citotóxico de naftiridina que previamente fue conocido como AG-7352 (véase por ejemplo, Tsuzuki et al., Tetrahedron-Asymmetry 12: 1793-1799 (2001) y la patente de EE.UU. Nº 5.817.669). El nombre químico del SNS-595 es ácido (+)-1,4-dihidro-7-[(3S,4S)-3-metoxi-4(metilamino)-1-pirimidini]-4-oxo-1-(2-tiazolil)-1,8-naftiridin-3-carboxílico y tiene la estructura mostrada a continuación.
La presente invención se refiere a combinaciones que comprenden SNS-595 y usos de SNS-595.
La Figura 1 ilustra los tres principales daños del DNA y las vías de reparación.
La Figura 2 representa las respuestas dependientes de las dosis de miembros ilustrativos de la vía DNA-PK en células HCT 116 tratadas con SNS-595.
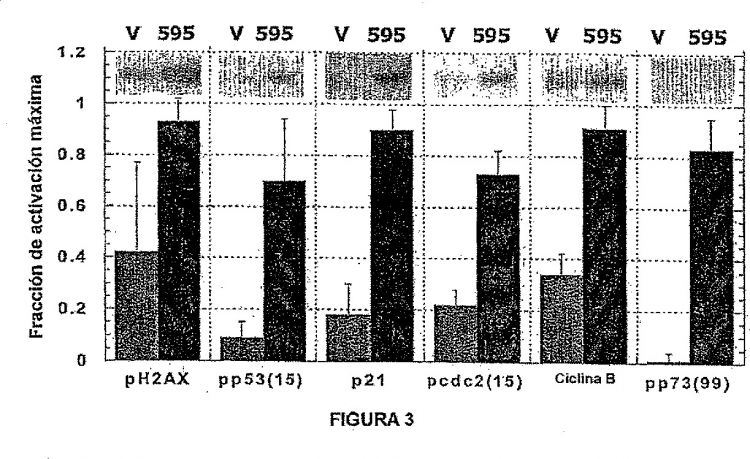
La Figura 3 representa la activación de miembros ilustrativos de la vía DNA-PK en tumores de ratones.
Los estudios previos usan inhibidores de DNA-PK en combinación con un segundo agente, en donde la inhibición de DNA-PK dan como resultado la necesidad de una dosis inferior del segundo agente anti-cáncer para conseguir la apoptosis celular (WO 02/20500 Halbrook et al).
Las células proliferantes experimentan cuatro fases del ciclo celular: G1, S, G2 y M. Estas fases se identificaron primeramente observando células en división a medidas que las células progresaban a través de la síntesis de DNA que llegó a ser conocida como la fase de síntesis del DNA o fase S del ciclo celular y la mitosis que llegó a ser conocida como la fase mitótica o fase M del ciclo celular. Las separaciones observadas en el tiempo que tarda en completarse la síntesis de DNA y la mitosis y entre la mitosis y el ciclo siguiente de la síntesis de DNA llegaron a ser conocidas como las fases G1, y G2 respectivamente. Las células no proliferantes que retienen la capacidad de proliferar en condiciones apropiadas están quiescentes o en el estado G0 y están caracterizadas típicamente por tener por tener excitado el ciclo celular.
El ciclo celular tiene múltiples puntos de control para impedir que las células intenten progresar a través del ciclo celular en circunstancias inapropiadas deteniendo las células en estos puntos designados. Un importante punto de control ocurre antes de que la célula entre en la fase S y analiza, por ejemplo, si el medio ambiente (por ejemplo, si hay los nutrientes suficientes) es adecuado para la división celular. Las células que fallan en un punto de control en la fase G1 y por tanto están impedidas de entrar en la fase S se dice que están detenidas en G1. Otro punto de control ocurre antes de que la célula entre en la fase M y analiza por ejemplo, la integridad del DNA sintetizado. Las células que fallan un punto de control en la fase G2 y que por tanto están impedidas de entrar en la fase M se dice que están detenidas en G2. Otro punto de control ocurre la fase M inmediatamente antes de la citoquinesis y analiza, por ejemplo, que los cromosomas estén apropiadamente alineados. Las células que fallan un punto de control en la fase M y están por tanto impedidas de dividirse se dice que están detenidas en M.
En la práctica, la detención del ciclo celular se caracteriza frecuentemente por el contenido de DNA y no por un fallo en puntos de control. En consecuencia, las detenciones de células más frecuentemente descritas son detenciones en G1 basadas en contenido de DNA 2N la detención G2/M basada en contenido de DNA 4N.
La SNS-595 es un inhibidor del ciclo celular y detiene las células en la interfase de G2. Inicialmente, se creyó que la actividad de SNS-595 era debida a la inhibición de la topoisomerasa II. Aunque SNS-595 es un inhibidor catalítico de la topoisomerasa II (inhibe la descadenización y el relajamiento del DNA super-enrollado sin formación de complejos escindibles) con un valor de la CI50 de aproximadamente 5 µm, no puede establecerse una correlación dependiente de la dosis entre su actividad de topoisomerasa II y su efecto en las células. Por ejemplo, el valor de la CE50 en diversas células varía desde 200-300 nM, al menos una diferencia de diez veces en aumento de potencia a partir de la inhibición bioquímica de la topoisomerasa II. Además, cuando se modularon los niveles de la topoisomerasa II en las células usando 2-desoxiglucosa (que da como resultado la degradación de la enzima) no se observa esencialmente diferencia en actividad entre las células tratadas con 2-desoxiglucosa y células no tratadas.
La inducción de la detención en G2 tampoco parece tener un efecto contributivo significativo a la citotoxicidad de SNS-595. Por ejemplo, en células en donde la detención en G2 está suprimida (tratándolas con cafeína que inhibe tanto ATM como ATR), esencialmente no se observaron diferencias en los valores de la CE50 por tratamiento con SNS-595 cuando se compararon con las células del grupo no tratado con cafeína y en donde se observa detención en G2). Como se muestra en la Figura 1, ATM, ATR y DNA-PK son los tres sensores/efectores centrales del DNA que dependiendo del nivel de daño del DNA que se detecta dentro de una célula individual, dirigen a la célula en una de las varias salidas que incluyen reparación del DNA, detención en G2 o apoptosis.
Contrariamente a su caracterización inicial, el agente SNS-595 media la activación de la vía DNA-PK que finalmente conduce a la muerte celular por apoptosis. Notablemente, estos eventos son específicos de la fase S lo que significa que sólo ocurren durante la fase S del ciclo celular.
El tratamiento con SNS-595 da como resultado un aumento en el número de roturas del DNA bicatenario que se forma durante la fase S. Este daño impide la capacidad de las células para sintetizar DNA y prolonga el tiempo que la célula gasta en la fase S. Como ilustra la Figura 2, la formación de roturas de dobles cadenas activa en una manera dependiente de la dosis la reparación mediada por DNA-PK y la maquinaria celular apoptótica incluyendo: i) expresión de DNA-PK; ii) fosforilación de H2AX; iii) fosforilación de c-Ab1; iv) fosforilación de p53; v) fosforilación de p73; vi) expresión de p21; vii) activación de la caspasa-9; y viii) activación de la caspasa-3. Cuando el daño al DNA es suficientemente severo de tal modo que las roturas de la doble cadena no pueden ser reparadas a través de la unión de los extremos no homólogos (NHB), la célula entra rápidamente en apoptosis. Algunas células son capaces de alcanzar la fase G2 pero subsiguientemente son detenidas (mediadas por edc2/ciclina B) debido a que las células están demasiado dañadas para entrar en la fase M y finalmente llegan a ser apoptóticas. Notablemente, debido a que el SNS-595 es selectivo para la fase S, las dosis de SNS-595 que son citotóxicas para las células proliferantes (que por tanto están progresando a través del ciclo celular incluyendo la fase S) no son letales para las células no proliferantes.
Consistente con este mecanismo, las células con resistencia inducida al SNS-595 también tienen alteraciones en la vía de DNA-PK. Por ejemplo, una variante estable de las células HCT-116 que es aproximadamente 10 veces menos sensible al SNS-595 con respecto a las células HCT-116, muestra por ejemplo mayores niveles de KU70, una proteína que es un componente esencial del complejo DNA-PK activado. Inversamente, menores niveles de DNA-PK o su actividad (por ejemplo, en presencia de un inhibidor) están asociados con una mayor sensibilidad a SNS-595.
La citotoxicidad de SNS-595 mediada por DNA-PK es inusual. Los compuestos conocidos que también impiden la síntesis de DNA actúan usualmente a través de ATR o a través de tanto ATM como DNA-PK. Ejemplos ilustrativos de compuestos citotóxicos mediados por ATR incluyen antimetabolitos e inhibidores de DNA-polimerasa. Ejemplos ilustrativos de compuestos citotóxicos mediados por ATM y DNA-PK incluyen venenos para la topoisomerasa II y antibióticos antineoplásicos, tales como la bleomicina.
La presente invención se refiere a SNS-595 y al uso de su mecanismo de acción en maximizar su potencial terapéutico en tratar cáncer humano, tal como cáncer de vejiga, cáncer de mama, cáncer del cuello de la matriz, cáncer de colon, (incluyendo cáncer colono-rectal), cáncer de esófago, cáncer de cabeza y cuello, leucemia, cáncer...
Reivindicaciones:
1. Una combinación que comprende: a) una cantidad terapéuticamente eficaz de ácido (+)-1,4-dihidro-7-((3S,4S)-3-metoxi-4-(metilamino)-1-pirrolidinil)-4-oxo-1-(2-tiazolil)-1,8-naftiridin-3-carboxílico y b) una cantidad terapéuticamente eficaz de un inhibidor de Hsp90 o de un agente que es capaz de impedir la síntesis de DNA seleccionado de un antibiótico anti-neoplásico, un anti-metabolito, un complejo de coordinación del platino y un inhibidor de topoisomerasa II.
2. La combinación de la reivindicación 1, en donde el segundo agente es un antibiótico anti-neoplásico.
3. La combinación de la reivindicación 1. en donde el segundo agente es un anti-metabolito.
4. La combinación de la reivindicación 3, en donde el anti-metabolito es un análogo de folato, un análogo de purina, un análogo de adenosina, un análogo de pirimidina o hidroxiurea.
5. La combinación de la reivindicación 1, en donde el agente es un complejo de coordinación del platino.
6. La combinación de la reivindicación 1, en donde el agente es un inhibidor de la topoisomerasa II.
7.La combinación de la reivindicación 1, en donde el agente es un análogo de pirimidina.
8. La combinación de la reivindicación 7, en donde el agente se selecciona de citarabina, capecitabina y fluorouracilo.
9. La combinación de cualquiera de las reivindicaciones 1 a 8 para uso en tratamiento del cáncer.
10. Uso de ácido (+)-1,4-dihidro-7-[(3S,4S)-3-metoxi-4-(metilamino)-1-pirrolidinil)-4-oxo-1-(2-tiazolil)-1,5-naftiridin-3-carboxílico en combinación con un inhibidor de Hsp90 o un agente que es capaz de impedir la síntesis de DNA seleccionado de antibiótico anti-neoplásico, un anti-metabolito, un complejo de coordinación del platino y un inhibidor de topoisomerasa II para la fabricación de un medicamento para tratamiento del cáncer.
11. El uso de la reivindicación 10, en donde el agente es un antibiótico anti-neoplásico.
12. El uso de la reivindicación 10, en donde el agente es un anti-metabolito.
13. El uso de la reivindicación 12, en donde el anti-metabolito es un análogo de folato, un análogo de purina, un análogo de adenosina, un análogo de pirimidina o hidroxiurea.
14. El uso de la reivindicación 10, en donde el agente es un complejo de coordinación del platino.
15. El uso de la reivindicación 10, en donde el agente es un inhibidor de la topoisomerasa II.
16. El uso de la reivindicación 10, en donde el agente es un análogo de pirimidina.
17. El uso de la reivindicación 16, en donde el análogo de pirimidina se selecciona de citarabina, capecitabina y fluorouracilo.
Patentes similares o relacionadas:
Composiciones farmacéuticas que contienen una leucocidina E mutada, del 22 de Julio de 2020, de NEW YORK UNIVERSITY: Una composición que comprende: una proteína Leucocidina E (LukE) aislada que comprende la secuencia de aminoácidos de la SEQ ID NO: 4, o un polipéptido […]
Procedimiento de compuestos antifúngicos, del 22 de Julio de 2020, de NQP 1598, Ltd: Procedimiento para preparar un compuesto de fórmula 5 ó 5*, o una mezcla de los mismos: **(Ver fórmula)** comprendiendo el método: (a) hacer reaccionar un compuesto […]
Productos terapéuticos basados en la lantionina sintetasa 2 tipo C, del 15 de Julio de 2020, de LANDOS BIOPHARMA, INC: Un compuesto de la fórmula: **(Ver fórmula)** o una sal o éster farmacéuticamente aceptable de este, en donde: Q es piperazina-1,4-diilo; […]
Derivados de piperidina en calidad de inhibidores de HDAC1/2, del 8 de Julio de 2020, de Regenacy Pharmaceuticals, Inc: Un compuesto de Fórmula IIIa: **(Ver fórmula)** o una sal farmacéuticamente aceptable del mismo, en donde R1 se selecciona del grupo que consiste […]
Compuestos orgánicos, del 17 de Junio de 2020, de INTRA-CELLULAR THERAPIES, INC: Un compuesto de Fórmula I: **(Ver fórmula)** en forma libre o de sal, donde: R1 y R2 son independientemente H o alquilo C1-4 (por ejemplo, metilo o […]
Compuestos ahorradores de PPAR para el tratamiento de enfermedades metabólicas, del 3 de Junio de 2020, de Metabolic Solutions Development Company LLC (100.0%): Un compuesto de Fórmula I: **(Ver fórmula)** o una sal farmacéuticamente aceptable del mismo, en la que: cada uno de R1 y R2 se selecciona independientemente entre […]
Uso de inhibidores de la PDE4 para la profilaxis y/o la terapia de la dislipoproteinemia y trastornos relacionados, del 27 de Mayo de 2020, de Albert-Ludwigs-Universität Freiburg: Inhibidor específico de la fosfodiesterasa 4 (PDE 4) para uso en el tratamiento profiláctico o terapéutico de la dislipoproteinemia, en donde el inhibidor […]
Nuevos usos terapéuticos de derivados de la bencilidenguanidina para el tratamiento de proteopatías, del 20 de Mayo de 2020, de InFlectis BioScience: Compuesto de la fórmula (I), o una sal farmacéuticamente aceptable del mismo, **(Ver fórmula)** o un tautómero de los mismos donde: […]