PRODUCCION DE CELULAS TTCR GAMMA DELTA.
Procedimiento para expandir las células T TcR?d+ en una muestra de partida,
que comprende:
(1)cultivar las células en la muestra de partida en un primer medio de cultivo que comprende un mitógeno de células T, interleuquina-2 e interleuquina-7, y
(2)cultivar las células obtenidas en la etapa (1) en un segundo medio de cultivo que comprende interleuquina-2 e interleuquina-7 para expandir las células T TcR?d+
Tipo: Patente Internacional (Tratado de Cooperación de Patentes). Resumen de patente/invención. Número de Solicitud: PCT/CA01/00444.
Solicitante: HEMOSOL INC..
Nacionalidad solicitante: Canadá.
Dirección: 2585 MEADOWPINE BLVD.,MISSISSAUGA ONTARIO L5N 8H9.
Inventor/es: BELL,DAVID,N, SKEA,DANNA,L.
Fecha de Publicación: .
Fecha Concesión Europea: 18 de Noviembre de 2009.
Clasificación Internacional de Patentes:
- C12N5/06B11C
Clasificación PCT:
- A61K31/00 NECESIDADES CORRIENTES DE LA VIDA. › A61 CIENCIAS MEDICAS O VETERINARIAS; HIGIENE. › A61K PREPARACIONES DE USO MEDICO, DENTAL O PARA EL ASEO (dispositivos o métodos especialmente concebidos para conferir a los productos farmacéuticos una forma física o de administración particular A61J 3/00; aspectos químicos o utilización de substancias químicas para, la desodorización del aire, la desinfección o la esterilización, vendas, apósitos, almohadillas absorbentes o de los artículos para su realización A61L; composiciones a base de jabón C11D). › Preparaciones medicinales que contienen ingredientes orgánicos activos.
- A61K35/00 A61K […] › Preparaciones medicinales que contienen sustancias de constitución indeterminada o sus productos de reacción.
- A61K35/14 A61K […] › A61K 35/00 Preparaciones medicinales que contienen sustancias de constitución indeterminada o sus productos de reacción. › Sangre; Sangre artificial (perfluorocarbonos A61K 31/02; sangre del cordón umbilical A61K 35/51; hemoglobina A61K 38/42).
- C07K14/42 QUIMICA; METALURGIA. › C07 QUIMICA ORGANICA. › C07K PEPTIDOS (péptidos que contienen β -anillos lactamas C07D; ipéptidos cíclicos que no tienen en su molécula ningún otro enlace peptídico más que los que forman su ciclo, p. ej. piperazina diones-2,5, C07D; alcaloides del cornezuelo del centeno de tipo péptido cíclico C07D 519/02; proteínas monocelulares, enzimas C12N; procedimientos de obtención de péptidos por ingeniería genética C12N 15/00). › C07K 14/00 Péptidos con más de 20 aminoácidos; Gastrinas; Somatostatinas; Melanotropinas; Sus derivados. › Lectinas, p. ej. concanavalina, fitohemaglutinina.
- C07K14/52 C07K 14/00 […] › Citoquinas; Linfoquinas; Interferones.
- C07K16/00 C07K […] › Inmunoglobulinas, p. ej. anticuerpos mono o policlonales.
- C12N1/38 C […] › C12 BIOQUIMICA; CERVEZA; BEBIDAS ALCOHOLICAS; VINO; VINAGRE; MICROBIOLOGIA; ENZIMOLOGIA; TECNICAS DE MUTACION O DE GENETICA. › C12N MICROORGANISMOS O ENZIMAS; COMPOSICIONES QUE LOS CONTIENEN; PROPAGACION, CULTIVO O CONSERVACION DE MICROORGANISMOS; TECNICAS DE MUTACION O DE INGENIERIA GENETICA; MEDIOS DE CULTIVO (medios para ensayos microbiológicos C12Q 1/00). › C12N 1/00 Microorganismos, p.ej. protozoos; Composiciones que los contienen (preparaciones de uso médico que contienen material de protozoos, bacterias o virus A61K 35/66, de algas A61K 36/02, de hongos A61K 36/06; preparación de composiciones de uso médico que contienen antígenos o anticuerpos bacterianos, p. ej. vacunas bacterianas, A61K 39/00 ); Procesos de cultivo o conservación de microorganismos, o de composiciones que los contienen; Procesos de preparación o aislamiento de una composición que contiene un microorganismo; Sus medios de cultivo. › Estimulación química del crecimiento o de la actividad por adición de compuestos químicos que no son factores esenciales de crecimiento; Estimulación del crecimiento por eliminación de un compuesto químico (C12N 1/34 tiene prioridad).
- C12N5/06
Clasificación antigua:
- A61K31/00 A61K […] › Preparaciones medicinales que contienen ingredientes orgánicos activos.
- A61K35/00 A61K […] › Preparaciones medicinales que contienen sustancias de constitución indeterminada o sus productos de reacción.
- A61K35/14 A61K 35/00 […] › Sangre; Sangre artificial (perfluorocarbonos A61K 31/02; sangre del cordón umbilical A61K 35/51; hemoglobina A61K 38/42).
- C07K14/42 C07K 14/00 […] › Lectinas, p. ej. concanavalina, fitohemaglutinina.
- C07K14/52 C07K 14/00 […] › Citoquinas; Linfoquinas; Interferones.
- C07K16/00 C07K […] › Inmunoglobulinas, p. ej. anticuerpos mono o policlonales.
- C12N1/38 C12N 1/00 […] › Estimulación química del crecimiento o de la actividad por adición de compuestos químicos que no son factores esenciales de crecimiento; Estimulación del crecimiento por eliminación de un compuesto químico (C12N 1/34 tiene prioridad).
- C12N5/06
Fragmento de la descripción:
Producción de células T TcR?d.
La presente invención se refiere a procedimientos nuevos y mejorados para la expansión ex vivo de células T TcR?d+.
Las células T TcR?d+ son un subconjunto pequeño de linfocitos T circulantes que son diferentes de las células T TcRaß+ convencionales, que reconocen, con una especificidad fina, los péptidos antígenos foráneos en el contexto de los elementos de restricción del complejo clásico de histocompatibilidad mayor (MHC) de clase I o II. En contraste, las células T TcR?d+ pueden reconocer antígenos tanto peptídicos como no peptídicos que pueden derivarse a partir de microorganismos foráneos o de productos celulares endógenos inducidos por estrés, tal como una infección o transformación vírica. Además, al contrario que el reconocimiento de antígeno por parte de las células TcRaß+, el reconocimiento de antígeno por parte de las células T TcR?d+ no se encuentra restringido al MHC.
Los receptores de células T de las células TcRaß+ y TcR?d+ se diferencian a partir de los diferentes elementos genéticos que los codifican. La mayoría de células T TcR?d+ se clasifican en dos subconjuntos principales: Vd1+ y Vd2+ basándose en los genes que codifican su cadena d. El subconjunto mayor de las células T TcR?d+ en la sangre periférica humana expresa Vd2 en combinación con V?9, mientras que la mayor parte del resto expresa Vd1 en combinación con V?2, V?3, V?4, V?5 o V?8 (Salerno A. y Dieli F., 1998).
Debido a que las células T TcR?d+ no presentan las características de especificidad fina de las células T TcRaß+, se ha propuesto que representan un mecanismo inmunológico más primitivo que proporciona una función de vigilancia de primera línea contra la infección y los tumores (Boismenu R. et al., 1997). Varios estudios han documentado la respuesta de las células T TcR?d+ frente a diversos virus, bacterias y parásitos (Bukowski J.F. et al., 1994; Wallace M. et al., 1994; Lang F. et al. 1995; Elloso M.M. et al., 1996), así como su capacidad de mediar en la lisis de células tumorales de diversos orígenes (Zocchi M.R. et al., 1990; Kitayama J. et al., 1993; Choudhary A. et al., 1995). Los tumores hematopoyéticos podrían ser particularmente susceptibles a los efectos líticos de las células T TcR?d+ debido a que los ratones transgénicos que expresan el transgén V?1.1 muestran una resistencia espontánea a leucemias de células T inyectadas y los hibridomas de células T TcR?d+ derivados de estos ratones responden preferentemente a células malignas hematopoyéticas y no a células tumorales no hematopoyéticas (Penninger J. et al., 1995). Además, los clones humanos de células T TcR?d+ derivadas de sangre periférica y de médula ósea del paciente se ha demostrado que lisan células leucémicas autólogas en la leucemia linfoblástica aguda y en la leucemia mieloide aguda, respectivamente (Bensussan A. et al., 1989; Jahn B. et al., 1995). Además, se ha demostrado la asociación entre una mayor supervivencia libre de enfermedad en pacientes de leucemia tras el trasplante de médula ósea alogénica y un incremento del número y porcentaje de células T TcR?d+ en sangre periférica (Lamb L.S. et al., 1996). Conjuntamente, estos resultados sugieren que las células T TcR?d+ podrían presentar un potencial terapéutico en el tratamiento del cáncer y de las enfermedades infecciosas.
Muchos de los procedimientos publicados que describen la expansión ex vivo de las células T TcR?d+ requieren la presencia de antígeno. Las células o líneas celulares infectadas o transformadas por virus, las bacterias y los parásitos se ha demostrado que estimulan la expansión de las células T TcR?d+ ex vivo, al igual que las líneas celulares tumorales establecidas. Por ejemplo, se utilizaron células infectadas por virus herpes simplex (HSV) para estimular la expansión de las células Vd2+ (Bukowski J.F. et al., 1994), mientras que las líneas celulares B-linfoblastoides transformadas por virus de Epstein Barr (EBV) se utilizaron para estimular la expansión de las células Vd1+ (Orsini D.L.M. et al., 1993). Se ha demostrado que los extractos de Mycobacterium tuberculosis y antígenos palúdicos de Plasmodium falciparum en estadio sanguíneo estimulan la proliferación de las células T TcR?d+ (Constant P. et al., 1994; Elloso M.M. et al., 1996). Daudi, una línea celular humana inmortalizada de linfoma de Burkitt, también puede estimular la proliferación de las células T TcR?d+ (Kaur I. et al., 1993). Además, se ha demostrado que algunos antígenos no peptidilo de la familia del fosfato de prenilo bien caracterizados, por ejemplo el pirofosfato de isopentenilo, estimulan la expansión ex vivo de las células T TcR?d+ (García V.E. et al., 1998). En algunos de estos sistemas, los cultivos de células T TcR?d+ estimulados por antígenos se suplementaron con citoquinas.
Las células T TcR?d+ también han sido expandidos ex vivo a partir de poblaciones de linfocitos infiltrantes de tumor (TIL) mediante cultivo con IL-2 (Zocchi M.R. et al., 1990) o con IL-2 en combinación con anticuerpo anti-CD3 inmovilizado (Kitayama J. et al., 1993) o anticuerpo anti-TcR?d+ (Yu S. et al., 1999). En estos sistemas, la estimulación selectiva de las células T TcR?d+ por los antígenos tumorales se supone que se ha producido in vivo previamente al aislamiento de las células T del tejido canceroso.
En otro sistema, se expandieron células T TcR?d+ procedentes de sangre periférica de pacientes de glioblastoma utilizando un anticuerpo anti-CD3 inmovilizado en fase sólida, en combinación con IL-2, seguido de cultivo en IL-2 solo (Yamaguchi T. et al., 1997). Estos autores informaron de que las células T TcR?d+ posteriormente purificadas no proliferaban durante más de una semana en presencia de IL-2 solo y, por lo tanto concluyeron que este procedimiento resultaría aplicable únicamente a estudios de corto plazo. Además mostraron que el procedimiento producía en la expansión y el enriquecimiento de células T tanto TcR?d+ como TcRaß+, consiguiendo purezas de las células T TcR?d+ del orden de 28%. En un informe posterior, los mismos autores demostraron que dicho procedimiento expandía selectivamente el subconjunto Vd2+ (Suzuki Y. et al., 1999). En otro informe, dicho grupo mostró que las células T TcR?d+ expandidas en cultivo utilizando anti-CD3 e IL-2 seguido de IL-2 solo y que se purificaron posteriormente a partir de la población expandida proliferaron mejor al añadir IL-15, según un ensayo de incorporación de 3H-timidina (Yamaguchi et al., 1998).
De esta manera, existen limitaciones a la proliferación celular y/o requisitos para la estimulación antigénica en los procedimientos existentes para el cultivo ex vivo y la expansión de las células T TcR?d+. A partir de lo expuesto anteriormente, existe una necesidad en la técnica de un procedimiento para cultivar selectivamente in vitro grandes cantidades de células TcR?d+ esencialmente puras.
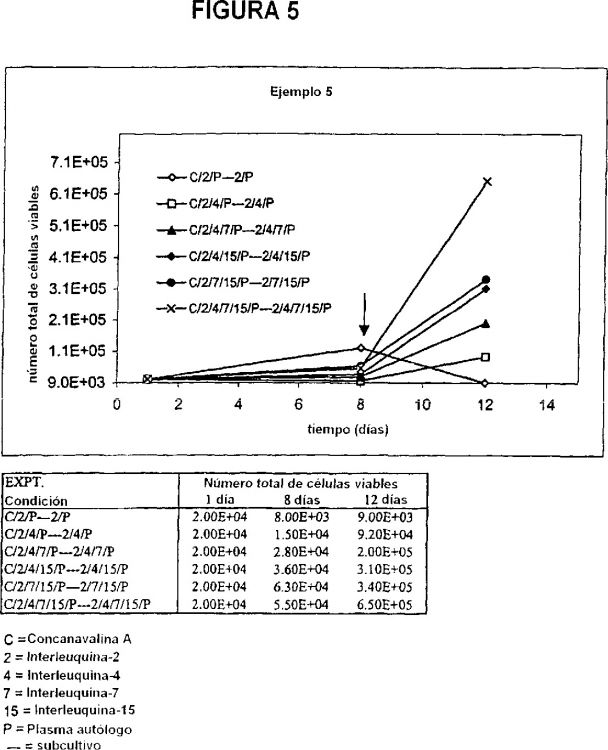
La presente invención proporciona nuevos procedimientos para expandir células T TcR?d+ en cultivo en ausencia de antígeno exógeno. En particular, los inventores han demostrado que las células T TcR?d+ pueden expandirse mediante el cultivo de las células en un primer medio que contiene un mitógeno de células T, interleuquina-2 e interleuquina-7, y después subcultivando las células en un segundo medio de cultivo que contiene interleuquina-2 e interleuquina-7 en ausencia del mitógeno. De acuerdo con lo expuesto anteriormente, la presente invención proporciona un procedimiento para expandir células T TcR?d+ en una muestra de partida, que comprende:
Reivindicaciones:
1. Procedimiento para expandir las células T TcR?d+ en una muestra de partida, que comprende:
2. Procedimiento según la reivindicación 1, que comprende además enriquecer las células en la muestra de partida en células T previamente a la etapa (1).
3. Procedimiento según cualquiera de las reivindicaciones 1 a 2, que comprende además enriquecer las células en la muestra de partida en células T TcR?d+ previamente a la etapa (1).
4. Procedimiento según cualquiera de las reivindicaciones 1 a 3, que comprende además empobrecer las células en la muestra de partida de células CD14+, CD16+, CD19+, CD33+, CD56+ y glicoforina-A+ previamente a la etapa (1).
5. Procedimiento según cualquiera de las reivindicaciones 1 a 4, que comprende además empobrecer las células en la muestra de partida de células T TcRaß+ previamente a la etapa (1).
6. Procedimiento según cualquiera de las reivindicaciones 1 a 5, que comprende además empobrecer las células en la muestra de partida de células T no TcR?d+ previamente a la etapa (1).
7. Procedimiento según cualquiera de las reivindicaciones 1 a 6, en el que la muestra de partida es sangre o tejido o fracciones de los mismos.
8. Procedimiento según la reivindicación 7, en el que la muestra de partida se selecciona de entre sangre periférica, sangre de cordón umbilical, médula ósea, tejido linfoide, epitelio, timo, hígado, bazo, tejido canceroso, tejido infectado, tejido de nódulo linfático o fracciones de los mismos.
9. Procedimiento según la reivindicación 7 u 8, en el que la muestra de partida es sangre periférica humana o una fracción de la misma.
10. Procedimiento según cualquiera de las reivindicaciones 1 a 9, en el que la muestra de partida es de células mononucleares de baja densidad.
11. Procedimiento según cualquiera de las reivindicaciones 1 a 10, en el que en el primer medio de cultivo el mitógeno de células T se encuentra presente en una cantidad de aproximadamente 0,01 a aproximadamente 100 µg/ml y en el que en los primer y segundo medios de cultivo la interleuquina-2 se encuentra presente en una cantidad comprendida de aproximadamente 0,1 a aproximadamente 1.000 ng/ml, y la interleuquina-7 se encuentra presente en una cantidad de aproximadamente 0,1 a aproximadamente 1.000 ng/ml.
12. Procedimiento según cualquiera de las reivindicaciones 1 a 10, en el que en el primer medio de cultivo el mitógeno de células T se encuentra presente en una cantidad de aproximadamente 0,1 a aproximadamente 50 µg/ml y en el que en los primer y segundo medios de cultivo la interleuquina-2 se encuentra presente en una cantidad de aproximadamente 1 a aproximadamente 100 ng/ml y la interleuquina-7 se encuentra presente en una cantidad de aproximadamente 1 a aproximadamente 100 ng/ml.
13. Procedimiento según cualquiera de las reivindicaciones 1 a 10, en el que en el primer medio de cultivo el mitógeno de células T se encuentra presente en una cantidad de aproximadamente 0,5 a aproximadamente 10 µg/ml y en el que en los primer y segundo medios de cultivo la interleuquina-2 se encuentra presente en una cantidad de aproximadamente 2 a aproximadamente 50 ng/ml y la interleuquina-7 se encuentra presente en una cantidad de aproximadamente 2 a aproximadamente 50 ng/ml.
14. Procedimiento según cualquiera de las reivindicaciones 1 a 13, en el que el primer medio de cultivo comprende 1 µg/ml de un mitógeno de células T y en el que en los primer y segundo medios de cultivo 10 ng/ml de interleuquina-2 y 10 ng/ml de interleuquina-7.
15. Procedimiento según cualquiera de las reivindicaciones 1 a 14, en el que dichos primer y segundo medios de cultivo comprenden además un factor de crecimiento adicional.
16. Procedimiento según la reivindicación 15, en el que dicho factor de crecimiento adicional es IL-4 o IL-15, o un mimético o equivalente funcional de los mismos.
17. Procedimiento según cualquiera de las reivindicaciones 1 a 14, en el que dichos primer y segundo medios de cultivo comprenden además dos factores de crecimiento adicionales.
18. Procedimiento según la reivindicación 17, en el que dichos dos factores de crecimiento adicionales son IL-4 e IL-15, o un mimético o equivalente funcional de los mismos.
19. Procedimiento según cualquiera de las reivindicaciones 1 a 18, en el que el mitógeno de células T es una lectina vegetal.
20. Procedimiento según la reivindicación 19, en el que la lectina vegetal es la concanavalina A.
21. Procedimiento según cualquiera de las reivindicaciones 1 a 18, en el que el mitógeno de células T es un anticuerpo o un fragmento del mismo.
22. Procedimiento según la reivindicación 21, en el que el anticuerpo se une a CD3 o a un fragmento del mismo.
23. Procedimiento según cualquiera de las reivindicaciones 1 a 22, en el que los primer y segundo medios de cultivo contienen además suero o plasma.
24. Procedimiento según la reivindicación 23, en el que el suero o el plasma se encuentran presentes en una cantidad de aproximadamente 1 a aproximadamente 25% en volumen.
25. Procedimiento según la reivindicación 23, en el que el suero o el plasma se encuentra presente en una cantidad de aproximadamente 2 a aproximadamente 20% en volumen.
26. Procedimiento según la reivindicación 23, en el que el suero o el plasma se encuentra presente en una cantidad de aproximadamente 2,5 a aproximadamente 10% en volumen.
27. Procedimiento según la reivindicación 23, en el que el suero o el plasma se encuentra presente en una cantidad de aproximadamente 5% en volumen.
Patentes similares o relacionadas:
OBTENCIÓN DE CÉLULAS TR1 ESPECÍFICAS DE ANTÍGENOS DE LOS ALIMENTOS O DE AUTOANTÍGENOS A PARTIR DE UNA POBLACIÓN DE LEUCOCITOS O PBMC, del 14 de Noviembre de 2011, de TXCELL S.A. INSTITUT NATIONAL DE LA SANTÉ ET DE LA RECHERCHE MÉDICALE (INSERM): Un método in vitro para la obtención de una población de células Tr1 específicas de antígenos de alimentos o autoantígenos proveniente de una población de leucocitos o de […]
UTILIZACIÓN DE LA PROTEÍNA GILZ PARA MODULAR LA RESPUESTA INMUNOESPECÍFICA DE UN ANTÍGENO, del 13 de Julio de 2011, de ASSISTANCE PUBLIQUE, HOPITAUX DE PARIS: Utilización de al menos: a) una proteína GILZ o un vector recombinante de expresión de la dicha proteína, aislados o expresados en células dendríticas […]
PROCESO PARA PRODUCIR LINFOCITOS CITOTÓXICOS, del 13 de Abril de 2011, de TAKARA BIO INC.: Un método para preparar un linfocito citotóxico o una preparación de linfocitos citotóxicos en donde dicho método comprende el paso de llevar a cabo al menos uno de inducción, […]
 MÉTODO Y KIT PARA EL AISLAMIENTO RÁPIDO DE CÉLULAS Foxp3+Treg HUMANAS, del 29 de Marzo de 2011, de MAX-DELBRÜCK-CENTRUM FÜR MOLEKULARE MEDIZIN (MDC): Un método para aislar células T reguladoras Foxp3+ CD25+ humanas (células Foxp3+ Treg) a partir de una muestra que contiene células mononucleares de sangre periférica (PBMC), […]
MÉTODO Y KIT PARA EL AISLAMIENTO RÁPIDO DE CÉLULAS Foxp3+Treg HUMANAS, del 29 de Marzo de 2011, de MAX-DELBRÜCK-CENTRUM FÜR MOLEKULARE MEDIZIN (MDC): Un método para aislar células T reguladoras Foxp3+ CD25+ humanas (células Foxp3+ Treg) a partir de una muestra que contiene células mononucleares de sangre periférica (PBMC), […]
ACTIVACIÓN Y EXPANSIÓN DE CÉLULAS T, del 10 de Marzo de 2011, de LIFE TECHNOLOGIES CORPORATION: Un método in vitro para expandir selectivamente una población de células T CD8 + de memoria, que comprende: poner en contacto una población de células en la […]
SOBRENADANTE PROCEDENTE DE CÉLULAS MADRE MESENQUIMÁTICAS PARA LA PREVENCIÓN Y EL TRATAMIENTO DE RESPUESTAS INMUNITARIAS EN TRASPLANTES, del 1 de Febrero de 2011, de OSIRIS THERAPEUTICS, INC.: Utilización de un sobrenadante procedente de un cultivo de células madre mesenquimáticas para la preparación de un medicamento destinado a reducir una respuesta […]
PEPTIDO CON CAPACIDAD PARA UNIRSE A ESCURFINA Y APLICACIONES, del 6 de Julio de 2010, de PROYECTO DE BIOMEDICINA CIMA, S.L.: Péptidos de fórmula general (I), donde X está ausente, o bien, X está presente y es X14 o X14-X15, donde X14 y X15, independientemente entre sí, representan un aminoácido; […]
Uso de inhibidores de la PDE4 para la profilaxis y/o la terapia de la dislipoproteinemia y trastornos relacionados, del 27 de Mayo de 2020, de Albert-Ludwigs-Universität Freiburg: Inhibidor específico de la fosfodiesterasa 4 (PDE 4) para uso en el tratamiento profiláctico o terapéutico de la dislipoproteinemia, en donde el inhibidor […]