NUEVOS DERIVADOS DE 4,8-DIFENILPOLIAZANAFTALENO.
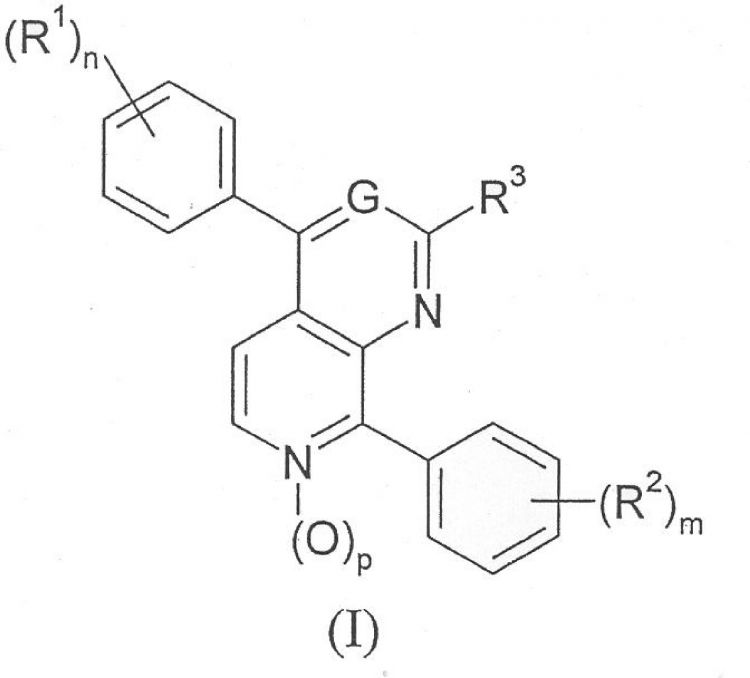
Nuevos derivados de 4,8-difenilpoliazanaftaleno inhibidores de proteína quinasa activada por mitógeno p38 que tienen la fórmula general (I)
**(Figura)**
procedimientos para su preparación,
composiciones farmacéuticas que los comprenden y su uso en terapia
Tipo: Patente de Invención. Resumen de patente/invención. Número de Solicitud: P200701132.
Solicitante: LABORATORIOS ALMIRALL, S.A..
Nacionalidad solicitante: España.
Provincia: BARCELONA.
Inventor/es: LUMERAS AMADOR,WENCESLAO, EASTWOOD, PAUL, ROBERT.
Fecha de Solicitud: 26 de Abril de 2007.
Fecha de Publicación: .
Fecha de Concesión: 10 de Septiembre de 2010.
Clasificación Internacional de Patentes:
- A61K31/4375 NECESIDADES CORRIENTES DE LA VIDA. › A61 CIENCIAS MEDICAS O VETERINARIAS; HIGIENE. › A61K PREPARACIONES DE USO MEDICO, DENTAL O PARA EL ASEO (dispositivos o métodos especialmente concebidos para conferir a los productos farmacéuticos una forma física o de administración particular A61J 3/00; aspectos químicos o utilización de substancias químicas para, la desodorización del aire, la desinfección o la esterilización, vendas, apósitos, almohadillas absorbentes o de los artículos para su realización A61L; composiciones a base de jabón C11D). › A61K 31/00 Preparaciones medicinales que contienen ingredientes orgánicos activos. › conteniendo el sistema heterocíclico un ciclo de seis eslabones teniendo el nitrógeno como heteroátomo del ciclo, p. ej. quinolicinas, naftiridinas, berberina, vincamina.
- A61K31/519 A61K 31/00 […] › condensadas en orto o en peri con heterociclos.
- C07D471/04 QUIMICA; METALURGIA. › C07 QUIMICA ORGANICA. › C07D COMPUESTOS HETEROCICLICOS (Compuestos macromoleculares C08). › C07D 471/00 Compuestos heterocíclicos que contienen átomos de nitrógeno como únicos heteroátomos del sistema condensado, teniendo al menos un ciclo de seis miembros con un átomo de nitrógeno, no previstos en los grupos C07D 451/00 - C07D 463/00. › Sistemas condensados en orto.
Clasificación PCT:
- A61K31/4375 A61K 31/00 […] › conteniendo el sistema heterocíclico un ciclo de seis eslabones teniendo el nitrógeno como heteroátomo del ciclo, p. ej. quinolicinas, naftiridinas, berberina, vincamina.
- A61K31/519 A61K 31/00 […] › condensadas en orto o en peri con heterociclos.
- C07D471/04 C07D 471/00 […] › Sistemas condensados en orto.
Fragmento de la descripción:
Nuevos derivados de 4,8-difenilpoliazanaftaleno.
La presente invención se refiere a nuevos inhibidores de la proteína quinasa activada por mitógeno p38.
Las MAP quinasas son enzimas conservadas evolutivamente que traducen señales de membrana a respuestas de expresión génica. En mamíferos, pueden distinguirse cuatro familias de MAPK: quinasas relacionadas con señal extracelular (ERK1/2), quinasas aminoterminales Jun (JNK1/2/3), proteínas p38 (alfa, beta, gamma y delta) y ERK5. La regulación de estas proteínas se ejerce mediante una cascada de tres niveles compuesta por MAPK, MAPK quinasa y MAPK quinasa quinasa.
La MAPK p38 se identificó originalmente como la diana de CSAIDs (fármacos antiinflamatorios supresores de citoquina), que tiene un papel central en la ruta de transducción de señal que conduce a la producción de TNF-alfa y otras citoquinas (Lee et al, 1984). La p38 se activa mediante la fosforilación en Thr y Tyr mediante MKK3, MKK4 o MKK6 (Kyriakis y Avruch, 2001) en respuesta a estrés y estímulos proinflamatorios. A su vez, la p38 fosforila sus efectores en los restos de Ser y Thr, a saber, proteína quinasas fosfatasas y factores de transcripción tales como ATF-2, MEF2, MAPKAPK2, MSK1/2 o MNK1/2. En conjunto, esta cascada de activación da como resultado el control de la expresión génica mediante cuatro mecanismos diferentes: la activación del factor de transcripción; la estabilización de ARNm, la traducción de ARNm y la fosforilación de histona en sitios de unión NF-kB en cromatina (Shi y Gaestel, 2002; Sacanni et al, 2001).
Existen cuatro isoformas diferentes de p38 codificadas por genes separados: p38 alfa, beta, gamma y delta, mostrando cada uno un patrón de expresión de tejido distinto. Como se evalúa mediante los niveles de ARNm y proteína (Beardmore et al, 2005; Wang et al, 1997), las p38 alfa y beta se expresan ubícuamente, siendo más relevante la expresión de p38 beta en tejidos del SNC (cerebro, corteza, cerebelo, hipocampo, etc). La expresión de p38 gamma es más destacada en el músculo esquelético, mientras que p38 delta se localiza principalmente en corazón, riñón, pulmón y glándula suprarrenal. A nivel celular, p38 alfa y delta parecen ser las isoformas más relevantes en células inmunes (monocitos, macrófagos, neutrófilos y células T) (Hale et al, 1999). La inhibición farmacológica con inhibidores específicos de p38 alfa/beta, así como estudios de reconocimiento génico, han indicado que la p38 alfa es la isoforma que regula las respuestas inflamatorias, lo más probablemente mediante su sustrato MAPKAP-K2 (Kotlyarov et al, 1999). Igualmente, esta isoforma es necesaria en el desarrollo embriónico temprano, ya que los ratones con deficiencia genética de p38 alfa (ratones KO) mueren el día embriónico 12,5 debido a insuficiencia placentaria y defectos vasculares (Allen et al, 2000; Tamura et al, 2000; Adams et al, 2000), un fenotipo que se reproduce también en los ratones con deficiencia genética doble de MKK3/MKK6 (Brancho et al, 2003). En contraposición, los ratones con deficiencia genética de p38 beta, gamma y delta no muestran ninguna deficiencia de desarrollo (Beardmore et al 2005; Sabio et al, 2005). Los ratones KO de p38 parecen responder de forma similar a estímulos proinflamatorios (LPS) que los controles de tipo silvestre, indicando que esta isoforma no tiene un papel en la inflamación (Beardmore et al 2005).
La contribución de la ruta de la MAPK p38 a la inflamación se ha estudiado tanto in vitro como in vivo empleando diferentes series químicas de inhibidores de p38 (Pargellis y Regan, 2003; Kumar et al, 2003). La molécula inhibidora más ampliamente utilizada, SB203580, es de hecho un inhibidor dual de p38 alfa/beta. La inhibición de p38 anula la liberación de TNF-alfa, así como otras citoquinas proinflamatorias tales como IL-1, IL-6 e IL-8, en PBMC, sangre completa o la línea celular monocítica humana THP-1.
En virtud de la implicación de p38 en la producción de TNF-alfa, se han ensayado inhibidores de p38 en modelos animales de enfermedades en los que la TNF-alfa tiene un papel patofisiológico. La inhibición de p38 reduce la artritis inducida por colágeno en murina y la gravedad de la artritis inducida por coadyuvante en rata (Pargellis y Regan, 2003). Además, los inhibidores de p38 mejoran también la resorción ósea en modelos animales de artritis, probablemente debido a la implicación de la MAPK p38 en la diferenciación de osteoclastos. La inhibición de p38 atenúa la respuesta inflamatoria en un modelo de murina de enfermedad de Crohn y reduce la producción de TNF-alfa en biopsias de pacientes humanos con enfermedad de Crohn (Hollenbach et al 2005; Waetzig et al, 2002). Debido al uso exclusivo de la ruta de p38 por neutrófilos, la p38 se ha considerado también una diana para la enfermedad pulmonar obstructiva crónica (EPOC) (Nick et al, 2002). La inhibición de p38 reduce la neutrofilia, las citoquinas inflamatorias, la MMP-9 y la fibrosis en pulmón (Underwood et al, 2000). En modelos cutáneos de irradiación, la inhibición de p38 protege la epidermis frente a la exposición aguda a radiación ultravioleta bloqueando la apoptosis y respuestas inflamatorias (Hildesheim et al, 2004). La inhibición de p38 revierte también los defectos hematopoyéticos en médula ósea de pacientes con síndromes mielodisplásticos, en los que la sobreproducción de TNF-alfa tiene un papel patofisiológico (Katsoulidis et al, 2005).
En malignidades hematopoyéticas, un estudio ha mostrado que los inhibidores de p38 pueden bloquear la proliferación de células de mieloma múltiple inhibiendo la producción de IL-6 y VEGF en células de estroma de médula ósea (Hideshima et al, 2002).
La p38 está implicada en mecanismos celulares clave tales como apoptosis, fibrosis e hipertrofia celular, que son comunes en patologías cardiacas y vasculares. La inhibición farmacológica de p38 se ha probado ser útil para mejorar la lesión por isquemia-reperfusión, isquemia focal cerebral, síndrome coronario agudo, insuficiencia cardiaca crónica y remodelación post-infarto de miocardio (See et al, 2004).
La inhibición experimental de p38 se ha reseñado eficaz para reducir el dolor en modelos animales de neuropatía que se basan en la expresión de COX-2 y la producción de TNF-alfa por células gliales (Schafers et al, 2003; Jin et al, 2003; Tsuda et al, 2004).
Por lo tanto, los compuestos de la invención pueden ser útiles en la profilaxis o el tratamiento de cualquier enfermedad o trastorno en el que la quinasa p38 desempeñe un papel, incluyendo afecciones causadas por una producción excesiva o no regulada de citoquina proinflamatoria incluyendo, por ejemplo, producción excesiva o no regulada de TNF, IL-1, IL-6 e IL-8 en un ser humano u otro mamífero. La invención se extiende a dicho uso y al uso de los compuestos para la fabricación de un medicamento para tratar dichas enfermedades o trastornos mediados por citoquina. Además, la invención se extiende a la administración a un ser humano de una cantidad eficaz de un inhibidor de p38 para tratar dicha enfermedad o trastorno.
Las enfermedades o trastornos en los que la quinasa p38 desempeña un papel directamente o mediante citoquinas proinflamatorias, incluyendo las citoquinas TNF, IL-1, IL-6 e IL-8, incluyen sin limitación enfermedades autoinmunes, enfermedades inmunes e inflamatorias, trastornos destructivos óseos, trastornos neoplásicos, trastornos neurodegenerativos, enfermedades víricas, enfermedades infecciosas, enfermedades cardiovasculares, trastornos relacionados con la angiogénesis y trastornos relacionados con el dolor.
Las enfermedades autoinmunes que pueden prevenirse o tratarse incluyen, pero sin limitación, psoriasis, artritis reumatoide, artritis psoriásica, espondilitis anquilosante, síndrome de Reiter, fibromialgia, enfermedad intestinal inflamatoria tal como colitis ulcerosa y enfermedad de Crohn, esclerosis múltiple, diabetes, glomerulonefritis, lupus sistémico eritematoso, escleroderma, tiroiditis crónica, enfermedad de Grave, anemia hemolítica, gastritis autoinmune, neutropenia autoinmune, trombocitopenia, hepatitis activa crónica autoinmune, miastenia grave o enfermedad de Addison.
Las enfermedades inmunes e inflamatorias que pueden prevenirse o tratarse incluyen, pero sin limitación, asma, EPOC, síndrome de dificultad respiratoria, pancreatitis aguda o crónica, enfermedad de injerto contra huésped, síndrome de Behcet,...
Reivindicaciones:
1. Un compuesto de fórmula (I)
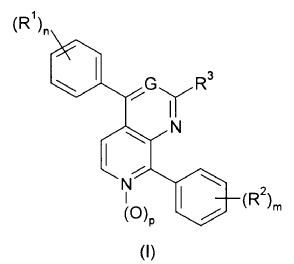
en la que:
G representa un átomo de nitrógeno o un grupo
R1 representa un átomo de halógeno, un grupo alquilo C1-4 opcionalmente sustituido con uno, dos o tres átomos de halógeno, o un grupo alcoxi C1-4,
R2 representa un átomo de halógeno o un grupo seleccionado de hidroxi, alquilo C1-4, alcoxi C1-4, alquiltio C1-4, alcoxi C1-4
R3 se selecciona de los grupos constituidos por un átomo de hidrógeno, un grupo hidroxi, grupos
R4 y R5 se seleccionan independientemente del grupo constituido por átomo de hidrógeno y un grupo alquilo C1-4,
n es un número entero de 0 a 4,
m es un número entero de 0 a 4,
p tiene el valor de 0 ó 1,
q es un número entero de 1-4,.
y sus sales farmacéuticamente aceptables.
Con la condición de que, cuando G es un grupo =CH-, R3 no puede ser un átomo de hidrógeno.
2. Un compuesto según la reivindicación 1, en el que p tiene el valor de 1.
3. Un compuesto según una cualquiera de las reivindicaciones 1 ó 2, en el que n es 1 ó 2 y cada R1 representa independientemente un átomo de halógeno o un grupo alquilo C1-4.
4. Un compuesto según la reivindicación 3, en el que al menos un grupo R1 está en posición orto con respecto al átomo de carbono mediante el que se une el grupo fenilo al núcleo de naftiridina o pirido[3,4-d]pirimidina.
5. Un compuesto según la reivindicación 4, en el que R1 es un átomo de halógeno.
6. Un compuesto según la reivindicación 5, en el que R1 se selecciona de átomos de cloro o flúor.
7. Un compuesto según cualquier reivindicación precedente, en el que m es 1 ó 2 y cada R2 representa independientemente un átomo de halógeno o un grupo alquilo C1-4.
8. Un compuesto según la reivindicación 7, en el que al menos un grupo R2 está en posición orto con respecto al átomo de carbono mediante el que el grupo fenilo se une al núcleo de naftiridina o pirido[3,4-d]pirimidina.
9. Un compuesto según la reivindicación 8, en el que m es 2 y los dos grupos R2 están en posición orto con respecto al átomo de carbono mediante el que el grupo fenilo se une al núcleo de naftiridina o pirido[3,4-d]pirimidina.
10. Un compuesto según la reivindicación 9, en el que ambos grupos R2 son átomos de halógeno.
11. Un compuesto según la reivindicación 10, en el que ambos grupos R2 son idénticos y se seleccionan de átomos de cloro o flúor.
12. Un compuesto según cualquier reivindicación precedente, en el que R3 se selecciona del grupo constituido por átomos de hidrógeno y grupos hidroxi, -NR4R5, -NH-(CH2)q-NR4R5 y NHS(O)2R4, en los que R4 y R5 representan independientemente un átomo de hidrógeno o un grupo metilo y q tiene un valor de 2 a 4.
13. Un compuesto según la reivindicación 12, en el que R3 se selecciona del grupo constituido por
14. Un compuesto según la reivindicación 13, en el que R3 representa un grupo
15. Un compuesto según la reivindicación 1, que es uno de:
4-(2,4-difluorofenil)-8-(2,6-difluorofenil)-1,7-naftiridin-2-amina,
7-óxido de 4-(2,4-difluorofenil)-8-(2,6-difluorofenil)-1,7-naftiridin-2-amina,
4-(2,4-difluorofenil)-8-(2-metilfenil)-1,7-naftiridin-2(1H)-ona,
7-óxido de 4-(2,4-difluorofenil)-8-(2-metilfenil)-1,7-naftiridin-2(1H)-ona,
4-(2-cloro-4-fluorofenil)-8-(2,6-difluorofenil)-1,7-naftiridin-2(1H)-ona,
7-óxido de 4-(2-cloro-4-fluorofenil)-8-(2,6-difluorofenil)-1,7-naftiridin-2(1H)-ona,
N'-[4-(2-cloro-4-fluorofenil)-8-(2,6-difluorofenil)-1,7-naftiridin-2-il]-N,N-dimetiletano-1,2-diamina,
N'-[4-(2-cloro-4-fluorofenil)-8-(2,6-difluorofenil)-7-oxido-1,7-naftiridin-2-il]-N,N-dimetiletano-1,2-diamina,
4-(2-cloro-4-fluorofenil)-8-(2,6-diclorofenil)-1,7-naftiridin-2(1H)-ona,
7-óxido de 4-(2-cloro-4-fluorofenil)-8-(2,6-diclorofenil)-1,7-naftiridin-2(1H)-ona,
4-(2-cloro-4-fluorofenil)-8-(2,6-diclorofenil)-1,7-naftiridin-2-amina,
7-óxido de 4-(2-cloro-4-fluorofenil)-8-(2,6-diclorofenil)-1,7-naftiridin-2-amina,
4-(2-clorofenil)-8-(2,6-difluorofenil)-1,7-naftiridin-2(1H)-ona,
7-óxido de 4-(2-clorofenil)-8-(2,6-difluorofenil)-1,7-naftiridin-2(1H)-ona,
4-(2-clorofenil)-8-(2,6-diclorofenil)-1,7-naftiridin-2(1H)-ona,
7-óxido de 4-(2-clorofenil)-8-(2,6-diclorofenil)-1,7-naftiridin-2(1H)-ona,
7-óxido de 4-(2-clorofenil)-8-(2,6-diclorofenil)-N-metil-1,7-naftiridin-2-amina,
7-óxido de 4-(2-clorofenil)-8-(2,6-diclorofenil)-N,N-dimetil-1,7-naftiridin-2-amina,
N-[4-(2-clorofenil)-8-(2,6-diclorofenil)-7-oxido-1,7-naftiridin-2-il]metanosulfonamida,
7-óxido de 4-(2-clorofenil)-8-(2,6-diclorofenil)-1,7-naftiridin-2-amina,
7-óxido de 4-(2-clorofenil)-8-(2,6-diclorofenil)-1,7-naftiridin-2-carboxilato de metilo,
7-óxido del ácido 4-(2-clorofenil)-8-(2,6-diclorofenil)-1,7-naftiridin-2-carboxílico,
4-(2-cloro-4-fluorofenil)-8-(2,6-difluorofenil)pirido[3,4-d]pirimidina,
7-óxido de 4-(2-cloro-4-fluorofenil)-8-(2,6-difluorofenil)pirido[3,4-d]pirimidina,
4-(2-cloro-4-fluorofenil)-8-(2,6-difluorofenil)pirido[3,4-d]pirimidin-2-amina,
7-óxido de 4-(2-cloro-4-fluorofenil)-8-(2,6-difluorofenil)pirido[3,4-d]pirimidin-2-amina,
4-(2-cloro-4-fluorofenil)-8-(2,6-diclorofenil)pirido[3,4-d]pirimidina,
7-óxido de 4-(2-cloro-4-fluorofenil)-8-(2,6-diclorofenil)pirido[3,4-d]pirimidina,
4-(2-cloro-4-fluorofenil)-8-(2,6-diclorofenil)pirido[3,4-d]pirimidin-2-amina,
7-óxido de 4-(2-cloro-4-fluorofenil)-8-(2,6-diclorofenil)pirido[3,4-d]pirimidin-2-amina,
4-(2,4-difluorofenil)-8-(2,6-difluorofenil)pirido[3,4-d]pirimidin-2-amina,
7-óxido de 4-(2,4-difluorofenil)-8-(2,6-difluorofenil)pirido[3,4-d]pirimidin-2-amina.
16. Un compuesto según una cualquiera de las reivindicaciones 1 a 15 para uso en el tratamiento de una afección patológica o enfermedad susceptible de mejora mediante la inhibición de la proteína quinasa activada por mitógeno p38.
17. Una composición farmacéutica que comprende un compuesto como se define en una cualquiera de las reivindicaciones 1 a 15 en mezcla con un diluyente o vehículo farmacéuticamente aceptable.
18. Uso de un compuesto como se define en una cualquiera de las reivindicaciones 1 a 15 en la fabricación de un medicamento para el tratamiento de una afección patológica o enfermedad susceptible de mejora mediante la inhibición de la proteína quinasa activada por mitógeno p38.
19. Uso según la reivindicación 18, en el que la afección patológica o enfermedad es artritis reumatoide, lesión por isquemia-reperfusión, isquemia focal cerebral, síndrome coronario agudo, EPOC, enfermedad de Crohn, síndrome del intestino irritable, síndrome de dificultad respiratoria en el adulto, osteoporosis, enfermedad de Alzheimer, espondilitis reumatoide, psoriasis, aterosclerosis, osteoartritis o mieloma múltiple.
20. Un producto de combinación que comprende:
para uso simultáneo, separado o secuencial en el tratamiento de un cuerpo humano o animal.
Patentes similares o relacionadas:
Compuestos de heteroaril carboxamida como inhibidores de RIPK2, del 29 de Julio de 2020, de BOEHRINGER INGELHEIM INTERNATIONAL GMBH: Un compuesto de fórmula (I): **(Ver fórmula)** o sus sales farmacéuticamente aceptables, en la que: X es N y Y es CH; o X es CH y Y es N; […]
Compuestos de alquinilbenceno heterocíclicos, y composiciones médicas y usos de los mismos, del 29 de Julio de 2020, de Guangzhou Healthquest Pharma Co., Ltd: Un compuesto de alquinilbenceno heterocíclico que tiene la fórmula (I) y una sal farmacéuticamente aceptable, o estereoisómero del mismo, **(Ver […]
Derivados de piperidina 1,4 sustituidos, del 29 de Julio de 2020, de 89Bio Ltd: Un compuesto de acuerdo con la Fórmula I: **(Ver fórmula)** o una sal farmacéuticamente aceptable del mismo, en donde: A se selecciona de […]
Compuestos y procedimientos de uso, del 29 de Julio de 2020, de Medivation Technologies LLC: Un compuesto de fórmula (Aa-1): **(Ver fórmula)** o una sal farmacéuticamente aceptable del mismo, en la que: A representa H, halógeno, amino, […]
Formas sólidas de un compuesto modulador de quinasas, del 22 de Julio de 2020, de PLEXXIKON, INC: Una forma cristalina del Compuesto I: **(Ver fórmula)** que es la Forma C del Compuesto I caracterizado por un difractograma de rayos […]
Derivado heteroarilo o sal farmacéuticamente aceptable del mismo, método de preparación del mismo y composición farmacéutica para prevenir o tratar enfermedades asociadas con PI3 quinasas, que contiene el mismo como principio activo, del 22 de Julio de 2020, de KOREA RESEARCH INSTITUTE OF CHEMICAL TECHNOLOGY: Un compuesto representado por la fórmula 1, un isómero óptico del mismo o una sal farmacéuticamente aceptable del mismo: **(Ver fórmula)** en la fórmula […]
Procedimiento de preparación de la forma A de grapiprant, del 22 de Julio de 2020, de Aratana Therapeutics Inc: Un procedimiento de preparación de una Forma A cristalina sustancialmente pura de grapiprant, comprendiendo el procedimiento: i. poner en contacto grapiprant a temperatura […]
Ureas asimétricas p-sustituidas y usos médicos de las mismas, del 22 de Julio de 2020, de Helsinn Healthcare SA: Un compuesto de Fórmula I: **(Ver fórmula)** o una sal farmacéuticamente aceptable del mismo, en donde: una línea discontinua indica un enlace opcional; X es CH; […]