MICOFENOLATO SODICO CRISTALINO.
Forma de micofenolato sódico cristalino anhidro (forma M5) caracterizada porque presenta un patrón de XRD de polvo con picos en 9,
8, 17,4, 22,2, 27,1 y 31,7 ± 0,2 grados 2-theta
Tipo: Patente Internacional (Tratado de Cooperación de Patentes). Resumen de patente/invención. Número de Solicitud: PCT/US2005/025816.
Solicitante: TEVA GYOGYSZERGYAR RESZVENYTARSASAG
TEVA PHARMACEUTICALS USA, INC.
Nacionalidad solicitante: Hungría.
Dirección: PALLAGI 13,H-4042 DEBRECEN.
Inventor/es: SZABO, CSABA, ARONHIME, JUDITH, KOVACSNE-MEZEI,ADRIENNE, MOLNAR,SANDOR, TAMAS,TIVADAR, HAJKO,JANOS.
Fecha de Publicación: .
Clasificación Internacional de Patentes:
- C07D307/88 QUIMICA; METALURGIA. › C07 QUIMICA ORGANICA. › C07D COMPUESTOS HETEROCICLICOS (Compuestos macromoleculares C08). › C07D 307/00 Compuestos heterocíclicos que contienen ciclos de cinco miembros que tienen un átomo de oxígeno como único heteroátomo del ciclo. › con un átomo de oxígeno unido directamente en la posición 1 ó 3.
Clasificación PCT:
- C07D307/88 C07D 307/00 […] › con un átomo de oxígeno unido directamente en la posición 1 ó 3.
Fragmento de la descripción:
Micofenolato sódico cristalino.
Referencia cruzada a las solicitudes relacionadas
La presente solicitud reivindica los derechos de las solicitudes provisionales de patente US nº 60/589.909, presentada el 20 de julio de 2004, y nº 60/631.849, presentada el 29 de noviembre de 2004.
Campo de la invención
La presente invención se refiere a la química del estado sólido del micofenolato sódico.
Antecedentes de la invención
Al final de la década de 1960, Eli Lilly dio a conocer el efecto inhibidor de la sal de micofenolato sódico (MPS) sobre el crecimiento de las células tumorales malignas en los mamíferos de sangre caliente. Actualmente, Novartis ha introducido una forma farmacéutica entérica revestida de micofenolato sódico, a la que se hace referencia como Myfortic®. El ácido micofenólico puede formarse como sal mono- o disódica. La patente sudafricana nº 6804959 describe la preparación del micofenolato mono- o disódico. El micofenolato monosódico puede aislarse después de la reacción de un equivalente molar del metóxido sódico con ácido micofenólico en una mezcla de metanol y cloroformo mediante precipitación con n-pentano. La preparación de la correspondiente sal disódica también se describe. En este caso, se añadieron dos equivalentes molares del metóxido de sodio a una solución de ácido micofenólico en una mezcla 2:1 benceno-cloroformo. El material evaporado se cristalizó a partir de acetona acuosa.
La vía sintética del documento WO 97/38689 es idéntica a la descrita en la patente sudafricana nº 6804959. El compuesto puede obtenerse en forma cristalina mediante recristalización a partir de acetona/etanol si es necesario con agua (temperatura de fusión 189-191ºC).
La presente invención se refiere a las propiedades físicas del estado sólido del micofenolato sódico. Se puede influir en estas propiedades controlando las condiciones bajo las cuales el micofenolato sódico se obtiene en forma sólida. Las propiedades físicas del estado sólido incluyen, por ejemplo, la capacidad de fluidificación del sólido molido. La capacidad de fluidificación afecta a la facilidad con la que el material se manipula durante el tratamiento para un producto farmacéutico. Cuando las partículas del compuesto pulverulento no fluyen fácilmente entre ellas, un experto en la forma farmacéutica debe considerar que para el desarrollo de un comprimido o una cápsula, puede requerir la utilización de deslizantes tales como dióxido de silicio coloidal, talco, almidón o fosfato cálcico tribásico.
Otra importante propiedad del estado sólido de un compuesto farmacéutico es la velocidad de disolución en el agua. La velocidad de disolución de un compuesto activo en el líquido estomacal de un paciente puede tener consecuencias terapéuticas, ya que impone un límite superior a la velocidad a la cual un principio activo administrado oralmente puede alcanzar el torrente sanguíneo del paciente. La velocidad de disolución debe tenerse en consideración para las formas farmacéuticas tipo jarabe, elixires y otros medicamentos líquidos. La forma del estado sólido de un compuesto puede afectar también a su comportamiento sobre la compactación y su estabilidad de almacenamiento.
Influyen en estas características físicas prácticas la conformación y orientación de las moléculas en la célula unitaria, que define una forma polimórfica particular de una sustancia. La forma polimórfica puede dar lugar a un comportamiento térmico distinto del material amorfo o de otra forma polimórfica. El comportamiento térmico se mide en el laboratorio mediante técnicas tales como la temperatura de fusión capilar, el análisis termogravimétrico (TGA) y la calorimetría de escaneo diferencial (DSC), y puede utilizarse para distinguir algunas formas polimórficas de otras. Una forma polimórfica particular puede asimismo dar lugar a distintas propiedades espectroscópicas que pueden detectarse mediante cristalografía de rayos X, espectrometría RMN C del estado sólido y espectrometría infrarroja.
El documento WO2004/020426 da a conocer la preparación de micofenolato sódico haciendo reaccionar el ácido micofenólico o su sal amónica o dibencil-amínica con una sal sódica del ácido carboxílico C2 a C10. El ácido micofenólico se convierte en su sal amónica reaccionando con amoníaco. Este compuesto reacciona con acetato sódico para obtener la sal sódica del ácido micofenólico.
El documento WO 2004/064806 da a conocer formas polimórficas adicionales del micofenolato sódico y del ácido micofenólico.
Sal monosódica
La patente sudafricana nº 68/4.959 proporciona un ejemplo para preparar la sal de micofenolato monosódico (Ejemplo 3). El metilato sódico en metanol anhidro se añadió al ácido micofenólico en cloroformo, precipitándose entonces la sal monosódica añadiendo n-pentano y recuperándolo mediante filtración y secado al vacío.
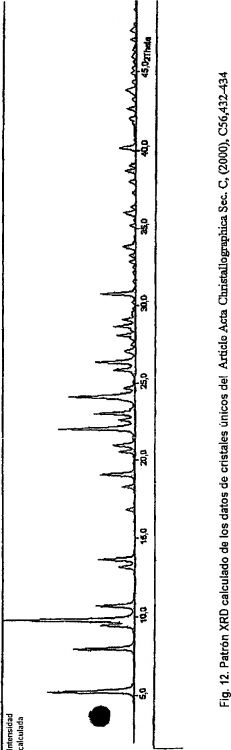
El Acta Chrtystallographica Sec. C, (2000), C56, 432-433, describe otro procedimiento para producir micofenolato monosódico. Una solución metanólica del ácido micofenólico comercializado se trató con un equivalente de metanolato sódico. Después de agitar durante 1 hora a temperatura ambiente, el disolvente se evaporó hasta sequedad al vacío. La temperatura de fusión del producto fue de 463 K (190ºC). Los cristales únicos crecieron por evaporación y enfriamiento de una solución de agua/acetato de etilo desde 323K a la temperatura ambiente. Asimismo, se describe la estructura cristalina del micofenolato sódico producido, medido mediante un difractómetro de cristal único.
Basándose en los parámetros dados del cristal, el difractograma calculado del polvo, llevado a cabo en el contexto de la presente invención, muestra que la forma cristalina obtenida es la forma cristalina denominada forma M2. La forma M2 es una forma anhidra. La forma M2 se caracteriza por un patrón XRD de polvo con picos a los 5,3, 8,0, 9,8, 10,7 y 21,9
El documento PCT 97/38689 describe sales de micofenolato sódico conocidas a partir de la patente sudafricana. Asimismo, describe el procedimiento para obtener la sal monosódica en forma cristalina mediante la recristalización a partir de acetona/etanol si es necesario con agua. La temperatura de fusión que se proporciona es 189-191ºC.
J. Med. Chem. (1996), 39, 1236-1242 describe el tratamiento de una solución de ácido micofenólico en etanol con etilato sódico equimolar a temperatura ambiente y agitación durante 30 minutos. El disolvente se evaporó al vacío.
J. Pharm. Sciences (1970), 59(8), 1157-1159 asegura que el micofenolato monosódico puede formarse ajustando la lechada de ácido micofenólico a pH 7-8 con hidróxido sódico. No se proporcionan datos físicos.
El descubrimiento de nuevas formas polimórficas de un compuesto farmacéuticamente útil proporciona una nueva oportunidad para mejorar las características de la actuación de un producto farmacéutico. Amplía el repertorio de materiales de los que un científico de la forma farmacéutica dispone para el diseño, por ejemplo, de la forma de dosificación farmacéutica de un medicamento con un perfil diana de liberación, o con otra característica deseada.
Sumario de la invención
La invención comprende una forma cristalina de micofenolato monosódico denominada forma M5.
La invención comprende asimismo composiciones farmacéuticas que comprenden la forma micofenolato de la invención.
La presente invención proporciona micofenolato sódico anhidro. El micofenolato sódico anhidro de la presente invención puede caracterizarse además por no presentar más del 1% de la pérdida de peso. La forma M5 de micofenolato sódico que se considera a continuación, es el micofenolato sódico anhidro.
La forma M1 de micofenolato sódico cristalino se caracteriza por un patrón XRD de polvo con picos en 4,7, 6,6, 11,2 y 15,6
Reivindicaciones:
1. Forma de micofenolato sódico cristalino anhidro (forma M5) caracterizada porque presenta un patrón de XRD de polvo con picos en 9,8, 17,4, 22,2, 27,1 y 31,7
2. Micofenolato sódico cristalino anhidro según la reivindicación 1, caracterizado además porque presenta picos de XRD en 21,0, 26,3 y 31,4
3. Micofenolato sódico cristalino anhidro según la reivindicación 1 ó 2, caracterizado porque presenta una XRD tal como se representa en la figura 7.
4. Micofenolato sódico cristalino anhidro según cualquiera de las reivindicaciones anteriores, que muestra un pico endotérmico pequeño de DSC en el intervalo de 169-171ºC y un pico de fusión de DSC en el intervalo de temperatura de aproximadamente 205 a aproximadamente 221ºC.
5. Micofenolato sódico cristalino anhidro según la reivindicación 4, caracterizado porque presenta un DSC tal como se representa en la figura 11.
6. Micofenolato sódico cristalino anhidro según cualquiera de las reivindicaciones anteriores, que presenta una pérdida ponderal de 0,8% como se ha medido mediante TGA.
7. Micofenolato sódico cristalino anhidro según cualquiera de las reivindicaciones anteriores, que contiene menos que o igual a aproximadamente 10% en peso de otras formas cristalinas del micofenolato sódico.
8. Procedimiento para preparar el micofenolato sódico cristalino anhidro según cualquiera de las reivindicaciones anteriores, que comprende el calentamiento de una mezcla de micofenolato sódico y 1,4-dioxano para obtener una solución, seguido por la cristalización de la forma cristalina a partir de la mezcla, y recuperar la forma cristalina.
9. Procedimiento según la reivindicación 8, en el que la mezcla se calienta hasta aproximadamente 80ºC o a la temperatura de reflujo.
10. Procedimiento según la reivindicación 8 ó 9, en el que la cristalización se lleva a cabo enfriando la solución hasta la temperatura ambiente.
11. Procedimiento según cualquiera de las reivindicaciones 8 a 10, en el que la relación de 1,4-dioxano a micofenolato sódico es más de aproximadamente 100 ml/g.
12. Composición farmacéutica que comprende una cantidad terapéuticamente efectiva de una forma de micofenolato sódico según cualquiera de las reivindicaciones 1 a 7, y por lo menos un portador farmacéuticamente aceptable.
Patentes similares o relacionadas:
Composiciones farmacéuticas que comprenden ácido micofenólico o sal de micofenolato, del 16 de Octubre de 2019, de NOVARTIS AG: Una forma de dosificación sólida revestida entéricamente que comprende una cantidad farmacológicamente eficaz de ácido micofenólico o sal de micofenolato, […]
Policondensados con cadena lateral de isobutileno, del 13 de Diciembre de 2017, de CONSTRUCTION RESEARCH & TECHNOLOGY GMBH: Producto de policondensación a base de compuestos aromáticos y/o compuestos heteroaromáticos y aldehídos, caracterizado porque comprende a) al menos […]
Derivado de butilftalida y método de preparación y uso del mismo, del 29 de Junio de 2016, de Shijiazhuang Yiling Pharmaceutical Co., Ltd: Un compuesto para uso en prevenir y tratar enfermedad cerebral isquémica, el compuesto es como se muestra a continuación:**Fórmula** el nombre químico […]
Inhibidores del canal de potasio de la médula externa renal, del 16 de Diciembre de 2015, de MERCK SHARP & DOHME CORP: Un compuesto que tiene la Formula estructural I:**Fórmula** o las sales farmaceuticamente aceptables del mismo, en la que:**Fórmula** representa […]
Derivado de éster 2-amino-biciclo[3.1.0]hexano-2, 6-dicarboxílico, del 23 de Enero de 2013, de TAISHO PHARMACEUTICAL CO., LTD: Un derivado de éster 2-amino-biciclo[3.1.0]hexano-2,6-dicarboxílico representado por la fórmula [II]: en la que X representa flúor, Y representa 3,4-diclorobenciloxi, R2 […]
Procedimiento para modificar la formación de cristales de fármaco de micofenolato de sodio, del 4 de Junio de 2012, de NOVARTIS AG: Procedimiento para modificar el hábito cristalino de un cristal de fármaco acicular, en el que la sustancia farmacológica acicular es una sal de sodio de […]
INMUNOENSAYO BASADO EN LA INHIBICIÓN ENZIMÁTICA, del 8 de Junio de 2011, de F. HOFFMANN-LA ROCHE AG: Un conjugado ligando-inhibidor con una estructura **Fórmula** en la que n = 1-2 y x es -NH-CO-(CH2)3-fenitoína
COMPLEJOS DE INCLUSIÓN DE BUTILFTALIDA CON DERIVADOS DE CICLODEXTRINA Y PROCEDIMIENTOS PARA SU PREPARACIÓN, del 23 de Marzo de 2011, de SHIJIAZHUANG PHARMA. GROUP ZHONGQI PHARMACEUTICAL TECHNOLOGY (SHIJIAZHUANG) CO., LTD: Un complejo de inclusión de la butilftalida con un derivado de la ciclodextrina, en donde dicho derivado de la ciclodextrina se selecciona […]