PROCEDIMIENTO DE INTERCAMBIO DE CONTRAION PARA PEPTIDOS.
Procedimiento para purificar un péptido por intercambio de contraión en el que el contraión del péptido se intercambia con un contraión farmacéuticamente aceptable,
que comprende:
a) cargar un péptido en una columna de RP-HPLC;
b) lavar la columna con una solución acuosa de una sal del contraión farmacéuticamente aceptable; y
c) eluir el péptido de la columna con una mezcla disolvente de un disolvente orgánico y un ácido del contraión farmacéuticamente aceptable,
en el que la solución acuosa presenta un pH de por lo menos 6 y el péptido es atosiban o lanreótido
Tipo: Patente Internacional (Tratado de Cooperación de Patentes). Resumen de patente/invención. Número de Solicitud: PCT/US2005/035868.
Solicitante: NOVETIDE LTD.
Nacionalidad solicitante: Israel.
Dirección: P.O. BOX 10140,26111 HAIFA BAY.
Inventor/es: TOVI, AVI, EIDELMAN, CHAIM, SHUSHAN, SHIMON, ELSTER, SHAI, ALON, HAGI, IVCHENKO,ALEXANDER, BUTILCA,GABRIEL-MARCUS, ZAOUI,GIL.
Fecha de Publicación: .
Fecha Concesión Europea: 2 de Junio de 2010.
Clasificación Internacional de Patentes:
- C07K1/20 QUIMICA; METALURGIA. › C07 QUIMICA ORGANICA. › C07K PEPTIDOS (péptidos que contienen β -anillos lactamas C07D; ipéptidos cíclicos que no tienen en su molécula ningún otro enlace peptídico más que los que forman su ciclo, p. ej. piperazina diones-2,5, C07D; alcaloides del cornezuelo del centeno de tipo péptido cíclico C07D 519/02; proteínas monocelulares, enzimas C12N; procedimientos de obtención de péptidos por ingeniería genética C12N 15/00). › C07K 1/00 Procedimientos generales de preparación de péptidos. › Cromatografía de partición, fase inversa o hidrófoba.
- C07K14/575 C07K […] › C07K 14/00 Péptidos con más de 20 aminoácidos; Gastrinas; Somatostatinas; Melanotropinas; Sus derivados. › Hormonas.
- C07K7/16 C07K […] › C07K 7/00 Péptidos con 5 a 20 aminoácidos en una secuencia totalmente determinada; Sus derivados. › Oxitocinas; Vasopresinas; Péptidos semejantes.
Clasificación PCT:
- C07K1/20 C07K 1/00 […] › Cromatografía de partición, fase inversa o hidrófoba.
- C07K14/575 C07K 14/00 […] › Hormonas.
- C07K14/585 C07K 14/00 […] › Calcitoninas.
- C07K14/655 C07K 14/00 […] › Somatostatinas.
- C07K7/16 C07K 7/00 […] › Oxitocinas; Vasopresinas; Péptidos semejantes.
Fragmento de la descripción:
Procedimiento de intercambio de contraión para péptidos.
Campo de la invención
La invención comprende la purificación de péptidos utilizando un procedimiento de intercambio de contraión.
Antecedentes de la invención
Es conocido que la somatostatina posee un potencial terapéutico muy amplio y puede administrarse en una amplia variedad de aplicaciones clínicas. La vida media en el plasma de la somatostatina es sumamente breve, reduciendo por consiguiente el número potencial de posibles aplicaciones de este polipéptido. Se realizó investigación con el fin de desarrollar análogos de somatostatina que presentan mayor estabilidad y eficacia. Una serie de compuestos que se evaluó como análogos potencialmente útiles de somatostatina fueron los octapéptidos cíclicos. La evaluación del octapéptido cíclico, octreotida, demostró que el compuesto presentaba excelente actividad biológica, tanto in vitro como in vivo (Pless J., Metabolism 41, 5-6 (1992)). La octreotida presenta la fórmula básica siguiente:
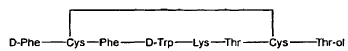
(SEC. ID. nº 1) en la que los átomos de azufre de los restos de Cys en las posiciones 2 y 7 están unidos por un puente disulfuro. El grupo carboxílico del aminoácido C-terminal, treonina (Thr) se reduce al resto del alcohol Thr-ol (treoninol).
La presencia de D-fenilananina (D-Phe) en el extremo N-terminal y de un aminoalcohol en el extremo C-terminal, junto con el resto D-triptófano (D-Trp) y el puente disulfuro, hacen a la molécula muy resistente a la degradación metabólica. La octreotida permite una incubación de 24 horas en medios agresivos, tales como los jugos gástricos o en la mucosa intestinal.
La octreotida inhibe a la hormona de crecimiento durante un periodo prolongado, inhibe la secreción del glucagón en menor grado e inhibe la secreción de insulina solamente de manera temporal. Por lo tanto la octreotida es más selectiva que otros análogos de somatostatina en la regulación de las concentraciones de la hormona de crecimiento en el cuerpo y por consiguiente, actualmente está indicada en la acromegalia para controlar y reducir los niveles en el plasma de dicha hormona. Además la octreotida es útil en el tratamiento de alteraciones celulares de origen gastroenteropancreático endocrino y de determinados tipos de tumores.
La síntesis de octreotida y de sus derivados ha sido descrita por dos métodos de síntesis general. El primer método es un procedimiento en fase de solución, basado en la condensación del fragmento, como describe Bauer et al. solicitud de patente europea nº 29.579 (1981) y la patente US nº 4.395.403. El procedimiento comprende generalmente separar un grupo protector de un resto de hexapéptido protegido; enlazar dos unidades peptídicas mediante un enlace amida, en el que uno comprende un resto de hexapéptido; convertir un grupo funcional en el extremo terminal N- o C- del polipéptido resultante; y oxidar el polipéptido. El procedimiento conlleva mucho tiempo, la síntesis en multietapa y presenta problemas adicionales durante la separación de la octreotida de las mezclas de reacción porque todas las etapas de síntesis se realizan en fase de solución.
El segundo procedimiento para la síntesis de octreotida sintetiza la cadena peptídica completa utilizando la síntesis de péptidos en fase sólida, partiendo de la síntesis en el resto de treoninol. Este método requiere que el resto de treoninol esté protegido.
El segundo procedimiento de síntesis utiliza una resina de aminometilo en la que el resto de treoninol se incorpora con las dos funciones alcohólicas protegidas en forma de acetal. Mergler et al., "Peptides: Chemistry an Biology", Proceedings of the 12th American Peptide Symposium, Poster 292 Presentation (Smith, J.A. y Rivier J.E., Eds ESCOM, Leiden) (1991). La síntesis se lleva a cabo siguiendo un esquema de protección Fmoc/t-Bu; formando el puente disulfuro en una resina mediante oxidación de los grupos tiol de los restos de cisteína previamente desprotegidos; y liberando y desprotegiendo el péptido con una mezcla al 20% de TFA/DCM.
Alsina et al. describieron la incorporación de un resto de treoninol en las resinas de carbonato activas en las que el grupo amino está protegido por un grupo Boc y la cadena lateral está protegida por un grupo Bzl. Alsina et al., Tetrahedron Letters, 38, 883-886 (1997). Después, la síntesis continuó utilizando una estrategia Boc/Bzl. La formación del puente disulfuro se llevó a cabo directamente en resina utilizando yodo, y el péptido se escindió de la resina y sus grupos protectores de la cadena lateral se separaron simultáneamente con HF/anisol (9/1). Al final de la etapa el grupo formilo se separó con una solución de piperidina/DMF. Neugebauer et al. describieron una síntesis lineal con un rendimiento de solamente el 7%. Neugebauer et al. PEPTIDES: CHEMISTRY, STRUCTURE AND BIOLOGY, Pág. 1017 (Marshal G.R. y Rivier J.E., Eds ESCOM, Leiden, 1990).
Edwards et al. dieron a conocer una aproximación de tipo fase sólida mediante la síntesis paso a paso del péptido D-Phe-Cys(Acm)-Phe-D-Trp(Boc)-Lys(Boc)-Thr(t-Bu)-Cys(Acm)-HMP-resina (SEC. ID. nº 1). Edwards et al., J. Med Chem. 37, 3749-3757 (1994). Posteriormente, se preparó el disulfuro sobre la resina, y el producto resultante se liberó de la resina por medio de aminolisis con treoninol. El rendimiento total obtenido fue solamente del 14%.
Arano et al. realizaron otro método en fase sólida para DTPA-octreotida. Arano et al., Bioconjugate Chem., 8, 442-446 (1997). La oxidación con yodo del DTPA-péptido produjo DTPA-D-Phe1-octreotida con un rendimiento total del 31,8% referido a la Fmoc-Thr(tBu)-ol-resina de partida.
Wu et al. desarrollaron un método de síntesis para la octreotida, en el que el enlace disulfuro se formó por oxidación utilizando una solución diluida de octreotida con aire durante 48 horas. Wu et al., Tetrahedron Letters, 39, 1783-1784 (1998). Lee et al. llevaron a cabo recientemente un nuevo método para anclar Thr(ol) (o Thr-ol) a una resina de síntesis en fase sólida para la preparación de la octreotida. Véase, la patente US nº 5.889.146. Se cargó el Fmoc-Thr (ol)-tereftal-acetal en la resina y tras la construcción de las cadenas peptídicas que utiliza la química Fmoc, se obtuvo la ciclación del péptido en la resina por oxidación con yodo. La escisión del péptido-resina con ácido trifluoracético, produjo la octreotida con un rendimiento global >70% a partir de la Fmoc-Thr(ol)-tereftal-acetal-resina de partida. Todos estos procedimientos completaron la ciclación de la octreotida en el péptido totalmente desprotegido o en la resina.
Más análogos cíclicos, cíclicos con puente y de cadena lineal de somatostatina y procedimientos para su preparación se describen en las patentes US nº 4.310.518 y nº 4.235.886; las memorias de patente europea EP-A-1295; nº 70.021; nº 113.209; nº 215.171; nº 203.031; nº 214.872 y nº 143.307; y la memoria de la p atente belga BE-A-900.089.
La purificación del péptido puede eliminar las impurezas producida por la modificación de la cadena lateral, las secuencias de eliminación o adición o los productos de racemización. Los contraiones introducidos durante la síntesis de péptido son también una fuente de impurezas. Los péptidos que contienen por lo menos una función básica en su secuencia (cadenas laterales de Lys o Arg, o el grupo amino N-terminal) aparecen como sales y no como base libre durante la síntesis y la purificación. Los contraiones del péptido por lo general comprenden ácido trifluoracético (ATF) o fosfatos, entre otros. El acetato es un contraión farmacéuticamente aceptable y con frecuencia la selección para reemplazar los contraiones se utiliza durante la síntesis o la purificación de ingredientes farmacéuticamente activos (API). Por lo tanto, en algún momento durante la síntesis del péptido debe reemplazarse el contraión.
Generalmente, las columnas de intercambio iónico reemplazan contraiones en las sales de polipéptidos; sin embargo, el procedimiento requiere con frecuencia etapas de purificación adicionales y un sistema adicional de purificación. La cromatografía líquida de alta resolución en fase inversa (RP-HPLC) mejora significativamente la purificación de péptido sintéticos (Andersson L et al., Biopolymers, 2000, 55, 227-250). Sin embargo,...
Reivindicaciones:
1. Procedimiento para purificar un péptido por intercambio de contraión en el que el contraión del péptido se intercambia con un contraión farmacéuticamente aceptable, que comprende:
en el que la solución acuosa presenta un pH de por lo menos 6 y el péptido es atosiban o lanreótido.
2. Procedimiento según la reivindicación 1, en el que la sal del contraión farmacéuticamente aceptable es el acetato de amonio, el citrato de amonio o el pamoato de amonio.
3. Procedimiento según la reivindicación 1, en el que el pH de la solución acuosa es 8.
4. Procedimiento según la reivindicación 3, en el que por lo menos una base ajusta el pH de la solución acuosa.
5. Procedimiento según la reivindicación 4, en el que la base es amoniaco, hidróxido de amonio, metilamina, etilamina, dimetilamina, dietilamina, metiletilamina, trimetilamina o trietilamina.
6. Procedimiento según la reivindicación 4, en el que la base es el hidróxido de amonio.
7. Procedimiento según la reivindicación 1, en el que la mezcla disolvente presenta un pH inferior a 6.
8. Procedimiento según la reivindicación 1, en el que el disolvente orgánico es por lo menos uno de entre acetonitrilo, metanol, etanol, isopropanol o THF.
9. Procedimiento según la reivindicación 8, en el que el disolvente orgánico es el acetonitrilo.
10. Procedimiento según la reivindicación 1, en el que el ácido del contraión farmacéuticamente aceptable es el ácido acético, el ácido cítrico o el ácido pamoico.
11. Procedimiento según la reivindicación 1, en el que el péptido eluido presenta no más de 0,25% en peso de contraión residual.
12. Procedimiento según la reivindicación 1, en el que el péptido eluído presenta no más de 200 partes por millón de contraión residual.
Patentes similares o relacionadas:
Antagonistas peptídicos de la familia calcitonina CGRP de hormonas peptídicas y su uso, del 17 de Junio de 2020, de Soares, Christopher, J: Un antagonista del péptido relacionado con el gen de la calcitonina, o una sal farmacéuticamente aceptable del mismo, teniendo dicho antagonista la estructura […]
Una composición para el tratamiento de la diabetes que comprende un análogo de oxintomodulina, del 11 de Marzo de 2020, de HANMI PHARM. CO., LTD.: Una composición para su uso en la prevención o el tratamiento de la diabetes, la composición comprende un conjugado de análogo de oxintomodulina como un ingrediente […]
Modelo de cerdo para la diabetes, del 29 de Enero de 2020, de AARHUS UNIVERSITET: Un cerdo transgénico que comprende un gen de polipéptido amiloide de los islotes (IAPP) mutado humano o parte del mismo, y que muestra al menos […]
Variantes mejoradas de unión de anti-albúmina sérica, del 18 de Diciembre de 2019, de GLAXO GROUP LIMITED: Un conjugado que comprende un fármaco NCE conjugado a un dominio variable único de inmunoglobulina antialbúmina sérica (SA) que comprende la secuencia de aminoácidos de SEQ […]
POLIPÉPTIDOS, del 4 de Diciembre de 2019, de NOVO NORDISK A/S: Un polipéptido de acuerdo con la Fórmula (I): Xaa1-Cys-Xaa3-Thr-Ala-Thr-Cys-Ala-Thr-Gln-Arg-Leu-Ala-Xaa14-Phe-Leu- Xaa17-Xaa18-Ser-Ser- Xaa21- […]
Polipéptidos de acción prolongada y métodos para producirlos y administrarlos, del 4 de Diciembre de 2019, de OPKO Biologics Ltd: Un polipéptido que comprende una actividad biológica, dicho polipéptido comprende un péptido de interés, un solo péptido carboxilo terminal (CTP) de gonadotropina coriónica unido […]
Análogos de cortistatina para el tratamiento de enfermedades inflamatorias y/o inmunes, del 23 de Octubre de 2019, de BCN PEPTIDES, S.A.: Un compuesto análogo de cortistatina de fórmula general (I), R1-AA1-AA2-AA3-AA4-c[Cys-AA5-Asn-X-Y-Trp-Lys-Thr-Z-AA6-Ser-Cys]-AA7-R2 sus […]
Compuestos coagonistas de GIP y GLP-1, del 14 de Agosto de 2019, de ELI LILLY AND COMPANY: Un compuesto de Fórmula: YX1EGTFTSDYSIX2LDKIAQKAX3VQWLIAGGPSSGAPPPS; en la que X1 es Aib; X2 es Aib; K en la posición 20 se modifica químicamente […]