FORMULACION FARMACOLOGICA LIOFILIZADA ESTABLE DE ANTICUERPOS IGG DACLIZUMAB.
Formulación estable liofilizada preparada mediante liofilización de una formulación acuosa,
que comprende:
una solución tampón de aproximadamente 5 a 25 mM de histidina con un pH variable entre 5,5 y 6,5,
alrededor de un 0,005% a un 0,03% de polisorbato,
alrededor de 100 a 300 mM de sucrosa, y
un anticuerpo IgG con una concentración de 50 mg/ml o superior,
en la que dicha formulación puede ser reconstituida con un líquido para formar una solución exenta de partículas que contenga anticuerpo IgG con una concentración de 50 mg/ml o superior, en un tiempo de 2 minutos o inferior, en la que el anticuerpo IgG es un anticuerpo monoclonal recombinante humanizado de la subclase IgG1 denominado "Daclizumab" que se une a la subunidad p55 del receptor IL-2 expresado en células T activadas y que tiene un peso de monómero de aproximadamente 150.000 daltons
Tipo: Patente Internacional (Tratado de Cooperación de Patentes). Resumen de patente/invención. Número de Solicitud: PCT/US02/24078.
Solicitante: FACET BIOTECH CORPORATION.
Nacionalidad solicitante: Estados Unidos de América.
Dirección: 1400 SEAPORT BOULEVARD,REDWOOD CITY, CALIFORNIA 94063.
Inventor/es: KAISHEVA,ELIZABET,A, FLORES-NATE,ALENI, GUPTA,SUPRIYA.
Fecha de Publicación: .
Fecha Concesión Europea: 6 de Enero de 2010.
Clasificación Internacional de Patentes:
- A61K39/395S
- A61K9/00M5
- A61K9/19 NECESIDADES CORRIENTES DE LA VIDA. › A61 CIENCIAS MEDICAS O VETERINARIAS; HIGIENE. › A61K PREPARACIONES DE USO MEDICO, DENTAL O PARA EL ASEO (dispositivos o métodos especialmente concebidos para conferir a los productos farmacéuticos una forma física o de administración particular A61J 3/00; aspectos químicos o utilización de substancias químicas para, la desodorización del aire, la desinfección o la esterilización, vendas, apósitos, almohadillas absorbentes o de los artículos para su realización A61L; composiciones a base de jabón C11D). › A61K 9/00 Preparaciones medicinales caracterizadas por un aspecto particular. › liofilizados.
- C07K16/28H
Clasificación PCT:
- A61K39/395 A61K […] › A61K 39/00 Preparaciones medicinales que contienen antígenos o anticuerpos (materiales para ensayos inmunológicos G01N 33/53). › Anticuerpos (aglutininas A61K 38/36 ); Inmunoglobulinas; Inmunosuero, p. ej. suero antilinfocitario.
- A61K9/19 A61K 9/00 […] › liofilizados.
Clasificación antigua:
- A61K39/395 A61K 39/00 […] › Anticuerpos (aglutininas A61K 38/36 ); Inmunoglobulinas; Inmunosuero, p. ej. suero antilinfocitario.
- C07K16/00 QUIMICA; METALURGIA. › C07 QUIMICA ORGANICA. › C07K PEPTIDOS (péptidos que contienen β -anillos lactamas C07D; ipéptidos cíclicos que no tienen en su molécula ningún otro enlace peptídico más que los que forman su ciclo, p. ej. piperazina diones-2,5, C07D; alcaloides del cornezuelo del centeno de tipo péptido cíclico C07D 519/02; proteínas monocelulares, enzimas C12N; procedimientos de obtención de péptidos por ingeniería genética C12N 15/00). › Inmunoglobulinas, p. ej. anticuerpos mono o policlonales.
Fragmento de la descripción:
Formulación farmacológica liofilizada estable de anticuerpos IgG Daclizumab.
Ámbito de la invención
La presente invención se refiere en términos generales al campo de la formulación farmacológica de anticuerpos IgG. Concretamente, la presente invención se refiere a una formulación estable, liofilizada y de alta concentración del anticuerpo IgG, en la que el anticuerpo IgG es un anticuerpo recombinante humanizado monoclonal de la subclase IgG1 denominado "Daclizumab", que se une a la subunidad p55 del receptor IL-2.
Antecedentes de la invención
Es bien conocido que muchas preparaciones de proteína preparadas para su administración en los seres humanos requieren estabilizadores para impedir su desnaturalización, agregación y otras alternancias de las proteínas con anterioridad a la utilización de la preparación. Muchas preparaciones de proteína resultan especialmente inestables en soluciones muy diluidas o altamente concentradas. Esta inestabilidad se manifiesta en la formación de agregados solubles/insolubles, y suele aumentar cuando la preparación de proteína se almacena o se transporta. Uno de los grandes desafíos que existen en el ámbito de los medicamentos proteínicos es el desarrollo de formulaciones que mantengan simultáneamente la estabilidad y la actividad de la proteína.
Concretamente, se reconoce que las inmunoglobulinas poseen características que tienden a formar agregados y partículas en solución, lo que exige el filtrado de estas formulaciones antes de utilizarlas para su inyección intravenosa. La formación de agregados y partículas proteínicas ha sido desde hace tiempo un problema en el desarrollo de productos de inmunoglobulina para administración parenteral. Existe en la técnica la necesidad de una formulación farmacológica estable que incluya un anticuerpo.
El documento WO 89/11297 describe un compuesto liofilizado que incluye un anticuerpo monoclonal de inmunoglobulina de 1 a 25 mg/ml, 2 a 10% maltosa, y un tampón de acetato sódico, fosfato o citrato con un pH de entre 3,0 y 6,0.
El SynagisTM (MedIinmune) es un anticuerpo monoclonal humanizado IgG1 producido mediante tecnología de ADN recombinante que se dirige a un epítopo del emplazamiento antigénico A de la proteína T del virus sincitial respiratorio (RSV). El SynagisTM es un compuesto formado por secuencias de anticuerpos humanas (95%) y de ratón (5%). El SynagisTM se suministra como un producto estéril liofilizado para su reconstitución con agua esterilizada para su inyección. El SynagisTM reconstituido debe mantenerse a temperatura ambiente durante un mínimo de 20 minutos hasta que se aclare la solución. El SynagisTM reconstituido debe administrarse exclusivamente mediante inyección intramuscular. En el momento de la reconstitución, el SynagisTM contiene los siguientes excipientes: 47 mM de histidina, 3,0 mM de glicina y 56% de manitol, y el ingrediente activo, el anticuerpo IgG1, a una concentración de 100 miligramos por vial. (Véase Physicians' Desk Reference®, Medical Economic Company, Inc., Montvale, New Jersey).
La solicitud de patente US 2001/0014326A1 describe una formulación de anticuerpo pre-liofilizado que contiene 25 mg/ml del anticuerpo anti-IgE, 5 mM de histidina, pH 6,0, 85 mM de sucrosa y 0,01% de polisorbato 20.
La patente estadounidense Nº 6171586 describe una formulación farmacológica acuosa estable que comprende una cantidad terapéuticamente efectiva de un anticuerpo no sujeto a una liofilización previa, y un buffer de acetato de entre pH 4,8 a aproximadamente 5,5, un surfactante y un poliol, en la que la formulación carece de una cantidad tonificante de cloruro sódico.
El documento WO 97/45140 describe una preparación de anticuerpo monoclonal de un anticuerpo humanizado contra el antígeno CDw52, con una concentración de 100 mg/ml o superior, estando dicha preparación sustancialmente exenta de agregados.
Cleland, et al (J. Pharm. Sci., 90:310-321 (2001)) describen que se precisa una relación molar de 360:1 entre lioprotector y proteína para almacenar de forma estable un anticuerpo monoclonal liofilizado.
La publicación de la solicitud de patente estadounidense Nº 2006/0034827 A1 presenta la descripción del producto SYNAGIS®, que hace referencia a una formulación del anticuerpo IgG "Palivizumab" que se combina inmunoespecíficamente con un antígeno del virus sincitial respiratorio (RSV). Esta formulación comprende el anticuerpo en combinación con concentraciones específicas de histidina, manitol, y glicina, mientras que la formulación no incluye polisorbato o sucrosa. Además, la formulación reconstituida del SYNAGIS® debe mantenerse a temperatura ambiente durante un mínimo de 20 minutos hasta que la solución se aclara.
Es necesaria una preparación estable, liofilizada y de alta concentración del anticuerpo para su administración a seres humanos, pudiendo reconstituirse dicho anticuerpo en un breve período de tiempo, siendo adecuado para su administración parenteral, incluyendo la inyección intravenosa, intramuscular, intraperitoneal o subcutánea.
Resumen de la invención
La presente invención se refiere a una formulación farmacológica estable liofilizada preparada a partir de una formulación acuosa con una elevada concentración, es decir, 50 mg/ml o superior de un anticuerpo IgG, en la que el anticuerpo IgG es un anticuerpo recombinante monoclonal humanizado de la subclase IgG 1 denominado "Daclizumab" en una solución tampón de histidina de alrededor de 5 a 25 mM (pH de entre 5,5 a 6,5), alrededor de un 0,005% a un 0,003% de polisorbato, y sucrosa, opcionalmente en combinación con serina, y/o manitol. Esta formulación conserva la estabilidad del anticuerpo IgG de la presente invención e impide que las inmunoglobulinas previstas para su administración en seres humanos formen agregados/partículas en el producto final. La formulación liofilizada se reconstituye con un líquido para formar una solución clarificada que contenga el anticuerpo IgG en una concentración de 50 mg/ml o superior en un tiempo de unos 2 minutos o inferior.
Esta formulación liofilizada es estable a temperatura ambiente durante al menos 3 meses, más preferiblemente 6 meses y más preferiblemente 1 año. La formulación liofilizada es también estable a 2 a 8ºC durante un año, y preferiblemente 2 años. Esta formulación liofilizada tiene un corto período de reconstitución de menos de 2 minutos, y resulta adecuada para su administración parenteral incluyendo la inyección intravenosa, intramuscular, intraperitoneal o subcutánea.
Breve descripción de las figuras
La figura 1 muestra el efecto de los excipientes sobre la estabilidad de los anticuerpos, mediante la comprobación (A) del líquido tras su almacenamiento a 55ºC durante 10 días, y (B) del liófilo a 40ºC durante 12 días.
Las figuras 2A y 2B muestran la comparación de las predicciones modelo y de la observación experimental correspondiente a las muestras de prueba 1 a 15.
La figura 2A muestra la bajada en % de monómero. La figura 2B muestra el tiempo de reconstitución.
Las figuras 3A y 3B muestran la comparación de las predicciones modelo y de la observación experimental para las muestras de control 16 a 20. La figura 3A muestra el % de bajada de monómero. La figura 3B muestra el tiempo de reconstitución.
La figura 4 muestra los coeficientes modelo de (A) el efecto principal, y (B) el efecto de interacción.
Las figuras 5A y 5B muestran simulaciones modelo representativas de manitol frente a sucrosa, [serina]=0. La figura 5A muestra el % de bajada de monómero. La figura 5B muestra el tiempo de reconstitución.
Las figuras 6A y 6B muestran simulaciones modelo representativas de manitol frente a serina, [sucrosa]=0. La figura 6A muestra el % de bajada de monómero. La figura 6B muestra el tiempo de reconstitución.
Las figuras 7A y 7B muestran simulaciones modelo representativas de sucrosa frente a serina, [manitol]=0.
La figura 7A muestra el % de bajada de monómero. La figura 7B muestra el tiempo de reconstitución.
Las figuras 8A y 8B muestran simulaciones modelo representativas de manitol frente a serina, [sucrosa]=100 mM. La figura 8A muestra el % de bajada de monómero. La figura 8B muestra el tiempo de reconstitución.
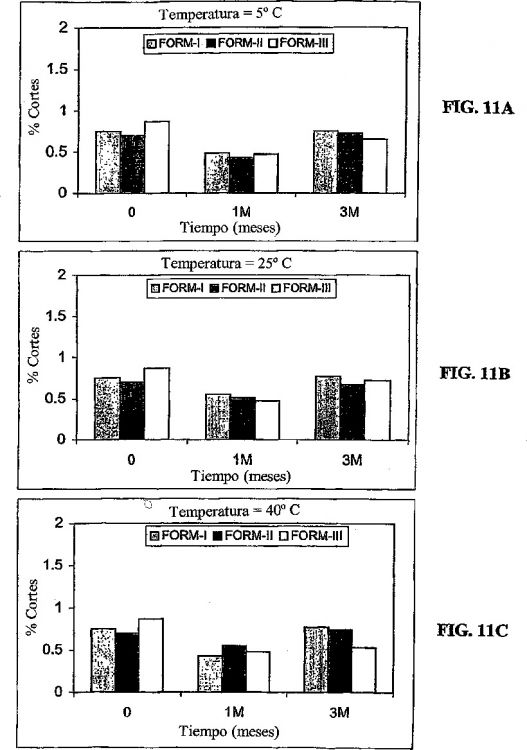
Las figuras 9A a 9C muestran el porcentaje de monómero en las formulaciones I, II y III en función del tiempo en (A) 5ºC, (B) 25ºC, y (C)...
Reivindicaciones:
1. Formulación estable liofilizada preparada mediante liofilización de una formulación acuosa, que comprende:
una solución tampón de aproximadamente 5 a 25 mM de histidina con un pH variable entre 5,5 y 6,5,
alrededor de un 0,005% a un 0,03% de polisorbato,
alrededor de 100 a 300 mM de sucrosa, y
un anticuerpo IgG con una concentración de 50 mg/ml o superior,
en la que dicha formulación puede ser reconstituida con un líquido para formar una solución exenta de partículas que contenga anticuerpo IgG con una concentración de 50 mg/ml o superior, en un tiempo de 2 minutos o inferior, en la que el anticuerpo IgG es un anticuerpo monoclonal recombinante humanizado de la subclase IgG1 denominado "Daclizumab" que se une a la subunidad p55 del receptor IL-2 expresado en células T activadas y que tiene un peso de monómero de aproximadamente 150.000 daltons.
2. Formulación estable liofilizada de acuerdo con la reivindicación 1, en la que dicha concentración de sucrosa está situada en torno a 100 a 200 mM.
3. Formulación estable liofilizada preparada mediante liofilización de una formulación acuosa, que comprende:
una solución tampón de aproximadamente 5 a 25 mM de histidina con un pH variable entre 5,5 y 6,5,
alrededor de un 0,005% a un 0,03% de polisorbato,
alrededor de 110 a 130 mM de sucrosa,
alrededor de 20 a 45 mM de manitol, y
un anticuerpo IgG con una concentración de 50 mg/ml o superior,
en la que dicha formulación puede ser reconstituida con un líquido para formar una solución exenta de partículas que contenga anticuerpo IgG con una concentración de 50 mg/ml o superior, en un tiempo de 2 minutos o inferior, en la que el anticuerpo IgG es un anticuerpo monoclonal recombinante humanizado de la subclase IgG1 denominado "Daclizumab" que se une a la subunidad p55 del receptor IL-2 expresado en células T activadas y que tiene un peso de monómero de aproximadamente 150.000 daltons.
4. Formulación estable liofilizada preparada mediante liofilización de una formulación acuosa, que comprende:
Una solución tampón de aproximadamente 5 a 25 mM de histidina con un pH variable entre 5,5 y 6,5,
alrededor de un 0,005% a un 0,03% de polisorbato,
alrededor de 80 a 130 mM de sucrosa,
alrededor de 7 a 55 mM de serina,
alrededor de 10 a 55 mM de manitol, y
un anticuerpo IgG con una concentración de 50 mg/ml o superior,
en la que dicha formulación puede ser reconstituida con un líquido para formar una solución exenta de partículas que contenga anticuerpo IgG con una concentración de 50 mg/ml o superior, en un tiempo de 2 minutos o inferior, en la que el anticuerpo IgG es un anticuerpo monoclonal recombinante humanizado de la subclase IgG1 denominado "Daclizumab" que se une a la subunidad p55 del receptor EL-2 expresado en células T activadas y que tiene un peso de monómero de aproximadamente 150.000 daltons.
5. Formulación estable liofilizada preparada mediante liofilización de una formulación acuosa, que comprende:
una solución tampón de aproximadamente 5 a 25 mM de histidina con un pH variable entre 5,5 y 6,5,
alrededor de un 0,005% a un 0,03% de polisorbato, alrededor de 100 a 130 mM de sucrosa,
alrededor de 15 a 55 mM de serina, y
un anticuerpo IgG con una concentración de 50 mg/ml o superior,
en la que dicha formulación puede ser reconstituida con un líquido para formar una solución exenta de partículas que contenga anticuerpo IgG con una concentración de 50 mg/ml o superior, en un tiempo de 2 minutos o inferior, en la que el anticuerpo IgG es un anticuerpo monoclonal recombinante humanizado de la subclase IgG1 denominado "Daclizumab" que se une a la subunidad p55 del receptor IL-2 expresado en células T activadas y que tiene un peso de monómero de aproximadamente 150.000 daltons.
6. Formulación estable liofilizada de acuerdo con la reivindicación 1, 3, 4 o 5, en la que dicha formulación es estable en torno a 22 a 28ºC durante al menos 3 meses.
7. Formulación estable liofilizada de acuerdo con la reivindicación 1, 3, 4 o 5, en la que dicha formulación es estable en torno a 2 a 8ºC durante al menos un año.
8. Formulación estable liofilizada de acuerdo con la reivindicación 1, 3, 4 o 5, en la que una solución reconstituida de la formulación es adecuada para su inyección subcutánea.
9. Formulación estable liofilizada de acuerdo con la reivindicación 1, 3, 4 o 5, en la que la solución reconstituida es isotónica.
10. Formulación estable liofilizada de acuerdo con la reivindicación 1, 3, 4 o 5, en la que la concentración de histidina varía entre 10 y 20 mM.
11. Formulación estable liofilizada de acuerdo con la reivindicación 1, 3, 4 o 5, en la que la formulación acuosa comprende 20 mM de histidina, un 0,015% de polisorbato Tween®80, 117 mM de sucrosa, y "Daclizumab" a una concentración de 50 mg/ml.
12. Formulación estable liofilizada de acuerdo con la reivindicación 1, 3, 4 o 5, en la que la formulación acuosa comprende 20 mM de histidina, un 0,025% de polisorbato Tween®80, 190 mM de sucrosa, y "Daclizumab" a una concentración de 80 mg/ml.
13. Formulación estable liofilizada de acuerdo con la reivindicación 1, 3, 4 o 5, en la que la formulación acuosa comprende 20 mM de histidina, un 0,015% de polisorbato Tween®80, 117 mM de sucrosa, y "Daclizumab" a una concentración de 80 mg/ml.
Patentes similares o relacionadas:
Formulaciones liofilizadas para antídoto del factor Xa, del 1 de Julio de 2020, de PORTOLA PHARMACEUTICALS, INC.: Una formulación acuosa, que comprende de 10 mM a 55 mM de arginina, de 1% a 3% de sacarosa (p/v), de 2% a 8% de manitol (p/v), y al menos 5 mg/ml de un polipéptido […]
Formulaciones de nanopartículas y usos de las mismas, del 24 de Junio de 2020, de ABRAXIS BIOSCIENCE, LLC: Una composición que comprende nanopartículas, en donde las nanopartículas comprenden un derivado de taxano hidrófobo recubierto con albúmina, en donde al menos […]
Método de producción de compuestos de inclusión de flavonoide, del 3 de Junio de 2020, de TAIYO KAGAKU CO., LTD.: Un método de producción de un compuesto de inclusión de flavonoide, que comprende una etapa de escisión que comprende tratar un flavonoide escasamente […]
Composición de principios activos liofilizada, del 27 de Mayo de 2020, de MedSkin Solutions Dr. Suwelack AG: Cuerpo moldeado liofilizado, caracterizado porque contiene ≥ 75% en peso de ácido ascórbico, dado el caso principios activos adicionales y < […]
Preparación liofilizada de toxina botulínica, del 20 de Mayo de 2020, de Medy-Tox, INC. (100.0%): Preparación liofilizada farmacéutica que comprende: toxina botulínica, polisorbato y metionina; y uno o más componentes seleccionados del grupo que consiste en azúcar, […]
Composición farmacéutica estable de la proteína de fusión TNFR:Fc etanercept, del 29 de Abril de 2020, de Lupin Atlantis Holdings, SA: Composición farmacéutica estable que comprende etanercept, tampón fosfato-citrato y L-glicina como agente antiagregante.
Formulación de Mesna y su uso, del 29 de Abril de 2020, de AuXin Surgery SA: Un dispositivo para administrar una formulación de Mesna a tejidos y/u órganos, que comprende una primera cámara que comprende el Mesna en forma sólida, una segunda cámara […]
Formulación parenteral de esmolol, del 15 de Abril de 2020, de AOP ORPHAN PHARMACEUTICALS AG: Formulación parenteral de clorhidrato de esmolol para su uso en el tratamiento de un paciente que padece taquicardia que comprende un polvo liofilizado que consiste en clorhidrato […]