FORMA DE DOSIFICACION ESTABLE DE DERIVADOS DE FENILALANINA.
Formulación farmacéutica, que comprende (i) un derivado de amidino-,
hidroxiamidino-, guanidino- y/o hidroxiguanidino-fenialanina en calidad de sustancia activa, (ii) una mezcla a base de poliol/alcohol y (iii) una fase acuosa que comprende un tampón
Tipo: Patente Internacional (Tratado de Cooperación de Patentes). Resumen de patente/invención. Número de Solicitud: PCT/EP2005/010143.
Solicitante: WILEX AG.
Nacionalidad solicitante: Alemania.
Dirección: GRILLPARZERSTRASSE 10, 81675 MUNCHEN.
Inventor/es: SCHMALIX, WOLFGANG, KOCH, KLAUS, BURGLE,MARKUS.
Fecha de Publicación: .
Fecha Concesión Europea: 8 de Septiembre de 2010.
Clasificación Internacional de Patentes:
- A61K31/18 NECESIDADES CORRIENTES DE LA VIDA. › A61 CIENCIAS MEDICAS O VETERINARIAS; HIGIENE. › A61K PREPARACIONES DE USO MEDICO, DENTAL O PARA EL ASEO (dispositivos o métodos especialmente concebidos para conferir a los productos farmacéuticos una forma física o de administración particular A61J 3/00; aspectos químicos o utilización de substancias químicas para, la desodorización del aire, la desinfección o la esterilización, vendas, apósitos, almohadillas absorbentes o de los artículos para su realización A61L; composiciones a base de jabón C11D). › A61K 31/00 Preparaciones medicinales que contienen ingredientes orgánicos activos. › Sulfamidas (compuestos que contienen un grupo para N-benceno-sulfonil-N A61K 31/63).
- A61K31/198 A61K 31/00 […] › Alfa-amino-ácidos, p. ej. alanina, ácido etilendiamino tetraacético (EDTA) (betaína A61K 31/205; prolina A61K 31/401; triptófano A61K 31/405; histidina A61K 31/4172; péptidos no degradados en aminoácidos individuales A61K 38/00).
- A61K31/495 A61K 31/00 […] › que tienen ciclos con seis eslabones con dos nitrógenos como únicos heteroátomos de un ciclo, p. ej. piperazina (A61K 31/48 tiene prioridad).
- A61K47/10 A61K […] › A61K 47/00 Preparaciones medicinales caracterizadas por los ingredientes no activos utilizados, p. ej. portadores o aditivos inertes; Agentes de direccionamiento o agentes modificadores enlazados químicamente al ingrediente activo. › Alcoholes; Fenoles; Sus sales, p. ej. glicerol; Polietilenglicoles [PEG]; Poloxámeros; Éteres alquílicos PEG/POE.
- A61K9/00M5
Clasificación PCT:
- A61K31/18 A61K 31/00 […] › Sulfamidas (compuestos que contienen un grupo para N-benceno-sulfonil-N A61K 31/63).
- A61K31/495 A61K 31/00 […] › que tienen ciclos con seis eslabones con dos nitrógenos como únicos heteroátomos de un ciclo, p. ej. piperazina (A61K 31/48 tiene prioridad).
- A61K47/10 A61K 47/00 […] › Alcoholes; Fenoles; Sus sales, p. ej. glicerol; Polietilenglicoles [PEG]; Poloxámeros; Éteres alquílicos PEG/POE.
- A61K47/12 A61K 47/00 […] › Acidos carboxílicos; Sus sales o anhídridos.
Fragmento de la descripción:
Forma de dosificación estable de derivados de fenilalanina.
La invención se refiere a formulaciones farmacéuticas de derivados de fenilalanina, mejoradas y estables, y a su uso en calidad de inhibidores de uroquinasa, en particular para el tratamiento de tumores malignos y de metástasis tumorales.
La capacidad de tumores sólidos de expandirse y metastasizarse en el tejido circundante se correlaciona con la degradación o reconstrucción de la matriz extracelular (estroma tumoral) en el entorno de la célula tumoral o con su capacidad de atravesar la membrana basal. A pesar de que aún no se han esclarecido definitivamente las relaciones (pato)bioquímicas, se les otorga una importancia central al activador de plasminógeno tipo uroquinasa (uPA) y al receptor de uroquinasa (uPAR). uPA induce la disociación proteolítica de plasminógeno en plasmina. A su vez, plasmina es una proteasa de amplio espectro de acción que es capaz de degradar directamente los componentes de la matriz extracelular, tales como fibrina, fibronectina, laminina y la estructura protéica de los proteoglicanos. Además, plasmina puede activar metaloproteasas "latentes" y la proenzima inactiva de uPA, pro-uPA.
Células tumorales y células no malignas del estroma tumoral sintetizan y segregan la proenzima enzimáticamente inactiva pro-uPA. Proteasas, tales como, p. ej., plasmina o las catepsinas B y L, disocian pro-uPA mediante una proteolisis limitada en la serina proteasa activa HMW-uPA (HMW - siglas inglesas de alto peso molecular). Pro-uPA y la proteasa activa HMW-uPA se unen al receptor de la superficie de la célula uPAR (CD87). Plasmina (plasminógeno) se une asimismo a receptores específicos sobre la membrana del plasma de la célula tumoral, con lo cual se consigue una focalización y amplificación de la activación del plasminógeno en el entorno inmediato de la célula tumoral. Por consiguiente, a las células invasivas se las da la posibilidad de degradar la matriz extracelular, sin eliminarse mediante proteolisis las bases necesarias para un movimiento dirigido.
En diferentes estudios de biología celular pudo demostrarse que al sistema de activador de plasminógeno asociado a las células se le otorga una particular importancia dentro de las rutas de reacción a modo de cascada de sistemas de proteolisis asociados a tumores (Wilhelm et al., The Urokinase/Urokinase receptor system: A new target for cancer therapy? En: Schmitt M., Graeff H., Kindermann G. (compiladores): Prospects in Diagnosis and Treatment of Cancer. International Congress Series, Excerpta Medica 1050, Amsterdam, Elsevier (1994) págs. 145-156). En cultivos de células de carcinoma de colon humanas se observó que su capacidad de atravesar una matriz extracelular depende del grado de saturación de los receptores del uPA con uPA activo (Hollas et al., Cancer Res. 51 (1991) 3690-3695). Igualmente, en el modelo de cultivo celular se observó una reducción del potencial invasivo de células cuando la actividad proteolítica de uPA fue inhibida por PAI-1 (Cajot et al., Proc. Natl. Acad. Sci. USA 87 (1990) 6939-6943) o por PAI-2 (Baker et al., Cancer Res. 50 (1990) 4676-4684). Un efecto equiparable se consiguió en la inhibición de la unión de uPA a la superficie de las células mediante bloqueo del receptor mediante variantes de uPA proteolíticamente inactivas (Cohen et al., Blood 78 (1991) 479-487; Kobayashi et al., Br. J. Cancer 67 (1993) 537-544). También la transfección de células de carcinoma epidermoides con un plásmido que espresa un transcrito antisentido contra una parte de uPAR, condujo, mediante la represión de la síntesis de uPAR, a disminuir la capacidad de invasión de estas células (Kook, EMBO J. 13 (1994) 3983-3991). Anticuerpos dirigidos contra uPA y PAI-1 redujeron el potencial invasivo de células de cáncer de pulmón in vitro (Liu et al., Int. J. Cancer 60 (1995) 501-506).
La influencia del sistema de activador de plasminógeno sobre el proceso de metastasización también pudo confirmarse en modelos de animales con tumores. Así, se impidió casi por completo la formación de metástasis pulmonares en embriones de gallinas, provocada por células de carcinoma humanas, mediante la adición de anticuerpos contra uPA (Ossowski y Reich, Cell 35 (1983) 611-619). Células de carcinoma humanas metastasizantes se transfectaron con un plásmido de expresión que codificaba un mutante de uPA proteolíticamente inactivo, pero que se unía a uPAR. En el modelo de ratón se demostró que las células de carcinoma, que sintetizaban uPA inactivo, tras la inyección formaban un número de metástasis significativamente menor en comparación con las células no transfectadas (Crowley et al., Proc. Natl. Acad. Sci. USA 90 (1993) 5021-5025). Tras la administración de oligonucleótidos uPA-antisentido se observó, además de ello, una inhibición de la expansión intraperitoneal de células de carcinoma de ovario humanas en ratones inmunodeficientes (Wilhelm et al., Clin. Exp. Metast. 13 (1995) 296-302).
En los últimos años se investigó intensamente la relevancia clínica de factores del sistema de activador de plasminógeno (uPA, uPAR, PAI-1 y PAI-2) para el diagnóstico de pacientes con tumores malignos sólidos. Con ello, el contenido en antígenos del uPA en distintos tumores (p. ej., mama, ovarios, estómago, pulmones, riñones, etc.) se manifestó, tanto para la supervivencia exenta de recidiva como para la muerte, como un potente factor de diagnóstico (véase, por ejemplo, Schmitt et al., J. Obstet. Gynaecol. 21 (1995) 151-165; Jaenicke et al., Breast Cancer Res. Treat. 24 (1993) 195-208; Kuhn et al., Gynecol. Oncol. 55 (1994) 401-409; Nekarda et al., Lancet 343 (1994) 117; Pedersen et al., Cancer Res. 54 (1994) 4671-4675). Asimismo, concentraciones elevadas en uPAR en cáncer de pulmón (Pedersen et al., supra) y tejido cancerígeno de mama (Duggan et al., Int. J. Cancer 61 (1995) 597-600; Ronne et al., Breast Cancer Res. Treat. 33 (1995) 199-207) así como en cáncer de estómago, tanto en el propio tejido tumoral (Heiss et al., J. Clin. Oncol. 13 (1995) 2084-2093) como en células tumorales dispersadas en la médula ósea (Heiss et al., Nature Medicine 1 (1995) 1035-1039) se correlacionan con un mal diagnóstico.
Se encontró, también, que derivados de 3-amidinofenilalanina sustituidos en la posición 2 con un radical fenilo representan inhibidores selectivos y eficaces in vivo de uPA (documento EP 1 098 651). La administración de estos compuestos en el experimento con animales tiene lugar en forma de disoluciones acuosas. Los documentos WO 02/074756 y WO 03/103644 dan a conocer el uso de otros inhibidores de uroquinasa basados en fenilalanina, al igual que el uso de derivados de 3-guanidinofenilalanina en calidad de inhibidores de uroquinasa.
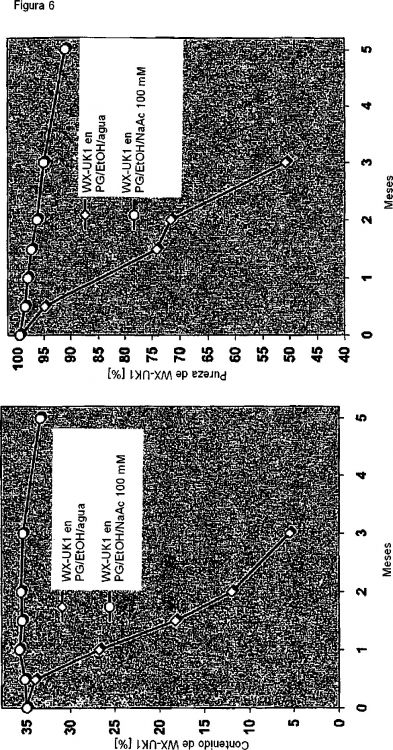
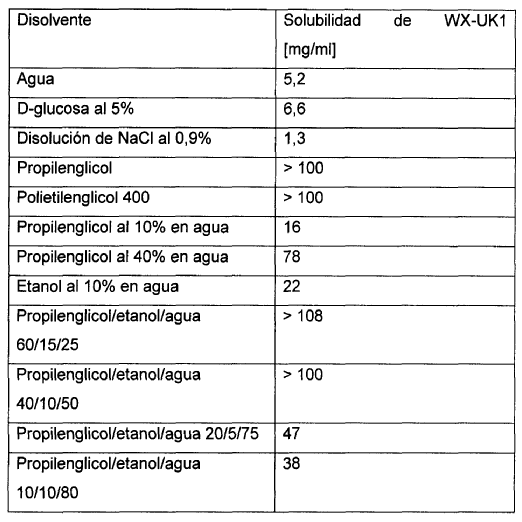
En el marco de los primeros ensayos clínicos de los compuestos arriba mencionados se ha demostrado que la administración en forma de manitol acuoso, por ejemplo D-manitol, sin la adición de disolventes orgánicos y disoluciones con contenido en propilenglicol/etanol así como sal de cocina va ligada a inconvenientes. Así, ni en disoluciones de sal de cocina ni con el uso del agente de isotonicidad manitol se puede preparar una disolución concentrada y estable de sustancia activa que no tienda a precipitaciones y a la formación de precipitados. Así, por ejemplo, en disoluciones de manitol al cinco (5) por ciento se forma, tras almacenamiento prolongado, un precipitado consistente en la sustancia activa añadida. Igualmente poco adecuadas se han manifestado formulaciones consistentes en disolventes puramente orgánicos, dado que la sustancia activa en estos disolventes no presenta la estabilidad química necesaria y tiende a descomponerse. Así, al cabo de aproximadamente 1,5 meses se inicia la descomposición de la sustancia activa a través de la formación de la amida para dar el éster, volviéndose inaprovechable la disolución de sustancia activa.
El documento WO 2004/011004 da a conocer una tanda para la estabilización de disoluciones acuosas con contenido en inhibidor de uroquinasa, basadas en fenilalanina, en forma de los denominados liposomas, micelas mixtas consistentes en diferentes fosfolípidos. Sin embargo, esta forma de estabilización no es suficiente para todas las aplicaciones, en particular tras la reconstitución con tampones fisiológicos ya no se garantizaba suficientemente la estabilidad química de la formulación liposomal.
Ensayos previos para el desarrollo...
Reivindicaciones:
1. Formulación farmacéutica, que comprende
2. Formulación farmacéutica según la reivindicación 1, en donde el tampón es un tampón acetato, en particular es un tampón acetato de sodio.
3. Formulación farmacéutica según una de las reivindicaciones precedentes, en donde el alcohol es etanol.
4. Formulación farmacéutica según una de las reivindicaciones precedentes, en donde el poliol se selecciona de glicerol, propilenglicol y polietilenglicol.
5. Formulación farmacéutica según una de las reivindicaciones precedentes, en donde el alcohol y/o el poliol está presente en aproximadamente un 20-60%, referido a la formulación total.
6. Formulación farmacéutica según una de las reivindicaciones precedentes, en donde el componente (ii) comprende una mezcla a base de poliol/alcohol en una relación de mezcla de 2:1 a 10:1.
7. Formulación farmacéutica según una de las reivindicaciones precedentes, que comprende, además, un agente de isotonicidad y/u otros coadyuvantes o combinaciones de los mismos.
8. Formulación farmacéutica según una de las reivindicaciones precedentes, en donde la sustancia activa se selecciona de Nα-(2,4,6-triisopropilfenilsulfonil)-3-amidino-(D,L)-fenilalanin-4-etoxi-carbonilpiperazida, Nα-(2,4,6-triisopropilfenilsulfonil)-3-guanidino-(D,L)-fenilalanin-4-etoxicarbonil-piperazida, los enantiómeros L de las mismas, o Nα-(2,4,6-triisopropilfenilsulfonil)-3-amidino-(L)-fenilalanin-4-etoxicarbonilpiperazida, el cloruro, hidrógeno-sulfato y/o la sal sulfato de la misma y las sales farmacéuticamente compatibles de la misma.
9. Concentrado de una formulación farmacéutica según una de las reivindicaciones precedentes, en donde la sustancia activa está presente en una concentración de hasta 100 mg/ml y el tampón está presente en una concentración de hasta 1000 mM.
10. Formulación o concentrado según una de las reivindicaciones precedentes, para uso para combatir enfermedades asociadas a uroquinasa, preferiblemente para combatir tumores, prevenir tumores, combatir y/o prevenir la formación de metástasis, de manera particularmente preferida para combatir y/o prevenir carcinoma de mama, carcinoma de páncreas y/o la formación de metástasis.
11. Formulación o concentrado según una de las reivindicaciones 1 a 9 precedentes, para combatir y/o prevenir la artritis, inflamaciones, osteoporosis, retinopatías, p. ej. degeneración de la mácula condicionada por la edad, para evitar la formación de ampollas en la enfermedad de la piel pénfigo vulgar.
12. Uso de una formulación farmacéutica o de un concentrado según una de las reivindicaciones precedentes, para la preparación de una disolución adecuada para la administración mediante inyección o infusión, mediante dilución de la formulación farmacéutica o del concentrado en un agente de isotonicidad adecuado, ascendiendo la concentración máxima de la sustancia activa hasta 1 mg/ml.
13. Uso de una formulación farmacéutica o de un concentrado según una de las reivindicaciones 1 a 9, para la preparación de un medicamento para el tratamiento y/o la prevención de una enfermedad tumoral y/o para el tratamiento y/o la prevención de la formación de metástasis.
14. Combinación que contiene una formulación farmacéutica o un concentrado según una de las reivindicaciones 1 a 9, y un agente citostático y/o citotóxico.
15. Procedimiento para la estabilización de formulaciones farmacéuticas que comprenden como sustancia activa un compuesto que presenta un grupo amidino, hidroxiamidino, guanidino y/o hidroxiguanidino, mediante adición a la sustancia activa de una cantidad adecuada de una mezcla a base de poliol/alcohol y una cantidad adecuada de una fase acuosa que comprende un tampón.
Patentes similares o relacionadas:
Análogos de (E)-N''-(1-feniletiliden) benzohidrazida sustituida como inhibidores de desmetilasas de histonas, del 15 de Julio de 2020, de UNIVERSITY OF UTAH RESEARCH FOUNDATION: Un compuesto que tiene una estructura representada por una fórmula: **(Ver fórmula)** en donde m es 1; n es un número entero de 0 a […]
Antagonista del receptor NK1, del 27 de Mayo de 2020, de KISSEI PHARMACEUTICAL CO., LTD.: Un compuesto representado por la fórmula (I): **(Ver fórmula)** donde W es un átomo de hidrógeno o un átomo de flúor; el anillo A es un […]
Formulación granular compleja con estabilidad mejorada, que comprende levocetirizina y montelukast, del 13 de Mayo de 2020, de HANMI PHARM. CO., LTD.: Una formulación granular compleja que comprende: (a) una primera parte granular que comprende levocetirizina o una sal farmacéuticamente aceptable de la misma, ciclodextrina […]
Composiciones y compuestos terapéuticos, del 6 de Mayo de 2020, de Agios Pharmaceuticals, Inc: Un compuesto de Fórmula (I) o una sal del mismo farmacéuticamente aceptable, en donde: **(Ver fórmula)** A es arilo o heteroarilo, en donde el arilo o heteroarilo […]
Composiciones farmacéuticas para terapia de combinación, del 29 de Abril de 2020, de Acesion Pharma ApS: Una combinación de (i) un inhibidor del canal de potasio (SK) activado por calcio de pequeña conductancia, o una sal o solvato farmacéuticamente aceptable de este; […]
Combinaciones de inhibidores de histona desacetilasa y fármacos inmunomoduladores, del 29 de Abril de 2020, de Acetylon Pharmaceuticals, Inc: Una combinación farmacéutica para su uso en el tratamiento del linfoma que comprende una cantidad terapéuticamente eficaz de un inhibidor específico de histona desacetilasa […]
Formulaciones farmacéuticas de liberación controlada de nitazoxanida, del 15 de Abril de 2020, de ROMARK LABORATORIES, L.C.: Composición farmacéutica en forma de una forma de dosificación oral sólida que comprende: (a) una primera parte que comprende una primera […]
Composiciones congeladas fluidas que comprenden un agente terapéutico, del 8 de Abril de 2020, de Tavakoli, Zahra: Una composición fluida congelada que comprende un agente terapéutico y al menos un agente aromatizante para su uso en terapia, donde dicha composición […]