ESQUEMA DE SINTESIS MEJORADA PARA LACOSAMIDA.
Método para producir (R)-2-acetamido-N-bencil-3-metoxipropionamida (lacosamida), que comprende la O-metilación de un compuesto de fórmula I
Tipo: Patente Internacional (Tratado de Cooperación de Patentes). Resumen de patente/invención. Número de Solicitud: PCT/EP2005/010603.
Solicitante: UCB PHARMA GMBH.
Nacionalidad solicitante: Alemania.
Dirección: ALFRED-NOBEL-STRASSE 10,40789 MONHEIM.
Inventor/es: RIEDNER,JENS, DUNNE,GAVIN.
Fecha de Publicación: .
Fecha Concesión Europea: 17 de Febrero de 2010.
Clasificación Internacional de Patentes:
- C07C231/02 QUIMICA; METALURGIA. › C07 QUIMICA ORGANICA. › C07C COMPUESTOS ACICLICOS O CARBOCICLICOS (compuestos macromoleculares C08; producción de compuestos orgánicos por electrolisiso electroforesis C25B 3/00, C25B 7/00). › C07C 231/00 Preparación de amidas de ácidos carboxílicos. › a partir de ácidos carboxílicos o a partir de sus ésteres, anhídridos o haluros por reacción con amoniaco o aminas.
- C07C273/18B
- C07C273/18D
- C07C275/10 C07C […] › C07C 275/00 Derivados de urea, es decir, compuestos que contienen uno de los grupos en que los átomos de nitrógeno no forman parte de grupos nitro o nitroso. › que está sustituida por átomos de oxígeno unidos por enlaces sencillos.
- C07C275/16 C07C 275/00 […] › que está sustituida por grupos carboxilo.
Clasificación PCT:
- C07C231/02 C07C 231/00 […] › a partir de ácidos carboxílicos o a partir de sus ésteres, anhídridos o haluros por reacción con amoniaco o aminas.
- C07C273/18 C07C […] › C07C 273/00 Preparación de urea o sus derivados, es decir, de compuestos que contienen uno de los grupos en que los átomos de nitrógeno no forman parte de grupos nitro o nitroso. › de ureas sustituidas.
- C07C275/10 C07C 275/00 […] › que está sustituida por átomos de oxígeno unidos por enlaces sencillos.
- C07C275/16 C07C 275/00 […] › que está sustituida por grupos carboxilo.
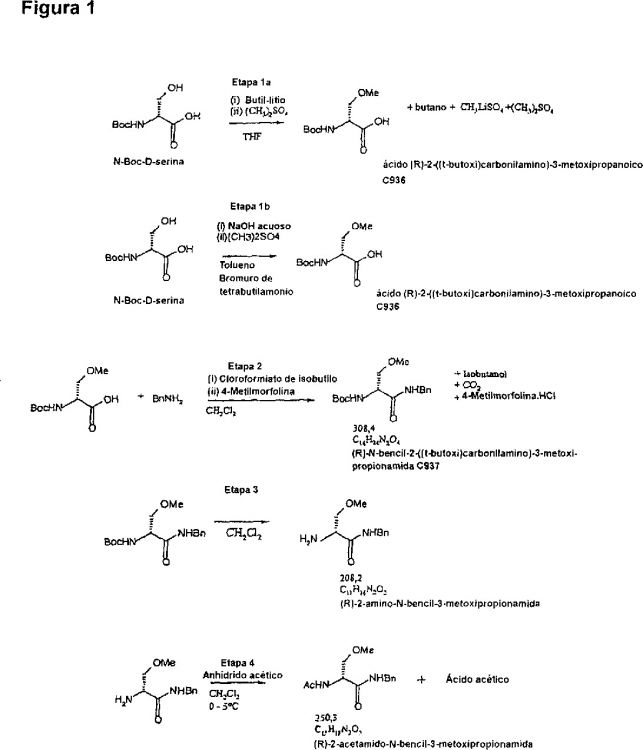
Fragmento de la descripción:
Esquema de síntesis mejorada para lacosamida.
La (R)-2-acetamido-N-bencil-3-metoxipropionamida (DCI recomendada: lacosamida) es un fármaco anticonvulsionante útil para tratar epilepsia y dolor. En el documento US 6.048.899 se describen dos métodos para producir este compuesto.
El esquema 2 del documento US 6.048.899 comprende la formación de bencilamida antes de la O-metilación. Sin embargo, este esquema de reacción da como resultado diversas impurezas que se deben de eliminar mediante cromatografía, lo que no es práctico en una escala industrial. También, el rendimiento de las etapas individuales es sólo entre 80 y 85%.
El esquema 1 del documento US 6.048.899 implica la O-metilación de una D-serina N-protegida antes de la formación, N-desprotección y N-acetilación de la bencilamida. Aunque este esquema de producción es un punto de partida más prometedor para un aumento de escala, sufre deficiencias importantes. La más importante, la O-metilación de D-serina N-protegida usando óxido de plata (I) y yoduro de metilo no es práctica y es cara, y da como resultado la racemización parcial (alrededor de 15%), lo que reduce el rendimiento de esta etapa hasta 79%. También, la eliminación del enantiómero S durante la producción de (R)-2-acetamido-N-bencil-3-metoxipropionamida es extremadamente difícil.
Chen F.M.F. et al., J. Org. Chem., 44, 2299-2300 (1979) describe preparaciones de N-Boc-O-metil-L-serina y N-Boc-O-metil-L-treonina mediante metilación directa usando como base metóxido de sodio.
Barlos K. et al., Tetrahedron, 39, 475-478 (1983) describe la síntesis de N-tritil-O-alquil-L-hidroxiaminoácidos usando como base hidruro de sodio.
Varga J.R. et al., Acta Chimica Hungarica, 120, 247-249 (1985) describe la síntesis de N-benciloxicarbonil-(3,4-dibenciloxifenil)-O-metilserina usando como base hidruro de sodio.
Sorprendentemente, ahora se ha detectado que se puede evitar la racemización usando métodos alternativos de O-metilación, a saber, la O-metilación usando catálisis de transferencia de fases, u O-metilación usando organolitio y un agente de metilación adecuado, tal como sulfato de dimetilo.
También, la presente invención proporciona una ruta de síntesis mejorada de lacosamida, en la que el método de O-metilación es selectivo para el grupo hidroxi alcohólico de la D-serina N-protegida. En consecuencia, comparada con la metilación no específica sugerida en el esquema 1 del documento US 6.048.899, que también conduce a la esterificación del grupo carboxílico, la presente invención da como resultado una síntesis más corta, más eficaz, en la que se evita la etapa subsiguiente de hidrolizar el grupo éster metílico de un intermedio.
En consecuencia, la presente invención se refiere a un método mejorado para producir (R)-2-acetamido-N-bencil-3-metoxipropionamida, que comprende la O-metilación de un compuesto de fórmula I

para producir un compuesto de fórmula II

en la que Rx es un grupo N-protector,
caracterizado porque la O-metilación se lleva a cabo en una reacción de una etapa, y en el que se evita la racemización, de forma que el compuesto de fórmula II se obtiene como un enantiómero R de al menos 88%, preferiblemente al menos 90%, e incluso más preferido de al menos 95, 96, 97, 98 ó 99% de pureza enantiomérica.
La expresión "reacción de una etapa", como se usa en esta Solicitud de patente, significa que, cuando se transforma un compuesto de fórmula I en un compuesto de fórmula II, no se forma una cantidad significativa (es decir, una cantidad de 5% en moles o más) de éster del grupo carboxilo que necesite ser hidrolizada en una etapa separada. Habitualmente, incluso se forma menos de 1% en moles de éster, que se elimina entonces durante el procesamiento adicional a lacosamida como se describe adicionalmente más abajo sin la necesidad de ninguna etapa de hidrólisis adicional.
El método para producir (R)-2-acetamido-N-bencil-3-metoxipropionamida de la presente invención se lleva a cabo (a) como una catálisis de transferencia de fases, o (b) añadiendo un agente de metilación y un compuesto de organolitio al compuesto de fórmula I.
La O-metilación inventiva se puede lograr añadiendo a un compuesto de fórmula I, tal como, por ejemplo, a N-Boc-D-serina, un agente de metilación en presencia de un compuesto de organolitio. Los agentes de metilación adecuados son, por ejemplo, sulfato de dimetilo, fosfato de trimetilo o yoduro de metilo, siendo particularmente preferido el sulfato de dimetilo. El compuesto de organolitio es preferiblemente un compuesto de alquil-litio, tal como butil-litio, metil-litio o hexil-litio, o un compuesto de aril-litio, tal como fenil-litio. Más preferiblemente, el compuesto de organolitio es t-butil-litio o n-butil-litio, y particularmente se prefiere n-butil-litio. Como disolvente, se pueden usar mezclas de THF/2-metoxietiléter, dietoximetano, o, preferiblemente, THF. La reacción se deja transcurrir habitualmente durante al menos 5 horas a 0-10ºC, y preferiblemente durante 7-24 horas a 0-10ºC, lo más preferible durante 9-18 horas a 0-5ºC. También, la reacción se puede llevar a cabo a mayores o menores temperaturas, tal como cualquier temperatura entre -10 y +25ºC si el tiempo de reacción se adapta en consecuencia.
Si el grupo N-protector Rx del compuesto de fórmula I es N-Boc, una reacción típica se puede ilustrar mediante el siguiente esquema (etapa 1-A)

Sorprendentemente, este procedimiento no da como resultado la formación de éster metílico ni la racemización significativa del producto. El rendimiento experimental es 91%, siendo las impurezas principales N-metilaciones (por ejemplo, Ejemplo 1). Por lo tanto, el rendimiento de la metilación según el método de la presente invención usando un compuesto de organolitio puede ser al menos 85%, preferiblemente al menos 90%.
Típicamente, la cantidad de impureza de éster tras la metilación usando un compuesto de organolitio, en particular después de la etapa 1a, es significativamente menor que 1% en moles, preferiblemente menor que 0,1% en moles, y normalmente es menor que el límite de detección.
En una ruta alternativa, la O-metilación selectiva del grupo alcohólico de D-serina N-protegida se lleva a cabo mediante catálisis de transferencia de fases ("PTC"). La PTC es un método que hace uso de sistemas bifásicos heterogéneos - siendo una fase una fase acuosa o sólida y un depósito de aniones reaccionantes o una base para la generación de aniones orgánicos, mientras que los agentes reaccionantes orgánicos y los catalizadores se localizan en la segunda fase orgánica.
Habitualmente, como catalizador de transferencia de fases se usa una sal de amonio cuaternario, fosfonio o sulfonio, tal como, por ejemplo, un haluro de tetraalquilamonio. Los catalizadores y reactivos de PTC adecuados se pueden adquirir de muchos proveedores, por ejemplo de Sigma-Aldrich o Hawks Chemical.
En consecuencia, una realización de la presente invención se refiere a un método para producir lacosamida, caracterizado porque un compuesto de fórmula I se O-metila en un compuesto de fórmula II llevando a cabo la reacción como una catálisis de transferencia de fases.
Típicamente, este método comprende la adición de un reactivo de metilación, tal como sulfato de dimetilo, yoduro de metilo, o fosfato de trimetilo, a un sistema de reacción de transferencia de fases que comprende el compuesto de fórmula I, una fase acuosa, una fase orgánica y un catalizador de transferencia de fases.
En la PTC de la presente invención, preferiblemente
Reivindicaciones:
1. Método para producir (R)-2-acetamido-N-bencil-3-metoxipropionamida (lacosamida), que comprende la O-metilación de un compuesto de fórmula I

para producir un compuesto de fórmula II

en la que Rx es un grupo N-protector,
caracterizado porque
la O-metilación se lleva a cabo en una reacción de una etapa, y en el que el compuesto de fórmula II se obtiene como un enantiómero R de al menos 88% de pureza, y
el método se lleva a cabo (a) como una catálisis de transferencia de fases, o (b) añadiendo un agente de metilación y un compuesto de organolitio al compuesto de fórmula I.
2. Método según la reivindicación 1, en el que el método comprende la adición de un agente de metilación a un sistema de reacción de transferencia de fases que comprende el compuesto de fórmula I, una fase acuosa, una fase orgánica y un catalizador de transferencia de fases.
3. Método según la reivindicación 2, en el que se usa una sal de piridinio, de fosfonio, de amonio o de sulfonio como catalizador de transferencia de fases.
4. Método según cualquiera de las reivindicaciones 2-3, en el que el catalizador de transferencia de fases se elige de los compuestos de
(a) fórmula general IV

(b) fórmula general V

o
(c) fórmula general VI

en las que
5. Método según cualquiera de las reivindicaciones 2-4, en el que el catalizador de transferencia de fases es bromuro de tetrabutilamonio.
6. Método según cualquiera de las reivindicaciones 2-5, en el que el agente metilante usado en la catálisis de transferencia de fases se elige de sulfato de dimetilo, fosfato de trimetilo o yoduro de metilo.
7. Método según cualquiera de las reivindicaciones 2-6, en el que la fase acuosa es hidróxido sódico acuoso, hidróxido de litio acuoso, hidróxido potásico acuoso, carbonato de sodio acuoso o carbonato de potasio acuoso.
8. Método según cualquiera de las reivindicaciones 2-7, en el que el disolvente orgánico es tolueno, hexano, cloruro de metileno o metil-t-butil-éter.
9. Método según cualquiera de las reivindicaciones 1-8, en el que la catálisis de transferencia de fases se lleva a cabo a 0-10ºC durante al menos 30 minutos.
10. Método según la reivindicación 1, en el que el agente de metilación usado con el compuesto de organolitio es sulfato de dimetilo.
11. Método según cualquiera de las reivindicaciones 1 ó 10, en el que el compuesto de organolitio es butil-litio.
12. Método según las reivindicaciones 1 ó 10 a 11, en el que la O-metilación en presencia de un compuesto de organolitio tiene lugar a una temperatura de 0-10ºC durante al menos 5 h.
13. Método según cualquiera de las reivindicaciones anteriores, que comprende además la reacción del compuesto II con bencilamina para dar el compuesto de fórmula III,

y sustituir entonces el grupo protector Rx por metilcarbonilo para dar (R)-2-acetamido-N-bencil-3-metoxipropionamida (lacosamida).
14. Método según la reivindicación 13, en el que la reacción del compuesto de fórmula II con bencilamina tiene lugar en presencia de un activador del grupo carboxilo y una base.
15. Método según la reivindicación 14, en el que la base es 4-metilmorfolina, trietilamina, diisopropiletilamina, 1,8-diazabiciclo[5.4.0]undec-7-eno o bicarbonato potásico, y el activador del grupo carboxilo es un cloroformiato de alquilo o una carbodiimida.
16. Método según cualquiera de las reivindicaciones 13-15, en el que el grupo N-protector Rx se sustituye por metilcarbonilo sucesivamente
17. Método según la reivindicación 16, en el que la etapa (b) se lleva a cabo en ausencia de piridina.
18. Método según cualquiera de las reivindicaciones 13-15, en el que el grupo N-protector Rx se separa por escisión para obtener (R)-2-amino-N-bencil-3-metoxipropionamida.
19. Método según cualquiera de las reivindicaciones anteriores, en el que se aísla lacosamida de la mezcla de reacción final mediante cristalización.
20. Método según cualquiera de las reivindicaciones anteriores, en el que el grupo N-protector es t-butiloxicarbonilo (Boc).
21. Método según cualquiera de las reivindicaciones anteriores, que comprende la etapa de N-acetilar (R)-2-amino-N-bencil-3-metoxipropionamida con anhídrido acético en ausencia de una base, en particular en ausencia de piridina.
22. Método según una cualquiera de las reivindicaciones anteriores, en el que el compuesto de fórmula II es ácido (R)-2-N-Boc-amino-3-metoxipropanoico (C-936) o sus sales.
23. Método según una cualquiera de las reivindicaciones 13-18, en el que el compuesto de fórmula III es (R)-N-bencil-2-N-Boc-amino-3-metoxipropionamida (C-937) o cualquier sal de la misma.
24. Uso de (R)-N-bencil-2-N-Boc-amino-3-metoxipropionamida (C-937) o cualquier sal de la misma en un método según las reivindicaciones 1 a 22 para producir (R)-2-acetamido-N-bencil-3-metoxipropionamida (lacosamida).
25. Método para producir una formulación farmacéutica que comprende lacosamida mediante las etapas subsiguientes de
26. Método según cualquiera de las reivindicaciones 1 a 22, que comprende además producir N-Boc-D-serina haciendo reaccionar D-serina con dicarbonato de di-t-butilo en una reacción de transferencia de fases.
27. Método para producir un compuesto de fórmula VIII, que comprende la O-metilación de un compuesto de fórmula VII,

para producir un compuesto de fórmula VIII,

en las que R1, R2 y R3 se seleccionan independientemente de hidrógeno, -OH, -SH, -NH2, -NO2, -CN, -COOH, -SOH, -SO2H, -SO3H, halógeno, -OR10, -SR10, -NR10R11, -SOR10, -SO2R10, -SO3R10, alquilo sustituido o no sustituido, alquenilo de C2-C6 sustituido o no sustituido, alquinilo de C2-C6 sustituido o no sustituido, -(CO)-R10, -(CO)-O-R10, -O-(CO)-R10, arilo sustituido o no sustituido, hetarilo de C3-C13 sustituido o no sustituido que tiene 1-3 heteroátomos seleccionados independientemente de N, S, O, aralquilo sustituido o no sustituido, alcarilo de C7-C15 sustituido o no sustituido, hetaralquilo de C4-C14 sustituido o no sustituido que tiene 1-3 heteroátomos seleccionados independientemente de N, S, O; alquilhetarilo de C4-C14 sustituido o no sustituido que tiene 1-3 heteroátomos seleccionados independientemente de N, S, O; y cicloalquilo de C3-C12 sustituido o no sustituido que tiene 0-3 heteroátomos seleccionados independientemente de N, S, O,
en las que R4 se selecciona de R1 y grupos N-protectores, y en los que R10 y R11 se seleccionan independientemente de hidrógeno, alquilo sustituido o no sustituido, alquenilo de C2-C6 sustituido o no sustituido, alquinilo de C2-C6 sustituido o no sustituido, arilo sustituido o no sustituido, hetarilo de C3-C13 sustituido o no sustituido que tiene 1-3 heteroátomos seleccionados independientemente de N, S, O, aralquilo sustituido o no sustituido, alcarilo de C7-C15 sustituido o no sustituido, hetaralquilo de C4-C14 sustituido o no sustituido que tiene 1-3 heteroátomos seleccionados independientemente de N, S, O; alquilhetarilo de C4-C14 sustituido o no sustituido que tiene 1-3 heteroátomos seleccionados independientemente de N, S, O; y cicloalquilo de C3-C12 sustituido o no sustituido que tiene 0-3 heteroátomos selccionados independientemente de N, S, O,
caracterizado porque la O-metilación se lleva a cabo en una reacción de una etapa en la que el compuesto de fórmula VIII se obtiene en la misma configuración que el compuesto VII con al menos 88% de pureza, y el método se lleva a cabo (a) como una catálisis de transferencia de fases, o (b) añadiendo un agente de metilación y un compuesto de organolitio al compuesto de fórmula VII.
28. Método de la reivindicación 27, en el que R1 es H, R2 es H y R3 es H, y R4 es un grupo N-protector.
29. Método de cualquiera de las reivindicaciones 27 ó 28, en el que el compuesto VII está en la configuración R.
Patentes similares o relacionadas:
Procedimiento para preparación de N-isopropil(met)acrilamida, del 25 de Marzo de 2020, de Evonik Operations GmbH: Procedimiento para la preparación de amidas del ácido (met)acrílico, caracterizado por que el anhídrido del ácido (met)acrílico se hace reaccionar con una amina primaria […]
Método para preparar sin disolvente el producto intermedio de la pregabalina, ácido 3-carbamoimetil-5-metilhexanoico, del 26 de Febrero de 2020, de ZHEJIANG HUAHAI PHARMACEUTICAL CO., LTD: Un método para preparar sin disolvente orgánico ácido 3-carbamoimetil-5-metilhexanoico, producto intermedio de la pregabalina, caracterizado porque el método comprende […]
Procedimiento para preparar derivados de quinolina, del 20 de Noviembre de 2019, de EXELIXIS, INC: Un proceso para preparar un compuesto de Fórmula A: **(Ver fórmula)** en la que R2 es H, F, Cl, o Br; que comprende (a) poner en contacto […]
Uso de derivados especiales de compuestos cuaternizados de nitrógeno, como aditivos en combustibles, del 22 de Octubre de 2019, de BASF SE: Uso de un producto de reacción que comprende un compuesto de nitrógeno cuaternizado o una fracción parcial del mismo que contiene un compuesto de […]
Compuesto de imida, método para fabricarlo y uso como insecticida, del 25 de Septiembre de 2019, de MITSUI CHEMICALS AGRO, INC: Un compuesto de imida representado por la Fórmula siguiente:**Fórmula** en donde, en la Fórmula , cada uno de A1, A2, A3 y A4 representa independientemente […]
Electrolito que comprende beta-aminoácidos y método para la deposición de una capa de metal, del 30 de Mayo de 2019, de MacDermid Enthone Inc: Un método para la deposición no galvánica de una capa de metal sobre un sustrato, que comprende poner en contacto el sustrato a revestir con una formulación […]
Síntesis eficiente de aminas y amidas a partir de alcoholes y aldehídos usando catálisis en cascada, del 1 de Mayo de 2019, de Organofuel Sweden AB: Método para la conversión de un alcohol que comprende las etapas de: a. convertir dicho alcohol en un aldehído o una cetona, b. convertir dicho aldehído […]
Nueva síntesis quiral de N-acil-(3-sustituida)-(8-sustituida)-5,6-dihidro-[1,2,4]triazolo [4,3-a] pirazinas, del 30 de Abril de 2019, de OGEDA SA: Un procedimiento de preparación de N-acil-(3-sustituida)-(8-sustituida)-5,6-dihidro-[1,2,4]triazolo[4,3-a] pirazina quiral de fórmula general I:**Fórmula** o solvatos […]