COMPOSICION FARMACEUTICA QUE COMPRENDE DROSPIRENONA Y ETINILESTRADIOL.
Una composición farmacéutica que comprende drospirenona y etinilestradiol en forma amorfa,
adsorbidos sobre un soporte sólido terapéuticamente inerte, en combinación con excipientes farmacéuticamente aceptables, caracterizada porque la composición comprende cantidades medibles del disolvente volátil cloruro de metileno
Tipo: Patente Internacional (Tratado de Cooperación de Patentes). Resumen de patente/invención. Número de Solicitud: PCT/EP2005/053759.
Solicitante: LABORATORIOS LICONSA, S.A.
Nacionalidad solicitante: España.
Inventor/es: SANDRONE,CARLOS,ARIEL, SAKSON,JOSE,MARIO, CAJARVILLE BASAISTEGUI,MARIA DEL CARMEN, LARROSA POMI,JOSE,DANIEL.
Fecha de Publicación: .
Fecha Concesión Europea: 14 de Abril de 2010.
Clasificación Internacional de Patentes:
- A61K31/565 NECESIDADES CORRIENTES DE LA VIDA. › A61 CIENCIAS MEDICAS O VETERINARIAS; HIGIENE. › A61K PREPARACIONES DE USO MEDICO, DENTAL O PARA EL ASEO (dispositivos o métodos especialmente concebidos para conferir a los productos farmacéuticos una forma física o de administración particular A61J 3/00; aspectos químicos o utilización de substancias químicas para, la desodorización del aire, la desinfección o la esterilización, vendas, apósitos, almohadillas absorbentes o de los artículos para su realización A61L; composiciones a base de jabón C11D). › A61K 31/00 Preparaciones medicinales que contienen ingredientes orgánicos activos. › no sustituidos en posición 17 beta por un átomo de carbono, p. ej. estrano, estradiol.
- A61K31/57 A61K 31/00 […] › sustituidos en posición 17 beta por una cadena con dos átomos de carbono, p. ej. pregnano, progesterona.
Clasificación PCT:
- A61K31/565 A61K 31/00 […] › no sustituidos en posición 17 beta por un átomo de carbono, p. ej. estrano, estradiol.
- A61K31/57 A61K 31/00 […] › sustituidos en posición 17 beta por una cadena con dos átomos de carbono, p. ej. pregnano, progesterona.
- A61P15/18 A61 […] › A61P ACTIVIDAD TERAPEUTICA ESPECIFICA DE COMPUESTOS QUIMICOS O DE PREPARACIONES MEDICINALES. › A61P 15/00 Medicamentos para el tratamiento de trastornos genitales o sexuales (para trastornos de las hormonas sexuales A61P 5/24 ); Anticonceptivos. › Anticonceptivos femeninos.
Fragmento de la descripción:
Composición farmacéutica que comprende drospirenona y etinilestradiol.
Campo de la invención
La presente invención se refiere a una composición farmacéutica que comprende drospirenona y etinilestradiol con una velocidad de disolución mejorada. Además, la invención se refiere a un método para preparar una formulación farmacéutica que comprende drospirenona y etinilestradiol de modo de mejorar su perfil de disolución. Dicha formulación puede ser utilizada para producir un efecto anovulatorio cuando se administra correctamente en humanos.
Antecedentes de la invención
Es conocido que las hormonas sexuales estrogénicas y progestágenas son prácticamente insolubles en agua o se disuelven tan lentamente que sus propiedades biofarmacéuticas se ven afectadas directamente por este comportamiento o características.
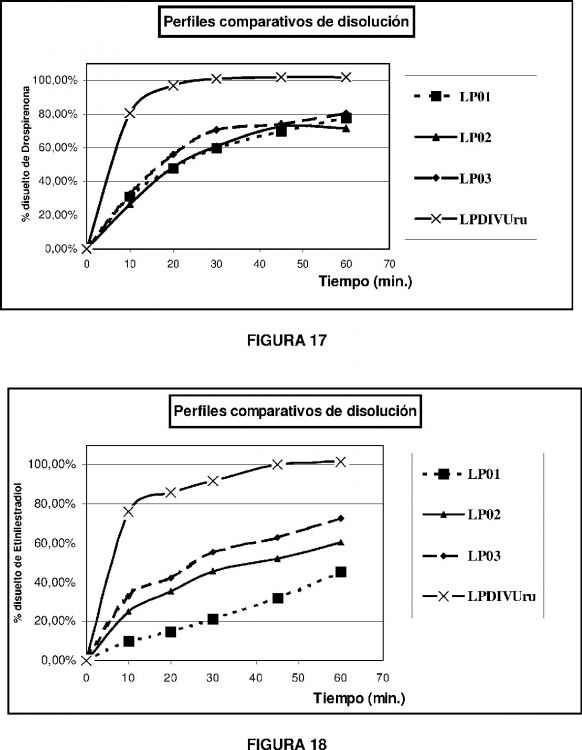
En particular, el progestágeno sintético drospirenona, ó 6ß,7ß,15ß,16ß-dimetilen-3-oxo-17a-pregn-4-en-21,17-carbolactona, conocido a partir de las patentes DE3022337 y DE2652761, en su estado cristalino tiene una forma de "espátula" tal como se muestra en las microfotografías de la Figura 1 con aumento de 200X con tamaños no menores a 50 micrones. La velocidad de disolución de este cristal en formulaciones farmacéuticas orales tales como comprimidos, muestra una velocidad de disolución muy lenta tal como se muestra aquí en la Figura 17 (ver lotes LP01, LP02 y LP03).
La solicitud publicada EP1216712A1 describe la preparación de complejos de inclusión entre ciclodextrina y drospirenona con el propósito de aumentar la solubilidad en agua de la drospirenona.
La biodisponibilidad de un fármaco puede estar limitada por una pobre disolución de la misma en los fluidos acuosos corporales, particularmente los fluidos gástricos, inmediatamente después de la administración. La velocidad de disolución puede por tanto ser crítica para alcanzar rápidamente los niveles terapéuticamente efectivos del fármaco o adicionalmente, como en el caso de la drospirenona, puede verse influenciada por una degradación del ingrediente activo debido a un contacto prolongado con los fluidos gástricos de un pH muy bajo, tal como se describe en la solicitud PCT WO 01/15701 (de la familia de patentes de EP1214076B1).
Este comportamiento se demuestra in vitro, en un medio ácido (HCl 0,1 N), para muestras de drospirenona con diferentes tamaños de partículas (ver Figura 16). Se observa que la presencia del fármaco en el medio ácido disminuye rápidamente, después de una disolución inicial, independientemente del tamaño de partículas. Por lo tanto, la biodisponibilidad de la drospirenona está doblemente afectada por la baja velocidad de disolución en medio acuoso y por la rápida degradación debida un contacto prolongado con los fluidos gástricos de un pH muy bajo.
La patente publicada EP1214076B1 describe una composición farmacéutica que contiene drospirenona y etinilestradiol donde la drospirenona está en forma micronizada, de modo que las partículas de la sustancia activa tienen un área superficial de más de 10.000 cm2/g, y una distribución de tamaño de partículas determinado bajo el microscopio donde no más de dos partículas en un lote dado tienen un diámetro de más de 30 µm, y preferiblemente 20 partículas o menos tienen un diámetro de entre 10 µm y 30 µm, aumentando así su velocidad de disolución y en particular para el uso en anticoncepción por vía oral.
Adicionalmente, la última parte de la sección [0017] de EP1214076B1 dice "En lugar de proveer la drospirenona en forma micronizada, es posible disolverla en un disolvente adecuado, por ejemplo metanol o acetato de etilo, y rociarla sobre la superficie de partículas de un portador inerte seguido de la incorporación de las partículas que contienen drospirenona sobre su superficie a la composición." Sin embargo, esta sección aparece aislada en la descripción de EP121407B1. Todos los ejemplos de preparación más las principales reivindicaciones independientes están referidas a la forma micronizada.
Resumen de la invención
El problema a resolver por la presente invención es proveer una composición farmacéutica de drospirenona y etinilestradiol con una velocidad de disolución mejorada en agua y en fluidos corporales y una biodisponibilidad mejorada.
Los presentes inventores han encontrado que mediante una composición farmacéutica de drospirenona y etinilestrasdiol en una forma amorfa, sin la presencia de un estado cristalino, se pueden mejorar los perfiles de disolución de ambos ingredientes activos, aumentando así su biodisponibilidad.
Asimismo, los presentes inventores han demostrado que el uso del disolvente volátil cloruro de metileno y, en particular, el uso de la combinación de una mezcla de los disolventes cloruro de metileno y metanol proporciona resultados de velocidad de disolución significativamente mejores que con el uso de metanol sólo. Para más detalles, véanse por ejemplo la Tabla 2 del Ejemplo 4 y la Tabla 3 del Ejemplo 5. El uso de metanol solo se sugiere teóricamente en el documento de la técnica previo EP1214076B1 (véase arriba).
Tal como se explica en la presente, el disolvente volátil cloruro de metileno se utiliza para disolver los fármacos. En el posterior paso de granulación, se seca hasta que se alcanzan niveles residuales de disolvente muy bajos (véase el Ejemplo 1). Sin embargo, aunque dichos niveles sean bajos, el experto sabe que es aún posible medir pequeñas cantidades del disolvente volátil de interés en la composición farmacéutica final. El experto sabe que esto puede hacerse, por ejemplo, mediante el uso de cromatografía de gases (GC) y espectrometría de masa (EM).
Por lo tanto, un primer aspecto de la presente invención se refiere a una composición farmacéutica que comprende drospirenona y etinilestradiol en una forma amorfa, adsorbidos sobre un soporte sólido terapéuticamente inerte, en combinación con excipientes farmacéuticamente aceptables, caracterizada porque la composición comprende cantidades medibles del disolvente volátil cloruro de metileno.
Tal como se ha mencionado arriba, en la presente invención se prefiere utilizar una mezcla de los disolventes cloruro de metileno y metanol. Por consiguiente, en una realización preferida la composición del primer aspecto se caracteriza porque la composición comprende cantidades mensurables de ambos disolventes volátiles: cloruro de metileno y metanol.
La velocidad de disolución de la drospirenona y el etinilestradiol se incrementa introduciendo cambios en su estructura cristalina, de forma tal que la energía necesaria para disolver el fármaco sea mucho más baja. En tal caso, la velocidad de disolución aumentará considerablemente, lográndose así un aumento en la velocidad de absorción de los fármacos. De esta manera se reduce el tiempo de contacto de los fármacos con el medio gástrico donde el pH es demasiado bajo, evitando así las eventuales reacciones de degradación por hidrólisis de los fármacos sensibles, tal como se ha mencionado anteriormente.
Es por lo tanto un objeto de la presente invención proporcionar una composición farmacéutica que contiene drospirenona y etinilestradiol en una forma amorfa, sin la presencia de estado cristalino, partiendo preferiblemente de droga no micronizada y utilizando en su preparación disolventes de disolución/granulación adecuados.
Sorprendentemente, se ha encontrado que la mayor velocidad de disolución se obtiene por solubilización de drospirenona y etinilestradiol en la combinación adecuada de una mezcla de los disolventes cloruro de metileno y metanol y posterior adsorción sobre excipientes inertes farmacéuticamente adecuados.
Se ha observado que el uso de otro disolvente, tal como etanol, incluso con el uso de calor, a pesar de disolver el fármaco, no permite la aplicación sobre los excipientes farmacéuticamente adecuados.
Adicionalmente, el uso de cloruro de metileno y en particular el uso de la combinación de una mezcla de los disolventes cloruro de metileno y metanol proporciona resultados mejorados con respecto al uso de metanol solo.
La nueva composición farmacéutica de la invención está diseñada para proporcionar una rápida disolución de drospirenona y etinilestradiol en agua como disolvente de referencia.
Más particularmente, la invención proporciona una composición en forma de partículas sólidas que comprende drospirenona y etinilestradiol en estado amorfo adsorbidos sobre un soporte terapéuticamente...
Reivindicaciones:
1. Una composición farmacéutica que comprende drospirenona y etinilestradiol en forma amorfa, adsorbidos sobre un soporte sólido terapéuticamente inerte, en combinación con excipientes farmacéuticamente aceptables, caracterizada porque la composición comprende cantidades medibles del disolvente volátil cloruro de metileno.
2. La composición farmacéutica según la reivindicación 1, caracterizada porque la composición comprende cantidades medibles de los dos disolventes volátiles cloruro de metileno y metanol.
3. La composición farmacéutica según las reivindicaciones 1 ó 2, donde el soporte sólido inerte se elige de entre partículas seleccionadas del grupo consistente en almidón de maíz, almidón pregelatinizado, lactosa, croscarmelosa sódica, óxido de hierro amarillo y polivinilpirrolidona o de mezclas de uno o más de ellos, en combinación con excipientes farmacéuticamente aceptables.
4. La composición farmacéutica según cualquiera de las reivindicaciones 1 a 3, caracterizada porque por lo menos el 80% de la drospirenona y por lo menos el 80% del etinilestradiol se disuelven desde dicha composición en 20 minutos en un ensayo realizado en un aparato de disolución de acuerdo con la Farmacopea de los Estados Unidos, Edición número 27, Aparato 2, en 900 ml de agua destilada a 37ºC y agitados a 50 rpm.
5. Un método para preparar la composición farmacéutica de cualquiera de las reivindicaciones anteriores, que comprende las siguientes etapas:
6. El método de la reivindicación 5, en donde el disolvente volátil es una mezcla de de cloruro de metileno y metanol.
7. El método de la reivindicación 6, en donde la mezcla de cloruro de metileno y metanol es una mezcla de cloruro de metileno/metanol [9 a 4]:[3 a 0,5] v/v.
8. El método de la reivindicación 7, en donde la mezcla de cloruro de metileno es una mezcla de cloruro de metileno/metanol 6:1 v/v.
9. El método de cualquiera de las reivindicaciones 5 a 8, en donde en el paso 2 de la reivindicación 5 se agrega un polímero soluble en agua.
10. El método de la reivindicación 9, en donde el polímero soluble en agua es polivinilpirrolidona.
11. El método de cualquiera de las reivindicaciones 5 a 10, en donde el soporte sólido, terapéuticamente inerte, se selecciona de entre partículas de almidón de maíz, almidón pregelatinizado, lactosa, croscarmelosa sódica, óxido de hierro amarillo, polivinilpirrolidona o de mezclas de uno o más de ellos.
12. El método de cualquiera de las reivindicaciones 5 a 11, en donde adicionalmente el adsorbato granulado secado se combina con excipientes farmacéuticamente aceptables para la compresión de los comprimidos.
Patentes similares o relacionadas:
Unidad de dosificación orodispersable que contiene un componente de estetrol, del 29 de Abril de 2020, de Estetra SPRL: Una unidad de dosificación farmacéutica sólida orodispersable que tiene un peso entre 30 y 1.000 mg, y dicha unidad de dosificación consiste […]
Suministro transdérmico, del 8 de Abril de 2020, de AGILE THERAPEUTICS, INC: Un método anticonceptivo, que comprende: (A) aplicar de manera consecutiva múltiples dispositivos de tratamiento de suministro de hormonas transdérmico a la piel […]
Sistema de administración de fármacos por vía transmucosa oral, del 1 de Abril de 2020, de Abon Pharmaceuticals, LLC: Una forma de dosificación transmucosa oral que comprende (a) un vehículo primario monofásico que comprende (i) un agente de inhibición […]
Un dispositivo intravaginal, y un método para reducir la velocidad de difusión de ingredientes activos en dicho dispositivo intravaginal, del 11 de Marzo de 2020, de Qpharma AB: Un anillo intravaginal (1,1',1'') que comprende al menos un primer ingrediente farmacéuticamente activo y al menos una primera capa hecha de al menos un primer material […]
Composiciones de fulvestrant y métodos de uso, del 25 de Diciembre de 2019, de SHIMODA BIOTECH (PTY) LTD: Una formulación que comprende a) una ciclodextrina; y b) un compuesto de la fórmula (I): **(Ver fórmula)** o una sal del mismo o hidrato del anterior; y c) un vehículo […]
Composiciones y métodos de administración dérmica, del 2 de Octubre de 2019, de AGILE THERAPEUTICS, INC: Una composición para la administración transdérmica de levonorgestrel, que comprende: a) un portador que comprende un adhesivo sensible […]
Antagonistas de CYP2J2 en el tratamiento del dolor, del 2 de Octubre de 2019, de FRAUNHOFER-GESELLSCHAFT ZUR FORDERUNG DER ANGEWANDTEN FORSCHUNG E.V.: Un antagonista selectivo de la citocromo P450 epoxigenasa 2J2 (CYP2J2) para uso en la prevención o tratamiento del dolor neuropático periférico inducido por quimioterapia […]
Uso de un estrógeno en la fabricación de una composición que contiene estrógeno para el tratamiento de la vaginitis atrófica, del 27 de Septiembre de 2019, de NOVO NORDISK HEALTH CARE AG: Uso de un estrogeno en la preparacion de una composicion que contiene estrogeno para el tratamiento de la vaginitis atrofica en mujeres, donde se administra de aproximadamente […]