ANIMALES PORCINOS QUE CARECEN DE CUALQUIER EXPRESION DE ALFA 1,3 GALACTOSILTRANSFERASA FUNCIONAL.
Un cerdo en el que ambos alelos del gen de la alfa-1,3-GT son inactivos, donde un alelo se vuelve inactivo a través de al menos una mutación puntual
Tipo: Patente Internacional (Tratado de Cooperación de Patentes). Resumen de patente/invención. Número de Solicitud: PCT/US2003/026622.
Solicitante: REVIVICOR, INC.
Nacionalidad solicitante: Estados Unidos de América.
Dirección: 1700 KRAFT DRIVE, SUITE 2400,BLACKSBURG, VA 24060.
Inventor/es: PHELPS,CAROL,J.
Fecha de Publicación: .
Fecha Concesión Europea: 9 de Diciembre de 2009.
Clasificación Internacional de Patentes:
- A01K67/027M2
- C12N15/85A2
- C12N9/40 QUIMICA; METALURGIA. › C12 BIOQUIMICA; CERVEZA; BEBIDAS ALCOHOLICAS; VINO; VINAGRE; MICROBIOLOGIA; ENZIMOLOGIA; TECNICAS DE MUTACION O DE GENETICA. › C12N MICROORGANISMOS O ENZIMAS; COMPOSICIONES QUE LOS CONTIENEN; PROPAGACION, CULTIVO O CONSERVACION DE MICROORGANISMOS; TECNICAS DE MUTACION O DE INGENIERIA GENETICA; MEDIOS DE CULTIVO (medios para ensayos microbiológicos C12Q 1/00). › C12N 9/00 Enzimas, p. ej. ligasas (6.); Proenzimas; Composiciones que las contienen (preparaciones para la limpieza de los dientes que contienen enzimas A61K 8/66, A61Q 11/00; preparaciones de uso médico que contienen enzimas A61K 38/43; composiciones detergentes que contienen enzimas C11D ); Procesos para preparar, activar, inhibir, separar o purificar enzimas. › actúan sobre los enlaces alfa-galactosa-glicósido, p. ej. alfa-galactosidasa.
Clasificación PCT:
- A01K67/00 NECESIDADES CORRIENTES DE LA VIDA. › A01 AGRICULTURA; SILVICULTURA; CRIA; CAZA; CAPTURA; PESCA. › A01K CRÍA DE ANIMALES; AVICULTURA; APICULTURA; PISCICULTURA; PESCA; ANIMALES PARA CRIA O REPRODUCCIÓN, NO PREVISTOS EN OTRO LUGAR; NUEVAS VARIEDADES DE ANIMALES. › Cría u obtención de animales, no prevista en otro lugar; Nuevas razas de animales.
- C12N5/00 C12N […] › Células no diferenciadas humanas, animales o vegetales, p. ej. líneas celulares; Tejidos; Su cultivo o conservación; Medios de cultivo para este fin (reproducción de plantas por técnicas de cultivo de tejidos A01H 4/00).
Clasificación antigua:
- A01K67/00 A01K […] › Cría u obtención de animales, no prevista en otro lugar; Nuevas razas de animales.
- C12N5/00 C12N […] › Células no diferenciadas humanas, animales o vegetales, p. ej. líneas celulares; Tejidos; Su cultivo o conservación; Medios de cultivo para este fin (reproducción de plantas por técnicas de cultivo de tejidos A01H 4/00).
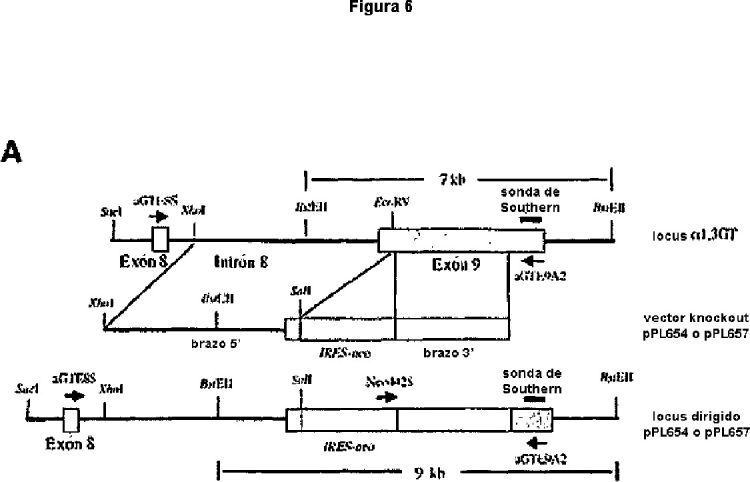
Fragmento de la descripción:
Animales porcinos que carecen de cualquier expresión de alfa 1,3 galactosiltransferasa funcional.
Esta solicitud reivindica prioridad a la solicitud de patente provisional de Estados Unidos Nº 60/404.775 presentada el 21 de agosto de 2002.
Campo de la invención
La presente invención son animales, tejidos y órganos porcinos así como células y líneas celulares obtenidas de dichos animales, tejidos y órganos, que carecen de cualquier expresión de alfa 1,3 galactosiltransferasa (alfa1,3GT) funcional. Dichos animales, tejidos, órganos y células pueden usarse en investigación y en terapia médica, incluyendo en xenotransplante.
Antecedentes de la invención
Los pacientes con fallo orgánico en fase final requieren el transplante de órganos para su supervivencia. El factor limitante principal en el transplante clínico es la escasez de donantes humanos adecuados. A lo largo de los últimos diez años ha aumentado drásticamente la lista de espera de pacientes para órganos, desde aproximadamente 30.000 en 1991 hasta aproximadamente 80.000 en 2001 (fuente: La Red de Donantes de Órganos de Nueva York (New York Organ Donor Network); Estudio de Revisión del Registro de Muertes de la Asociación de Organizaciones para la Recuperación de Órganos (Association of Organ Procurement Organizations' Death Record Review Study) de 1997 a 1999, proporcionado por 30 organizaciones para la recuperación de órganos). A pesar de esta creciente necesidad a los largo de los últimos diez años, la cantidad de donaciones de órganos se ha mantenido fija (aproximadamente 20.000 por año).
De acuerdo con la Red Internacional de Distribución de Órganos (United Network for Organ Sharing) (UNOS) con fecha de 17 de julio de 2003, había 82.249 pacientes esperando transplantes de órganos en los Estados Unidos. La necesidad de órganos específicos es la siguiente:

En todo Estados Unidos, un promedio de 17 hombres, mujeres y niños de todas las razas y trasfondos étnicos mueren cada día por la ausencia de órganos donados, por tanto, cada año, mueren más de 6.200 americanos esperando un transplante de órgano. La necesidad de una fuente más fiable e ilimitada de órganos ha conducido a la investigación del potencial para transplante de órganos de otros animales, llamado xenotransplante.
Los cerdos se consideran la fuente más probable de órganos para xenoinjerto. El suministro de cerdos es abundante, los programas de reproducción están bien establecidos, y su tamaño y fisiología son compatibles con seres humanos. El xenotransplante, sin embrago, presenta su propia serie de problemas. El más significativo es el rechazo inmune. El primer obstáculo inmunológico es el "rechazo hiperagudo" (HAR). El HAR puede definirse por la presencia ubicua de elevados títulos de anticuerpos naturales preformados que se unen al tejido foráneo. Se cree que la unión de estos anticuerpos naturales a epítopos diana en el endotelio del órgano donante es el acontecimiento inicial en el HAR. Esta unión, en minutos desde la perfusión del órgano donante con la sangre del receptor, está seguido de activación del complemento, deposición de plaquetas y fibrina, y finalmente por edema intersticial y hemorragia en el órgano donante, todo lo cual causa fallo del órgano en el receptor (Strahan et al. (1996) Frontiers in Bioscience 1, e34-41).
Excepto para los monos del viejo mundo, los simios y los seres humanos, la mayoría de los mamíferos portan glucoproteínas en sus superficies celulares que contienen galactosa alfa 1,3-galactosa (Galili et al., J. Biol. Chem. 263: 17755-17762, 1988). Los seres humanos, los simios y los monos del viejo mundo tienen un anticuerpo anti-alfa gal de origen natural que se produce en elevada cantidad (Cooper et al., Lancet 342: 682-683, 1993). Se une específicamente a glucoproteínas y glucolípidos que albergan galactosa alfa-1,3 galactosa.
En contraste, se encuentran glucoproteínas que contienen galactosa alfa 1,3-galactosa en grandes cantidades en células de otros mamíferos, tales como cerdos. Esta distribución diferencial del "epítopo alfa-1,3 GT" y anticuerpos anti-Gal (es decir, anticuerpos que se unen a glucoproteínas y glucolípidos que albergan galactosa alfa-1,3 galactosa) en mamíferos es el resultado de un proceso evolutivo que seleccionaba especies con alfa-1,3-galactosiltransferasa inactivada (es decir, mutada) en primates ancestrales del viejo mundo y seres humanos. Por tanto, los seres humanos son "knockout naturales" de alfa1,3GT. Una consecuencia directa de este acontecimiento es el rechazo de xenoinjertos, tal como el rechazo de órganos de cerdo transplantados en seres humanos inicialmente mediante HAR.
Se ha llevado a cabo una diversidad de estrategias para eliminar o modular la respuesta humoral anti-Gal causada por xenotransplante porcino, incluyendo la eliminación enzimática del epítopo con alfa-galactosidasas (Stone et al., Transplantation 63: 640-645, 1997), eliminación del anticuerpo anti-gal específico (Ye et al., Transplantation 58: 330-337,1994), recubriendo el epítopo con otros restos de carbohidrato, que no lograron eliminar la expresión de alfa-1,3-GT (Tanemura et al., J. Biol. Chem. 27321: 16421-16425, 1998 y Koike et al., Xenotransplantation 4: 147-153, 1997) y la introducción de proteínas inhibidoras del complemento (Dalmasso et al., Clin. Exp. Immunol. 86: 31-35, 1991, Dalmasso et al. Transplantation 52:530-533 (1991)). C. Costa et al. (FASEB J 13, 1762 (1999)) informaron de que la inhibición competitiva de alfa-1,3-GT en cerdos transgénicos para la H-transferasa provocaba una reducción solamente parcial en las cantidades de epítopos. Asimismo, S. Miyagawa et al. (J Biol. Chem 276, 39310 (2001)) informaron de que intentos de bloquear la expresión de epítopos gal en cerdos transgénicos para la N-acetilglucosaminiltransferasa III también provocaron una reducción solamente parcial de las cantidades de epítopos gal y no lograron prolongar significativamente la supervivencia del transplante en receptores primates.
Se ha informado de knockouts de un único alelo del locus alfa-1,3-GT en células porcinas y animales vivos. Denning et al. (Nature Biotechnology 19: 559-562, 2001) informaron de la deleción génica dirigida de un alelo del gen de la alfa-1,3-GT en ovejas. Harrison et al. (Transgenics Research 11: 143-150, 2002) informaron de la producción de células fibroblásticas fetales porcinas somáticas knockout heterocigóticas para alfa-1,3-GT. En 2002, Lai et al. (Science 295: 1089-1092, 2002) y Dai et al. (Nature Biotechnology 20: 251-255, 2002) informaron de la producción de cerdos, en los que un alelo del gen de la alfa-1,3-GT se volvió satisfactoriamente inactivo. Ramsoondar et al. (Biol of Reproduc 69, 437-445 (2003)) informaron de la generación de cerdos knockout heterocigóticos para alfa-1,3-GT que también expresan la alfa-1,2-fucosiltransferase humana (HT), que expresaban los epítopos tanto HT como alfa-1,3-GT.
La publicación PCT Nº WO 94/21799 y la patente de Estados Unidos Nº 5.821.117 del Austin Research Institute; la publicación PCT Nº WO 95/20661 de Bresatec; y la publicación PCT Nº WO 95/28412, la patente de Estados Unidos Nº 6.153.428, la patente de Estados Unidos Nº 6.413.769 y la publicación de Estados Unidos Nº 2003/0014770 de BioTransplant, Inc. y The General Hospital Corporation proporcionan un análisis de la producción de células porcinas alfa-1,3-GT negativas en base al conocimiento del ADNc del gen de la alfa-1,3-GT (y sin el conocimiento de la organización o secuencia genómica). Sin embargo, no había evidencias de que dichas células realmente se produjeran antes de la fecha de presentación de estas solicitudes y los ejemplos son todos proféticos.
La primera descripción pública de la producción satisfactoria de una célula porcina alfa-1,3-GT negativa heterocigótica sucedió en julio de 1999 en la Lake Tahoe Transgenic Animal Conference (David Ayares, et al., PPL Therapeutics, Inc.). Antes de la presente invención, nadie había publicado o descrito públicamente la producción de una célula porcina alfa 1,3GT negativa homocigótica. Además, como no han estado disponibles hasta la fecha células madre embrionarias porcinas, no había y aún no hay modo de usar una célula madre embrionaria homocigótica para alfa-1,3-GT para intentar preparar un cerdo knockout para alfa-1,3-GT homocigótico vivo.
El 27 de febrero de 2003,...
Reivindicaciones:
1. Un cerdo en el que ambos alelos del gen de la alfa-1,3-GT son inactivos, donde un alelo se vuelve inactivo a través de al menos una mutación puntual.
2. Un cerdo de acuerdo con la reivindicación 1, en el que al menos un alelo se vuelve inactivo por un acontecimiento de modificación genética dirigida.
3. Un cerdo de acuerdo con la reivindicación 2, donde el acontecimiento de modificación genética dirigida es recombinación homóloga.
4. Un cerdo de acuerdo con la reivindicación 2 o reivindicación 3, donde el acontecimiento de modificación genética dirigida usa una construcción de modificación dirigida al exón 9 del gen de la alfa-1,3-GT.
5. Un cerdo de acuerdo con una cualquiera de las reivindicaciones 1 a 4, en el que ambos alelos se vuelven inactivos a través de al menos una mutación puntual.
6. Un cerdo de acuerdo con una cualquiera de las reivindicaciones 1 a 5, donde la al menos una mutación puntual es una mutación de sustitución, deleción o inserción o una combinación de las mismas.
7. Un cerdo de acuerdo con una cualquiera de las reivindicaciones 1 a 6, donde al menos una mutación puntual es una mutación puntual T-a-G en la segunda base del exón 9.
8. Un cerdo de acuerdo con la reivindicación 7, que comprende la mutación puntual T-a-G en la segunda base del exón 9 en ambos alelos del gen de la alfa-1,3-GT.
9. Un cerdo de acuerdo con una cualquiera de las reivindicaciones 1 a 8, donde un alelo se vuelve inactivo a través de al menos dos mutaciones puntuales.
10. Un órgano de un cerdo de acuerdo con una cualquiera de las reivindicaciones 1 a 9.
11. El órgano de la reivindicación 10, donde el órgano es un riñón, un hígado, un corazón, un pulmón o un páncreas.
12. Un tejido de un cerdo de acuerdo con una cualquiera de las reivindicaciones 1 a 9.
13. El tejido de la reivindicación 12, donde el tejido es cartílago, hueso, adiposo o músculo.
14. Una célula o una línea celular de un cerdo de acuerdo con una cualquiera de las reivindicaciones 1 a 9.
15. La célula de la reivindicación 14, donde la célula se obtiene del páncreas.
16. La célula de la reivindicación 15, donde la célula es una célula del islote de Langerhans o una célula secretora de insulina.
17. Un método para seleccionar células que carecen de la expresión de galactosa alfa-1,3 galactosa, que comprende:
18. El método de la reivindicación 17, en el que la toxina A de Clostridium difficile usada para la selección está en forma de una toxina purificada.
19. El método de la reivindicación 17, en el que la toxina A de Clostridium difficile usada para la selección está en forma de un fluido sobrenadante de cultivo.
20. El método de la reivindicación 17, en el que la toxina purificada se aplica a células dispersadas, y en el que dichas células dispersadas después se cultivan in vitro en recipientes adecuados para la adherencia celular.
21. El método de la reivindicación 17, en el que la toxina purificada se aplica a células adheridas.
22. El método de la reivindicación 17, en el que el fluido sobrenadante de cultivo se aplica a células dispersadas y no adheridas seguido de cultivo en recipientes adecuados para la adherencia celular.
23. El método de una cualquiera de las reivindicaciones 17 a 22, en el que las células son células porcinas.
24. Un método para producir un animal no humano deficiente en alfa 1,3 GT que comprende:
25. El método de la reivindicación 24, en el que ambos alelos del gen de la alfa-1,3-GT en las células a seleccionar son inactivos, y un alelo se vuelve inactivo a través de al menos una mutación puntual.
26. El método de la reivindicación 25, en el que al menos un alelo del gen de la alfa-1,3-GT en las células a seleccionar se ha vuelto inactivo por un acontecimiento de modificación genética dirigida.
27. El método de la reivindicación 25 o reivindicación 26, en el que ambos alelos de la alfa-1,3-GT en las células a seleccionar se vuelven inactivos a través de al menos una mutación puntual.
28. El método de una cualquiera de las reivindicaciones 25 a 27, en el que la mutación puntual es una mutación de sustitución, deleción o inserción o una combinación de las mismas.
29. El método de una cualquiera de las reivindicaciones 25 a 28, en el que al menos una mutación puntual es una mutación puntual T-a-G en la segunda base del exón 9.
30. El método de la reivindicación 29, en el que las células a seleccionar comprenden la mutación puntual T-a-G en la segunda base del exón 9 en ambos alelos del gen de la alfa-1,3-GT.
31. El método de la reivindicación 24, en el que las células a seleccionar se han vuelto homocigóticas con respecto a la expresión del alelo alfa 1,3-GT, mediante knockout dirigido de ambos alelos por recombinación homóloga.
32. El método de la reivindicación 24, en el que las células a seleccionar son homocigóticas con respecto a la expresión del alelo alfa 1,3-GT conseguidas mediante mutaciones naturales de ambos alelos de la alfa 1,3-GT, que inutiliza el gen de la alfa 1,3-GT.
33. El método de la reivindicación 24, en el que las células a seleccionar son homocigóticas con respecto a la expresión del alelo alfa 1,3-GT, conseguidas mediante knockout dirigido de un alelo por recombinación homóloga y mutación natural del segundo alelo que inutiliza el gen de la alfa 1,3-GT.
34. El método de la reivindicación 24, en el que las células a seleccionar se han vuelto homocigóticas con respecto a la expresión del alelo alfa 1,3-GT mediante mutaciones inducidas de ambos alelos de la alfa 1,3-GT, que inutiliza el gen de la alfa 1,3-GT.
35. El método de la reivindicación 24, en el que dicho animal es un cerdo.
36. El método de la reivindicación 24, en el que se induce una mutación por un agente mutagénico seleccionado entre el grupo compuesto por un mutágeno químico, radiación, y un transposón.
37. El método de la reivindicación 24, en el que dicho mutágeno químico se selecciona entre el grupo compuesto por EMS, ENU, gas mostaza e ICR191.
38. El método de la reivindicación 24, en el que dicha radiación se selecciona entre el grupo compuesto por radiación ultravioleta, radiación alfa, radiación beta y radiación gamma.
39. Una célula en la que ambos alelos de su gen de la alfa-1,3-GT son inactivos en la que al menos un alelo contiene una mutación natural o espontánea en el gen de la alfa-1,3-GT, donde dicha célula se puede producir por un método que comprende:
40. La célula de la reivindicación 39, en la que al menos un alelo contiene la sustitución de bases timina a guanina en la posición de la base 424 del gen de la alfa 1,3-GT, que provoca una sustitución de aminoácido de tirosina a ácido aspártico en la posición 142 en la proteína alfa-1,3-GT.
41. La célula de la reivindicación 39, en la que al menos un alelo contiene una mutación inducida en el gen de la alfa-1,3-GT.
42. Un animal no humano que se puede producir de acuerdo con el método de la reivindicación 24, en el que ambos alelos del gen de la alfa-1,3-GT son inactivos.
43. Un animal no humano que se puede producir por clonación de transferencia nuclear usando la célula de una cualquiera de las reivindicaciones 39 a 41 como donante nuclear.
44. Una célula, tejido, u órgano que se puede obtener del animal de la reivindicación 42 o reivindicación 43, o de un cerdo de acuerdo con una cualquiera de las reivindicaciones 1 a 9, para su uso como suplemento o reemplazo in vivo o ex vivo para células, tejidos u órganos receptores.
45. Una construcción recombinante para modificar la secuencia endógena del gen de la alfa-1,3-GT del cerdo, en la que la secuencia comprende una mutación puntual T-a-G en la segunda base del exón 9.
46. Una construcción recombinante de acuerdo con la reivindicación 45, en la que la secuencia del gen de la alfa-1,3-GT comprende al menos 50 nucleótidos contiguos.
47. Un método para producir células que son heterocigóticas para alfa-1,3-GT, que comprende la transfección de fibroblastos fetales porcinos primarios con una construcción de acuerdo con una cualquiera de las reivindicaciones 45 a 47.
48. Una célula de cerdo en la que ambos alelos del gen de la alfa-1,3-GT son inactivos, donde un alelo se vuelve inactivo a través de al menos una mutación puntual.
49. Una célula de cerdo en la que al menos un alelo de la alfa 1,3-GT contiene una sustitución de base timina a guanina en posición de la base 424, que provoca la sustitución de aminoácido de tirosina a ácido aspártico en la posición 142 en la proteína alfa-1,3-GT.
Patentes similares o relacionadas:
Composiciones de alfa-galactosidasa, del 18 de Diciembre de 2019, de PROTALIX LTD. (100.0%): Una proteína α-galactosidasa humana que comprende una glicina como el resto N-terminal en donde dicha proteína α-galactosidasa humana se fusiona traduccionalmente […]
Alfa-galactosidasa estabilizada y usos de la misma, del 11 de Abril de 2019, de PROTALIX LTD. (100.0%): Un proceso para la preparación de una estructura de proteína multimérica que comprende al menos dos monómeros de α-galactosidasa que están unidos de forma covalente […]
Terapia génica para la enfermedad de Fabry, del 12 de Marzo de 2019, de UCL BUSINESS PLC: Una molécula de ácido nucleico que comprende una secuencia de nucleótidos con optimización de codones que codifica una proteína α-galactosidasa […]
Terapia de combinación para tratar trastornos de deficiencia de proteínas, del 19 de Octubre de 2018, de Mount Sinai School of Medicine of New York University: Una composición farmacéutica estable formulada para la administración parenteral a un ser humano y que comprende una enzima lisosomal de tipo […]
Nuevas alfa-galactosidasas, del 6 de Diciembre de 2017, de VELICO MEDICAL, INC: El uso de una enzima purificada, que comprende: un polipéptido que tiene al menos 10 aminoácidos seleccionados de la posición en la siguiente secuencia numerada […]
Preparaciones médicas para el tratamiento de deficiencia de alfa-galactosidasa A, del 31 de Mayo de 2017, de Shire Human Genetic Therapies, Inc: Una preparación de α-Gal A glicosilada humana que tiene una carga de oligosacáridos aumentada, en donde entre el 35% y el 85% de los oligosacáridos se cargan por […]
Nuevas alfa-galactosidasas, del 10 de Mayo de 2017, de VELICO MEDICAL, INC: El uso de una enzima purificada que comprende un polipéptido que tiene una secuencia especificada por SEC ID n.º: 8 como una α-galactosidasa.
Nuevas composiciones inmunogénicas para la prevención y tratamiento de enfermedad meningocócica, del 29 de Marzo de 2017, de WYETH HOLDINGS LLC: Una composición que comprende: (a) al menos una proteína que comprende una secuencia de aminoácidos que tiene identidad de secuencia mayor de 80 % con la secuencia […]