Proceso para la síntesis de 4,4'-diamino-difenil-sulfona.
Proceso para la síntesis de 4,4'-diamino-difenil-sulfona caracterizado por las siguientes etapas:
• reacción de condensación de 4-aminotiofenol y 4-cloronitrobenceno con la formación de 4-nitro-4'- aminodifenilsulfuro;
• oxidación del tioéter con un sistema oxidante formado por Na2WO4 y H2O2 en la sulfona correspondiente, en la que la reacción se realiza en condiciones ácidas añadiendo Na2WO4 al 0,1-3% molar y a continuación una solución de 1,0-1,3 equivalentes de peróxido de hidrógeno al 35 % a temperaturas entre 50 ºC y 85 ºC;
• reducción de la 4-nitro-4'-aminodifenilsulfona por hidrogenación en presencia de un catalizador con la obtención de la 4,4'-diamino-difenil-sulfona.
Tipo: Patente Internacional (Tratado de Cooperación de Patentes). Resumen de patente/invención. Número de Solicitud: PCT/EP2004/051389.
Solicitante: Lundbeck Pharmaceuticals Italy S.P.A.
Nacionalidad solicitante: Italia.
Dirección: Via Quarta Strada 2 35129 Padova ITALIA.
Inventor/es: VILLA, MARCO, CIARDELLA,FRANCESCO, DE FAVERI,CARLA, ZANOTTI,RICCARDO, BORIN,FABRIZIO.
Fecha de Publicación: .
Clasificación Internacional de Patentes:
- C07C315/02 QUIMICA; METALURGIA. › C07 QUIMICA ORGANICA. › C07C COMPUESTOS ACICLICOS O CARBOCICLICOS (compuestos macromoleculares C08; producción de compuestos orgánicos por electrolisiso electroforesis C25B 3/00, C25B 7/00). › C07C 315/00 Preparación de sulfonas; Preparación de sulfóxidos. › por formación de grupos sulfona o sulfóxido por oxidación de sulfuros o por formación de grupos sulfona por oxidación de sulfóxidos.
PDF original: ES-2553608_T3.pdf
Patentes similares o relacionadas:
Procedimiento para preparar ácidos 2-alquil-4-trifluorometil-3-alquilsulfonilbenzoicos, del 19 de Febrero de 2020, de BAYER CROPSCIENCE AKTIENGESELLSCHAFT: Procedimiento para preparar ácidos 2-alquil-4-trifluorometil-3-alquilsulfonilbenzoicos de la fórmula general (I), caracterizado porque a) en una […]
Procedimiento para la preparación de ácidos 2-alquil-4-trifluorometil-3-alquilsulfonilbenzoicos mediante oxidación quimioselectiva de tioéter, del 25 de Septiembre de 2019, de BAYER CROPSCIENCE AKTIENGESELLSCHAFT: Procedimiento para la preparación de ácidos 2-alquil-4-trifluorometil-3-alquilsulfonilbenzoicos de la fórmula general (I), caracterizado porque a) en una […]
Procedimiento para la oxidación asimétrica de compuestos orgánicos con peróxidos en presencia de un catalizador ácido quiral, del 7 de Marzo de 2018, de STUDIENGESELLSCHAFT KOHLE MBH: Procedimiento para la oxidación asimétrica libre de metales de un compuesto orgánico nucleofílico mediante adición electrofílica de un compuesto […]
Procedimiento para la obtención de derivados de 1,1-dióxido de 1,4-benzotiepina, del 24 de Enero de 2018, de SANOFI-AVENTIS DEUTSCHLAND GMBH: Procedimiento para la obtención del compuesto de la fórmula I **Fórmula** donde significan R2, R2', R3, R3', R4, R4', R5, R5', independientemente entre […]
Enantiómero (R) de la lauflumida a más del 95%ee, del 6 de Diciembre de 2017, de NLS Pharma AG: Molécula de fórmula (I) siguiente: **(Ver fórmula)** en su forma de enantiómero (R) ópticamente puro en exceso enantiomérico a más del 95%.
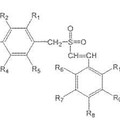 Estirilbencilsulfonas sustituidas para tratar trastornos proliferativos, del 28 de Octubre de 2013, de TEMPLE UNIVERSITY OF THE COMMONWEALTH SYSTEM OF HIGHER EDUCATION: compuesto de la fórmula **Fórmula**
en donde:
(a) (i) R1, R2, R4 y R5 están seleccionados, de manera independiente, del grupo consistente […]
Estirilbencilsulfonas sustituidas para tratar trastornos proliferativos, del 28 de Octubre de 2013, de TEMPLE UNIVERSITY OF THE COMMONWEALTH SYSTEM OF HIGHER EDUCATION: compuesto de la fórmula **Fórmula**
en donde:
(a) (i) R1, R2, R4 y R5 están seleccionados, de manera independiente, del grupo consistente […]
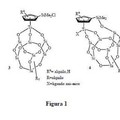 Catalizadores tipo silsesquioxano de titanio para la oxidación de grupos sulfuro a sulfóxido o sulfona, del 25 de Julio de 2013, de UNIVERSIDAD DE ALCALA.: Catalizadores tipo silsesquioxano de titanio para la oxidación de grupos sulfuro. La presente invención consiste en un procedimiento mejorado para la oxidación […]
Catalizadores tipo silsesquioxano de titanio para la oxidación de grupos sulfuro a sulfóxido o sulfona, del 25 de Julio de 2013, de UNIVERSIDAD DE ALCALA.: Catalizadores tipo silsesquioxano de titanio para la oxidación de grupos sulfuro. La presente invención consiste en un procedimiento mejorado para la oxidación […]
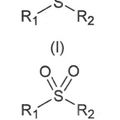 PROCEDIMIENTO DE OXIDACION AEROBICA DE UN GRUPO SULFOXIDO A SULFONA, del 5 de Julio de 2010, de UNIVERSIDAD DE BURGOS: Procedimiento de oxidación aeróbica de un grupo sulfóxido a sulfona. La presente invención consiste en un nuevo procedimiento general para la oxidación de un grupo sulfóxido […]
PROCEDIMIENTO DE OXIDACION AEROBICA DE UN GRUPO SULFOXIDO A SULFONA, del 5 de Julio de 2010, de UNIVERSIDAD DE BURGOS: Procedimiento de oxidación aeróbica de un grupo sulfóxido a sulfona. La presente invención consiste en un nuevo procedimiento general para la oxidación de un grupo sulfóxido […]