CONSTRUCTOS DE VECTORES.
Un constructo de ADN que comprende: a) un primer promotor y b) un segundo promotor,
donde el primer y segundo promotores están en orientación opuesta entre si y definen: c) una región inter-promotores situada aguas abajo del extremo 3' del primer promotor y aguas abajo del extremo 3' del segundo promotor, donde dicha región inter-promotores comprende una secuencia de nucleótidos que forma un molde para la producción de ARN de doble hebra; y cuyo constructo de ADN comprende adicionalmente: d) un primer terminador de la transcripción, situado en la región inter-promotores aguas abajo, como se observa desde el extremo 3' del primer promotor, del primer promotor, donde el primer terminador de la transcripción está conectado operablemente al primer promotor; caracterizado porque el primer y segundo promotores son promotores de bacteriófago, promotores procarióticos o promotores eucarióticos
Tipo: Patente Europea. Resumen de patente/invención. Número de Solicitud: E07000056.
Solicitante: DEVGEN NV.
Nacionalidad solicitante: Bélgica.
Dirección: TECHNOLOGIEPARK 30 9052 GENT-ZWIJNAARDE BELGICA.
Inventor/es: RENARD,JEAN-PIERRE, PLAETINCK,GEERT, BOGAERT,THIERRY.
Fecha de Publicación: .
Fecha Solicitud PCT: 18 de Mayo de 2001.
Clasificación Internacional de Patentes:
- C12N15/63 QUIMICA; METALURGIA. › C12 BIOQUIMICA; CERVEZA; BEBIDAS ALCOHOLICAS; VINO; VINAGRE; MICROBIOLOGIA; ENZIMOLOGIA; TECNICAS DE MUTACION O DE GENETICA. › C12N MICROORGANISMOS O ENZIMAS; COMPOSICIONES QUE LOS CONTIENEN; PROPAGACION, CULTIVO O CONSERVACION DE MICROORGANISMOS; TECNICAS DE MUTACION O DE INGENIERIA GENETICA; MEDIOS DE CULTIVO (medios para ensayos microbiológicos C12Q 1/00). › C12N 15/00 Técnicas de mutación o de ingeniería genética; ADN o ARN relacionado con la ingeniería genética, vectores, p. ej. plásmidos, o su aislamiento, su preparación o su purificación; Utilización de huéspedes para ello (mutantes o microorganismos modificados por ingeniería genética C12N 1/00, C12N 5/00, C12N 7/00; nuevas plantas en sí A01H; reproducción de plantas por técnicas de cultivo de tejidos A01H 4/00; nuevas razas animales en sí A01K 67/00; utilización de preparaciones medicinales que contienen material genético que es introducido en células del cuerpo humano para tratar enfermedades genéticas, terapia génica A61K 48/00; péptidos en general C07K). › Introducción de material genético extraño utilizando vectores; Vectores; Utilización de huéspedes para ello; Regulación de la expresión.
- C12N15/70 C12N 15/00 […] › Vectores o sistemas de expresión especialmente adaptados a E. coli.
- C12P19/34 C12 […] › C12P PROCESOS DE FERMENTACION O PROCESOS QUE UTILIZAN ENZIMAS PARA LA SINTESIS DE UN COMPUESTO QUIMICO DADO O DE UNA COMPOSICION DADA, O PARA LA SEPARACION DE ISOMEROS OPTICOS A PARTIR DE UNA MEZCLA RACEMICA. › C12P 19/00 Preparación de compuestos que contienen radicales sacárido (ácido cetoaldónico C12P 7/58). › Polinucleótidos, p. ej. ácidos nucleicos, oligorribonucleótidos.
Clasificación PCT:
- C12N1/21 C12N […] › C12N 1/00 Microorganismos, p.ej. protozoos; Composiciones que los contienen (preparaciones de uso médico que contienen material de protozoos, bacterias o virus A61K 35/66, de algas A61K 36/02, de hongos A61K 36/06; preparación de composiciones de uso médico que contienen antígenos o anticuerpos bacterianos, p. ej. vacunas bacterianas, A61K 39/00 ); Procesos de cultivo o conservación de microorganismos, o de composiciones que los contienen; Procesos de preparación o aislamiento de una composición que contiene un microorganismo; Sus medios de cultivo. › modificados por la introducción de material genético extraño.
- C12N15/10 C12N 15/00 […] › Procedimientos para el aislamiento, la preparación o la purificación de ADN o ARN (preparación química de ADN o ARN C07H 21/00; preparación de polinucleótidos no estructurales a partir de microorganismos o con la ayuda de enzimas C12P 19/34).
- C12N15/63 C12N 15/00 […] › Introducción de material genético extraño utilizando vectores; Vectores; Utilización de huéspedes para ello; Regulación de la expresión.
- C12N15/70 C12N 15/00 […] › Vectores o sistemas de expresión especialmente adaptados a E. coli.
Países PCT: Austria, Bélgica, Suiza, Alemania, Dinamarca, España, Francia, Grecia, Italia, Liechtensein, Luxemburgo, Países Bajos, Suecia, Mónaco, Portugal, Irlanda, Finlandia, Chipre.
PDF original: ES-2356389_T3.pdf
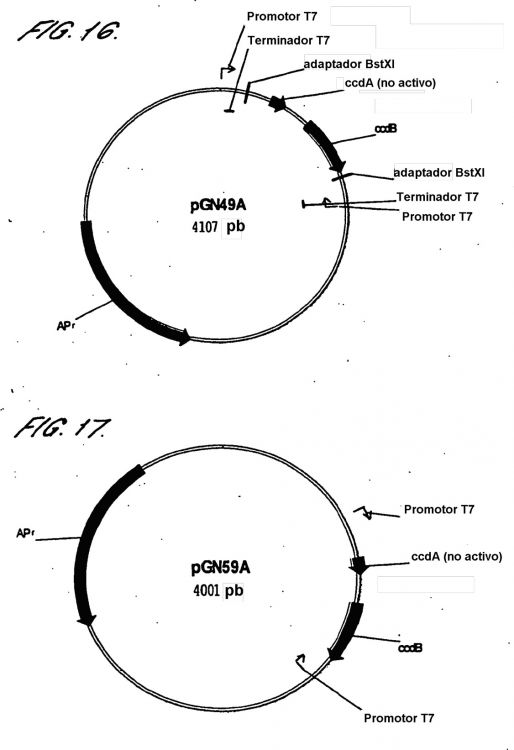
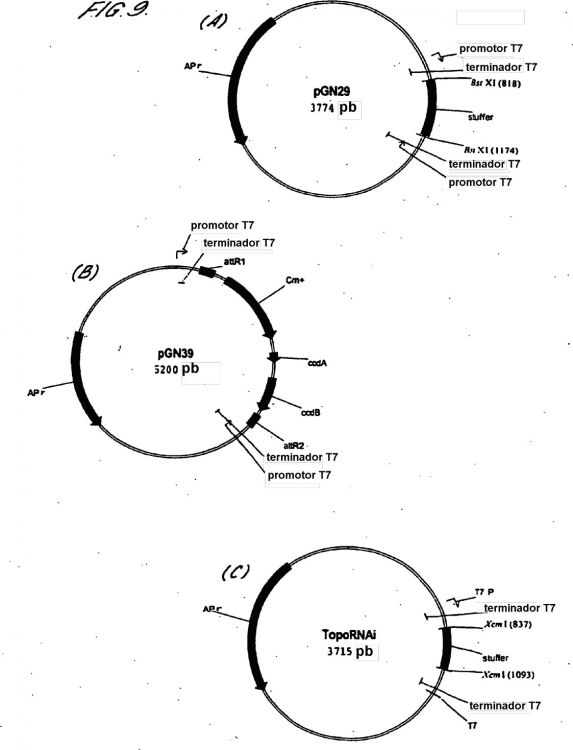
Fragmento de la descripción:
Campo de la Invención
La invención se refiere a constructos de vectores mejorados para su uso en la expresión de ARN de doble hebra, concretamente para su uso en la expresión de ARN de doble hebra in vitro e in vivo.
Antecedentes de la invención 5
Desde la llegada de la inhibición del ARN de doble hebra (ARNi) como herramienta para controlar la expresión génica, como se describe en los documentos WO 99/32619 y WO 00/01846, se ha reconocido una necesidad de vectores especializados diseñados para la producción de ARN de doble hebra (ARNdh).
Los vectores de clonación diseñados para producir elevados niveles de ARNdh han sido previamente descritos por Plaetinck et al. (documento WO 00/01846) and Timmons et al. Nature, 395:854 (1998). Estos vectores contienen 10 generalmente un sitio de clonación múltiple (SCM) en el cual se pueden clonar fragmentos de ADN diana flanqueados por dos promotores transcripcionales oponibles. Esencialmente, estos tres componentes (Promotor 1, SCM y Promotor 2) constituyen el sistema completo. En el sistema de expresión apropiado, el ADN clonado en el SCM puede ser transcrito en ambas direcciones, conduciendo a la producción de dos hebras de ARN complementarias.
Una desventaja de los sistemas conocidos es que no solamente se transcribe el fragmento clonado. La lectura 15 de la ARN polimerasa dará como resultado la transcripción del vector completo, y esto también en ambas direcciones. Como solamente la transcripción del fragmento de ADN clonado dará como resultado un ARNdh activo para los fines del ARNi, la transcripción de la parte del vector da como resultado ARN inútil, ineficaz. Más específicamente, el 80% de estos transcritos pueden ser considerados no específicos y por lo tanto no eficaces.
Las grandes cantidades de ARN no específico generado por medio de los plásmidos y los sistemas de 20 expresión de la técnica anterior producen algunos efectos secundarios no deseables. Primero, en los protocolos de ARNi basados en la introducción de ADNdh en C. elegans por medio de un organismo alimenticio tal como E. coli que expresa el ADNdh (véase el documento WO 00/01846), se considera que grandes hebras de ARN son tóxicas para el organismo alimenticio. Como resultado, las grandes cantidades de ARN que se acumulan en E. coli hacen que una porción significativa de la población muera. Segundo, y probablemente más importante, es la reducción del potencial de 25 inhibición. La presencia de grandes cantidades de ADNdh no específico ocasiona un entorno competitivo para las secuencias especificadas. El potencial de las secuencias de ARNdh especificadas por el molde para inhibir la expresión de la proteína elegida como diana, por ejemplo, en células de C. elegans es reducido por la presencia de estas grandes regiones no específicas. Semejante inhibición por el ADNdh no específico ha sido desarrollada en Drosophila por Tushl et al., Genes & Development 13:3191-3197 (1999). No solamente resulta afectado el potencial para inhibir la expresión 30 génica, si no que también se limita la cantidad de ARNdh específico producido. Tercero, la transcripción de la porción del esqueleto del vector, más concretamente la transcripción del origen de replicación y las estructuras relacionadas, da como resultado la inestabilidad del plásmido y la reorganización del plásmido, conduciendo a una reducción de la producción de ARNdh. Esta concentración relativamente baja de ARNdh eficaz conduce a su vez a un ARNi ineficaz.
Para concluir, los vectores previamente descritos tienen los siguientes defectos: son tóxicos para el organismo 35 alimenticio, una mayor parte de los transcritos producidos son no específicos, el potencial inhibidor del ADNdh es reducido por la presencia de regiones no específicas, elevada incidencia de las reorganizaciones de plásmidos y pérdida del plásmido desde el organismo alimentador. Por lo tanto un objeto de la presente invención es proporcionar vectores mejorados para la producción de ADNdh que eviten las desventajas de los vectores de la técnica anterior.
Los vectores para su uso en la síntesis in vitro de transcritos de ARN, por ejemplo la producción de sondas de 40 ARN, son conocidos y han sido utilizados comúnmente en la técnica durante algún tiempo (véase por ejemplo F. M. Ausubel et al. (eds.), Current Protocols in Molecular Biology, John Wiley & Sons, Inc. (1994); Jendrisak et al, Vectors for in vitro production of RNA copies of either strand of a cloned DNA sequence, documento US 4766072). En los protocolos de transcripción in vitro el problema de la transcripción de la lectura de las secuencias vectoras se evita generalmente linealizando el vector de transcripción en el sitio de restricción situado en el extremo 3' del transcrito 45 deseado. No obstante, esta solución no es apropiada para la transcripción in vivo o para la producción de ARNdh donde es importante que el molde sea transcrito en ambas direcciones.
Los autores de la presente invención proponen ahora una solución novedosa a los problemas encontrados con los vectores de la técnica anterior para la producción de ARNdh, basada en el uso de terminadores de la transcripción. Generalmente la solución consiste en el uso de al menos un terminador de la transcripción conectado operablemente al 50 menos a un promotor, donde el terminador detiene la transcripción iniciada por el promotor. Cualquier fragmento de ADN insertado entre el extremo 3' del promotor y el extremo 5' del terminador será transcrito después, sin la transcripción no deseada del esqueleto del vector. Preferentemente el vector consiste en dos promotores y dos terminadores, como se describe adicionalmente más abajo.
Por lo tanto, de acuerdo con un primer aspecto de la invención se proporciona un constructo de ADN que 55 comprende dos promotores oponibles flanqueando una región inter-promotores, comprendiendo adicionalmente el constructo al menos un terminador de la transcripción situado transcripcionalmente aguas abajo de uno de dichos
promotores. En particular, la invención proporciona:
un constructo de ADN que comprende:
a) un primer promotor y
b) un segundo promotor, en el cual el primero y segundo promotor están en orientación opuesta entre sí y definen: 5
c) una región inter-promotores situada aguas abajo del extremo 3' del primer promotor y aguas abajo del extremo 3' del segundo promotor, donde dicha región inter-promotores comprende una secuencia de nucleótidos que forma un molde para la producción de ARN de doble hebra.
e) un primer terminador de la transcripción, situado (como se observa desde el extremo 3' del primer promotor) aguas abajo del primer promotor y aguas abajo del al menos un sitio de clonación, donde el primer terminador 10 de la transcripción está conectado operablemente al primer promotor; caracterizado porque el primer y segundo promotores son promotores de bacteriófago, promotores procarióticos o promotores eucarióticos.
La región inter-promotores también puede ser definida adicionalmente como: la región de ADN entre el extremo 3' del primer promotor y el extremo 3' del segundo promotor, y que está aguas abajo del primer promotor, y que está aguas abajo del segundo promotor, y que preferiblemente no contiene el extremo 5' del primer promotor y del segundo 15 promotor. El primer promotor y el segundo promotor oponibles dirigen la expresión direccional desde sus extremos 5' a sus extremos 3' comenzando la transcripción aguas abajo de sus extremos 3', proporcionando de ese modo la transcripción de ambas hebras de cualquiera de las secuencias de nucleótidos presentes en la región inter-promotores.
En un segundo aspecto la invención proporciona el uso de un constructo de ADN para la producción de ARN de doble hebra para la inhibición de ARN, en el que dicho constructo de ADN comprende: 20
a) un primer promotor y
b) un segundo promotor,
en el que el primer y segundo promotores están en orientación opuesta entre sí y definen:
c) una región inter-promotores situada aguas abajo del extremo 3' del primer promotor y aguas abajo del extremo 3' del segundo promotor; 25
y cuyo constructo de ADN comprende adicionalmente:
d) al menos un sitio de clonación situado en la región inter-promotores; y
e) un primer terminador de la transcripción, situado (como se observa a partir del extremo 3' del primer promotor) aguas abajo... [Seguir leyendo]
Reivindicaciones:
1. Un constructo de ADN que comprende:
a) un primer promotor y
b) un segundo promotor,
donde el primer y segundo promotores están en orientación opuesta entre si y definen: 5
c) una región inter-promotores situada aguas abajo del extremo 3' del primer promotor y aguas abajo del extremo 3' del segundo promotor, donde dicha región inter-promotores comprende una secuencia de nucleótidos que forma un molde para la producción de ARN de doble hebra;
y cuyo constructo de ADN comprende adicionalmente:
d) un primer terminador de la transcripción, situado en la región inter-promotores aguas abajo, como se 10 observa desde el extremo 3' del primer promotor, del primer promotor, donde el primer terminador de la transcripción está conectado operablemente al primer promotor;
caracterizado porque el primer y segundo promotores son promotores de bacteriófago, promotores procarióticos o promotores eucarióticos.
2. Un constructo de ADN de acuerdo con la reivindicación 1, que comprende adicionalmente: 15
e) un segundo terminador de la transcripción situado en la región inter-promotores aguas abajo del segundo promotor, como se observa desde el extremo 3' del segundo promotor,
donde el segundo terminador de la transcripción está conectado operablemente al segundo promotor.
3. Un constructo de acuerdo con la reivindicación 1 o la reivindicación 2, donde el primer y el segundo promotores son idénticos. 20
4. Un constructo de ADN de acuerdo con la reivindicación 1 o reivindicación 2 donde el primer y el segundo promotores no son idénticos.
5. Un constructo de ADN de acuerdo con la reivindicación 3 o la reivindicación 4, donde el primer promotor y el segundo promotor se seleccionan independientemente entre los promotores de T7, T3 o SP6.
6. El uso de un constructo de ADN de acuerdo con una cualquiera de las reivindicaciones 1 a 4 para la 25 producción de ARN de doble hebra para la inhibición del ARN, con la condición de que el primer y segundo promotores del constructo de ADN no son promotores de bacteriófago.
7. Una cepa bacteriana que alberga un constructo de ADN, donde dicho constructo de ADN comprende:
a) un primer promotor y
b) un segundo promotor, 30
donde el primer y el segundo promotores están en orientación opuesta entre si y definen:
c) una región inter-promotores situada aguas abajo del extremo 3' del primer promotor y aguas abajo del extremo 3' del segundo promotor, donde la región inter-promotores comprende una secuencia de nucleótidos que forma un molde para la producción de ARN de doble hebra;
y cuyo constructo de ADN comprende adicionalmente: 35
d) un primer terminador de la transcripción situado en la región inter-promotores y aguas abajo del primer promotor, como se observa desde el extremo 3' del primer promotor, donde el primer terminador de la transcripción está conectado operablemente al primer promotor.
8. Una cepa bacteriana de acuerdo con la reivindicación 7, donde dicho constructo de ADN comprende adicionalmente: 40
e) un segundo terminador de la transcripción situado en la región inter-promotores y aguas abajo del segundo promotor, como se observa desde el extremo 3' del segundo promotor,
donde el segundo terminador de la transcripción está conectado operablemente al segundo promotor.
9. Una cepa bacteriana de acuerdo con la reivindicación 7 o la reivindicación 8, donde el primer y el segundo promotores del constructo de ADN son idénticos. 45
10. Una cepa bacteriana de acuerdo con la reivindicación 7 o la reivindicación 8, donde el primer y el segundo promotores del constructo de ADN no son idénticos.
11. Una cepa bacteriana de acuerdo con una cualquiera de las reivindicaciones 7 a 10, donde el primer y el segundo promotores son promotores de bacteriófago, promotores eucarióticos o promotores eucarióticos.
12. Una cepa bacteriana de acuerdo con la reivindicación 9 o reivindicación 10, donde el primer promotor y el 5 segundo promotor se seleccionan independientemente entre los promotores de T7, T3 o SP6.
13. Una cepa bacteriana de acuerdo con una cualquiera de las reivindicaciones 7 a 12, donde dicha cepa bacteriana es una cepa de E. coli.
14. El uso de la cepa bacteriana de acuerdo con una cualquiera de las reivindicaciones 7 a 11 o 13 para la producción de ARN de doble hebra para la inhibición del ARN, con la condición de que el primer y segundo promotores 10 del constructo de ADN no son promotores de bacteriófago.
15. El uso de un constructo de ADN para la producción de ARN de doble hebra para la inhibición de ARN, donde dicho constructo de ADN comprende:
a) un primer promotor y
b) un segundo promotor, 15
donde el primer y segundo promotores están en orientación opuesta entre si y definen:
c) una región inter-promotores situada aguas abajo del extremo 3' del primer promotor y aguas abajo del extremo 3' del segundo promotor;
y cuyo constructo de ADN comprende adicionalmente:
d) al menos un sitio de clonación situado en la región inter-promotores; y 20
e) un primer terminador de la transcripción, situado (como se observa desde el extremo 3' del primer promotor) aguas abajo del primer promotor y aguas abajo del al menos un sitio de clonación, donde el primer terminador de la transcripción está conectado operablemente al primer promotor, y donde el primer terminador de la transcripción está situado en la región inter-promotores;
caracterizado porque el primer y segundo promotores son promotores procarióticos o promotores 25 eucarióticos, pero no promotores de bacteriófago.
16. El uso de acuerdo con la reivindicación 15, donde dicho constructo de ADN comprende adicionalmente:
f) un segundo terminador de la transcripción situado, como se observa desde el extremo 3' del segundo promotor, aguas abajo del segundo promotor y aguas abajo del al menos un sitio de clonación,
donde el segundo terminador de la transcripción se conecta operablemente al segundo promotor. 30
17. El uso de acuerdo con la reivindicación 16, donde el segundo terminador de la transcripción está situado en la región inter-promotores.
19. El uso de acuerdo con la reivindicación 16 donde el segundo terminador de la transcripción está situado, como se observa desde el extremo 3' del segundo promotor, aguas abajo del segundo promotor, aguas abajo del al menos un sitio de clonación, y aguas abajo del extremo 5' del primer promotor. 35
19. El uso de acuerdo con la reivindicación 18, donde el extremo 3' del segundo terminador de la transcripción está separado del extremo 5' del primer promotor por no más de 2000 nucleótidos.
20. El uso de acuerdo con la reivindicación 18, donde el extremo 3' del segundo terminador de la transcripción está separado del extremo 5' del primer promotor por no más de 100 nucleótidos.
21. El uso de acuerdo con una cualquiera de las reivindicaciones 15 a 20, donde el primer y el segundo 40 promotores son idénticos.
22. El uso de acuerdo con una cualquiera de las reivindicaciones 15 a 20, donde el primer y el segundo promotores no son idénticos.
23. El uso de acuerdo con una cualquiera de las reivindicaciones 15 a 22, donde el sitio de clonación comprende al menos un sitio de restricción. 45
24. El uso de acuerdo con la reivindicación 23, donde el sitio de clonación comprende al menos dos sitios de restricción flanqueando una secuencia de ADN de relleno.
25. El uso de acuerdo con la reivindicación 24, donde los al menos dos sitios de restricción son idénticos.
26. El uso de acuerdo con una cualquiera de las reivindicaciones 15 a 25, donde el sitio de clonación comprende adicionalmente las secuencias de recombinación attR1 y attR2. 5
27. El uso de acuerdo con una cualquiera de las reivindicaciones 15 a 26, donde el sitio de clonación comprende adicionalmente una secuencia de nucleótidos ccdB.
28. El uso de acuerdo con la reivindicación 27, donde la secuencia de nucleótidos ccdB comprende adicionalmente al menos un sitio de restricción único.
29. El uso de acuerdo con la reivindicación 28, donde el al menos un sitio de restricción único es un sitio de 10 restricción con extremos romos.
30. El uso de acuerdo con la reivindicación 29, donde los sitios de restricción con extremos romos son sitios SrfI.
31. El uso de acuerdo con una cualquiera de las reivindicaciones 15 a 30, donde el constructo de ADN comprende adicionalmente: 15
g) un fragmento de ADN insertado en el al menos un sitio de clonación.
32. El uso de acuerdo con una cualquiera de las reivindicaciones 15 a 31, donde el constructo de ADN es un plásmido o un vector.
33. El uso de una cepa bacteriana que alberga un constructo de ADN para la producción de ARN de doble hebra para la inhibición de ARN, donde dicho constructo de ADN comprende: 20
a) un primer promotor y
b) un segundo promotor,
donde el primer y el segundo promotores están en orientación opuesta entre sí y definen:
c) una región inter-promotores situada aguas abajo del extremo 3' del primer promotor y aguas abajo del extremo 3' del segundo promotor; 25
y cuyo constructo de ADN comprende adicionalmente:
d) al menos un sitio de clonación situado en la región inter-promotores; y
e) un primer terminador de la transcripción, situado (como se observa desde el extremo 3' del primer promotor) aguas abajo del primer promotor y aguas abajo del al menos un sitio de clonación, donde el primer terminador de la transcripción está conectado operablemente al primer promotor, y donde el primer terminador de la 30 transcripción está situado en la región inter-promotores, con la condición de que el primer y el segundo promotores del constructo de ADN no sean promotores de bacteriófago.
34. El uso de acuerdo con la reivindicación 33, donde dicho constructo de ADN comprende adicionalmente:
f) un segundo terminador de la transcripción situado (como se observa desde el extremo 3' del segundo promotor) aguas abajo del segundo promotor y aguas abajo del al menos un sitio de clonación, 35
donde el segundo terminador de la transcripción está conectado operablemente al segundo promotor.
35. El uso de acuerdo con la reivindicación 34, donde el segundo terminador de la transcripción está situado en la región inter-promotores.
36. El uso de acuerdo con la reivindicación 34, donde el segundo terminador de la transcripción está situado, como se observa desde el extremo 3' del segundo promotor, aguas abajo del segundo promotor, aguas abajo del al 40 menos un sitio de clonación, y aguas abajo del extremo 5' del primer promotor.
37. El uso de acuerdo con la reivindicación 36, donde el extremo 3' del segundo terminador de la transcripción está separado del extremo 5' del primer promotor por no más de 2000 nucleótidos.
38. El uso de acuerdo con la reivindicación 36, donde el extremo 30 del segundo terminador de la transcripción está separado del extremo 5' del primer promotor por no más de 100 nucleótidos. 45
39. El uso de acuerdo con una cualquiera de las reivindicaciones 33 a 38, donde el primer y el segundo promotores del constructo de ADN son idénticos.
40. El uso de acuerdo con una cualquiera de las reivindicaciones 33 a 38, donde el primer y el segundo promotores del constructo de ADN no son idénticos.
41. El uso de acuerdo con una cualquiera de las reivindicaciones 33 a 40, donde el primer y el segundo 5 promotores del constructo de ADN son promotores procarióticos o promotores eucarióticos.
42. El uso de acuerdo con una cualquiera de las reivindicaciones 33 a 41, donde el constructo de ADN comprende adicionalmente un fragmento de ADN insertado en el al menos un sitio de clonación.
43. Una cepa bacteriana de acuerdo con una cualquiera de las reivindicaciones 33 a 42, donde el constructo de ADN es un plásmido o vector. 10
Patentes similares o relacionadas:
 Métodos para producir proteínas bicatenarias en bacterias, del 29 de Julio de 2020, de GENENTECH, INC.: Un método para producir un receptor de linfocitos T monoclonal de movilización inmunitaria contra el cáncer (ImmTAC) que comprende una cadena alfa del receptor de linfocitos […]
Métodos para producir proteínas bicatenarias en bacterias, del 29 de Julio de 2020, de GENENTECH, INC.: Un método para producir un receptor de linfocitos T monoclonal de movilización inmunitaria contra el cáncer (ImmTAC) que comprende una cadena alfa del receptor de linfocitos […]
Anticuerpo biespecífico o mezcla de anticuerpos con cadenas ligeras comunes, del 15 de Julio de 2020, de Jiangsu Alphamab Biopharmaceuticals Co., Ltd: Anticuerpo biespecífico o parte de unión a antígeno del mismo, en el que el anticuerpo biespecífico o la parte de unión a antígeno del mismo tiene una cadena […]
Vacunas y diagnóstico de torque teno virus porcino, del 18 de Junio de 2020, de VIRGINIA TECH INTELLECTUAL PROPERTIES, INC.: Composición inmunogénica que comprende una proteína según SEQ ID NO. 16.
Producción de FDCA catalizada por deshidrogenasa, del 17 de Junio de 2020, de PURAC BIOCHEM B.V.: Proceso para oxidar ácido 5-hidroximetil-2-furancarboxílico (HMFCA) a ácido 5-formil-2-furoico (FFA), donde el proceso comprende la etapa de incubar una […]
Vectores de AAV dirigidos a oligodendrocitos, del 10 de Junio de 2020, de THE UNIVERSITY OF NORTH CAROLINA AT CHAPEL HILL: Un ácido nucleico que codifica una cápside de AAV, comprendiendo el ácido nucleico una secuencia codificante de la cápside de AAV que es al menos el 96 % idéntica […]
Ácido nucleico que comprende o codifica para un tallo-bucle de histona y una secuencia poli(A) o una señal de poliadenilación para aumentar la expresión de un antígeno patogénico codificado, del 3 de Junio de 2020, de CureVac AG: Secuencia de ácido nucleico que comprende o codifica en la dirección 5' → 3' para: i) • una región codificante, que codifica para al menos […]
Microorganismo con productividad de l-lisina aumentada y procedimiento para producir l-lisina utilizando el mismo, del 27 de Mayo de 2020, de CJ CHEILJEDANG CORPORATION: Una subunidad beta prima (subunidad-β') mutante de la ARN polimerasa, en la que la subunidad beta prima (subunidad-β') mutante de la ARN polimerasa tiene […]
Agrupación de genes de biosíntesis de carrimicina, del 27 de Mayo de 2020, de Shenyang Fuyang Pharmaceutical Technology Co., Ltd: Agrupación de genes de biosíntesis de carrimicina, que consiste en 44 genes que comprende: 1) cinco genes de policétido sintasa, incluyendo los residuos […]