Vacuna contra Escherichia coli enterohemorrágica.
Una composición de vacuna que comprende una cantidad eficaz de un sobrenadante concentrado de cultivocelular de Escherichia coli enterohemorrágica (ECEH),
en donde el sobrenadante de cultivo celular, cultivadoen medio mínimo M-9 suplementado con NaHCO3 20-100 mM, MgSO4 5-10 mM, glucosa del 0,1-1,5% ycasaminoácidos del 0,05-0,5%, comprende un antígeno secretado por un sistema de secreción de tipo III y escapaz de estimular una respuesta inmunitaria contra ECEH, y un adyuvante inmunológico.
Tipo: Patente Internacional (Tratado de Cooperación de Patentes). Resumen de patente/invención. Número de Solicitud: PCT/CA2002/000019.
Solicitante: UNIVERSITY OF SASKATCHEWAN.
Nacionalidad solicitante: Canadá.
Dirección: 120 Veterinary Road Saskatoon Saskatchewan S7N 5E3 CANADA.
Inventor/es: POTTER, ANDREW, A., FINLAY,BRETT.
Fecha de Publicación: .
Clasificación Internacional de Patentes:
- A61K35/74 NECESIDADES CORRIENTES DE LA VIDA. › A61 CIENCIAS MEDICAS O VETERINARIAS; HIGIENE. › A61K PREPARACIONES DE USO MEDICO, DENTAL O PARA EL ASEO (dispositivos o métodos especialmente concebidos para conferir a los productos farmacéuticos una forma física o de administración particular A61J 3/00; aspectos químicos o utilización de substancias químicas para, la desodorización del aire, la desinfección o la esterilización, vendas, apósitos, almohadillas absorbentes o de los artículos para su realización A61L; composiciones a base de jabón C11D). › A61K 35/00 Preparaciones medicinales que contienen sustancias de constitución indeterminada o sus productos de reacción. › Bacterias (uso terapéutico de una proteína de la bacteria A61K 38/00).
- A61K39/02 A61K […] › A61K 39/00 Preparaciones medicinales que contienen antígenos o anticuerpos (materiales para ensayos inmunológicos G01N 33/53). › Antígenos bacterianos.
- A61K39/108 A61K 39/00 […] › Escherichia; Klebsiella.
- A61K39/39 A61K 39/00 […] › caracterizados por los aditivos inmunoestimulantes, p. ej. por los adyuvantes químicos.
- A61P31/00 A61 […] › A61P ACTIVIDAD TERAPEUTICA ESPECIFICA DE COMPUESTOS QUIMICOS O DE PREPARACIONES MEDICINALES. › Antiinfecciosos, es decir antibióticos, antisépticos, quimioterápicos.
- A61P31/04 A61P […] › A61P 31/00 Antiinfecciosos, es decir antibióticos, antisépticos, quimioterápicos. › Agentes antibacterianos.
- C07K1/02 QUIMICA; METALURGIA. › C07 QUIMICA ORGANICA. › C07K PEPTIDOS (péptidos que contienen β -anillos lactamas C07D; ipéptidos cíclicos que no tienen en su molécula ningún otro enlace peptídico más que los que forman su ciclo, p. ej. piperazina diones-2,5, C07D; alcaloides del cornezuelo del centeno de tipo péptido cíclico C07D 519/02; proteínas monocelulares, enzimas C12N; procedimientos de obtención de péptidos por ingeniería genética C12N 15/00). › C07K 1/00 Procedimientos generales de preparación de péptidos. › en solución.
- C07K1/34 C07K 1/00 […] › por filtración, ultrafiltración u ósmosis inversa.
- C07K14/245 C07K […] › C07K 14/00 Péptidos con más de 20 aminoácidos; Gastrinas; Somatostatinas; Melanotropinas; Sus derivados. › Escherichia (G).
- C12N1/20 C […] › C12 BIOQUIMICA; CERVEZA; BEBIDAS ALCOHOLICAS; VINO; VINAGRE; MICROBIOLOGIA; ENZIMOLOGIA; TECNICAS DE MUTACION O DE GENETICA. › C12N MICROORGANISMOS O ENZIMAS; COMPOSICIONES QUE LOS CONTIENEN; PROPAGACION, CULTIVO O CONSERVACION DE MICROORGANISMOS; TECNICAS DE MUTACION O DE INGENIERIA GENETICA; MEDIOS DE CULTIVO (medios para ensayos microbiológicos C12Q 1/00). › C12N 1/00 Microorganismos, p.ej. protozoos; Composiciones que los contienen (preparaciones de uso médico que contienen material de protozoos, bacterias o virus A61K 35/66, de algas A61K 36/02, de hongos A61K 36/06; preparación de composiciones de uso médico que contienen antígenos o anticuerpos bacterianos, p. ej. vacunas bacterianas, A61K 39/00 ); Procesos de cultivo o conservación de microorganismos, o de composiciones que los contienen; Procesos de preparación o aislamiento de una composición que contiene un microorganismo; Sus medios de cultivo. › Bacterias; Sus medios de cultivo.
PDF original: ES-2446984_T3.pdf
Fragmento de la descripción:
Vacuna contra Escherichia coli enterohemorrágica Campo de la invención La presente invención se refiere a composiciones y métodos para provocar una respuesta inmunitaria en mamíferos contra Escherichia coli enterohemorrágica. En particular, la invención se refiere al uso de sobrenadantes de cultivo celular para el tratamiento y la prevención de la colonización de mamíferos por E. coli enterohemorrágica.
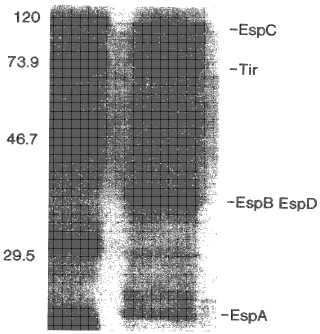
Antecedentes de la invención Escherichia coli enterohemorrágica (ECEH) , también denominada E. coli productora de toxina Shiga (ECTS) y E. coli vertotoxigénica (ECVT) son bacterias patogénicas que producen diarrea, colitis hemorrágica, síndrome urémico hemolítico, insuficiencia renal y muerte en seres humanos. Mientras que muchas cepas de ECEH productoras de toxinas similares a Shiga pueden producir enfermedades en seres humanos, las del serotipo O157:H7 producen la mayoría de las enfermedades humanas. Este organismo puede colonizar el intestino grueso de seres humanos mediante un mecanismo único en el que un número de determinantes de virulencia se administran a las células huésped a través de un sistema de secreción de tipo III, incluyendo el receptor de intimina translocado, Tir (DeVinney et al., Infect. Immun. (1999) 67:2389) . En particular, estos patógenos secretan determinantes de virulencia EspA, EspB y EspD que permiten la administración de Tir en las membranas de células intestinales. Tir se integra en la membrana de la célula huésped donde sirve como el receptor para una proteína de la membrana externa bacteriana, intimina. La unión Tir-intimina une ECEH a la superficie de células intestinales y desencadena reorganizaciones en el citoesqueleto de actina debajo de la ECEH adherente lo que produce la formación de un pedestal. EspA, EspB, Tir e intimina son cada una esencial para la colonización con éxito del intestino por ECEH.
Aunque ECEH coloniza el intestino de rumiantes y otros mamíferos, generalmente no producen enfermedad sintomática en estos animales. Sin embargo, la contaminación de la carne y el agua por el serotipo O157:H7 de ECEH (de aquí en adelante, “ECEH O157:H7”) es responsable de aproximadamente 50.000 casos de infección por ECEH O157:H7 en seres humanos al año en los Estados Unidos y Canadá lo que produce aproximadamente 500 muertes. En 1994, el coste económico asociado con la infección por ECEH O157:H7 en seres humanos se estimó que estaba por encima de 5 mil millones de dólares anuales.
El primer brote de ECEH O157:H7 documentado localizado a carne contaminada se produjo en 1982. Posteriormente, se demostró que los rumiantes saludables incluyendo, pero no limitados a, ganado vacuno, vacas lecheras y ovejas, podrían estar infectados con ECEH O157:H7. De hecho, informes de la USDA indican que hasta el 50% del ganado vacuno son portadores de ECEH O157:H7 en algún momento durante su vida y, por tanto, excretan ECEH O157:H7 en sus heces.
Debido al procesamiento mayoritario de ganado vacuno sacrificado y el bajo número de ECEH O157:H7 (10-100) necesario para infectar a un ser humano, la colonización por ECEH O157:H7 de ganado vacuno sano permanece como un problema de salud serio. Para abordar este problema, la investigación se ha enfocado en métodos mejorados para detectar y posteriormente aniquilar ECEH O157:H7 en el momento del sacrificio, alterar la dieta del ganado vacuno para reducir el número de ECEH O157:H7 intestinal e inmunizar animales para prevenir la colonización por ECEH O157:H7 (Zacek D. Animal Health and Veterinar y Vaccines, Alberta Research Counsel, Edmonton, Canadá, 1997) . Recientemente, se han descrito la producción y el uso recombinante de proteínas de ECEH O157:H7 incluyendo EspA recombinante (Publicación International No. WO 97/40063) , TIR recombinante (Publicación International No. WO 99/24576) , EspB recombinante e intimina recombinante (Li et al., Infec. Immun. (2000) 68:5090-5095) . Sin embargo, la producción y purificación de proteínas recombinantes en cantidades suficientes para su uso como antígenos es tanto difícil como cara. En el momento actual, no hay método eficaz para bloquear la colonización por ECEH O157:H7 de ganado vacuno y otros mamíferos y, por tanto, para reducir la excreción de ECEH en el medio ambiente.
Por tanto, existe una necesidad para composiciones y métodos nuevos para el tratamiento y la prevención de la enfermedad de ECEH, así como para reducir la colonización por ECEH de mamíferos para reducir la incidencia de problemas de salud asociados con carne y agua contaminados por ECEH.
Compendio de la invención La presente invención satisface la necesidad anterior proporcionando tales composiciones para su uso en tales métodos. En particular, los métodos descritos en el presente documento hacen uso de una composición de vacuna que comprende una cantidad eficaz de un sobrenadante de cultivo celular concentrado de Escherichia coli enterohemorrágica (ECEH) , en donde el sobrenadante de cultivo celular, hecho crecer en medio mínimo M9 suplementado con NaHCO3 20-100 mM, MgSO4 5-10 mM, glucosa del 0, 1-1, 5% y casaminoácidos del 0, 05-0, 5%, comprende un antígeno secretado por un sistema de secreción de tipo III y es capaz de estimular una respuesta inmunitaria contra ECEH, y un adyuvante inmunológico, tratándose y/o previniéndose con ello la infección por ECEH
y/o reduciéndose la colonización por ECEH del mamífero. Las composiciones se administran con un adyuvante coadministrado. En ciertas formas de realización, EspA y Tir comprenden al menos el 20% de la proteína del sobrenadante de cultivo celular. El sobrenadante del cultivo de ECEH puede derivar de cualquier serotipo de ECEH, pero preferiblemente se obtiene de un cultivo de ECEH O157, tal como ECEH O157:H7 o ECEH:NM (no móvil) . El sobrenadante del cultivo celular de la presente invención es fácil y relativamente barato de preparar y es eficaz a pautas de dosis que tienen toxicidad mínima.
EspA, EspB, Tir e intimina son necesarios para la activación (A) de rutas de transducción de señales de células epiteliales huéspedes y para la unión estrecha (E) de ECEH a las células huéspedes epiteliales. Por tanto, sin estar unido a la siguiente hipótesis, se cree que la administración del SCC de la presente invención a un mamífero estimula una respuesta inmunitaria contra uno o más antígenos secretados, tal como EspA y Tir, que bloquea la unión de ECEH a las células epiteliales intestinales.
Según esto, es un objeto de la presente invención proporcionar una vacuna eficaz para estimular una respuesta inmunitaria contra antígenos secretados de ECEH, tratando y/o previniendo con ello la enfermedad por ECEH en un mamífero.
Otro objeto es proporcionar una vacuna eficaz para reducir, prevenir y/o eliminar la colonización por ECEH de un rumiante u otro mamífero. Otro objeto es reducir el número de animales que excretan ECEH en el medio ambiente. Otro objeto es reducir el número de ECEH excretada en el medio ambiente por un animal infectado. Otro objeto es reducir el tiempo durante el cual ECEH se excreta en el medio ambiente por un animal infectado. En el presente documento se describe la reducción de la contaminación por ECEH del medio ambiente.
En el presente documento se describe la reducción de la contaminación por ECEH de carne y/o agua. En el presente documento se describe el tratamiento, prevención o reducción de infecciones por ECEH en seres humanos.
En el presente documento se describen vacunas eficaces como un auxiliar a otros agentes biológicos anti-ECEH. En el presente documento se describen vacunas eficaces como un auxiliar a agentes químicos anti-ECEH. En el presente documento se describen vacunas eficaces como un auxiliar a agentes anti-ECEH biológicamente
manipulados.
Otro objeto es proporcionar una vacuna eficaz como un auxiliar para agentes anti-ECEH basados en ácidos nucleicos. Otro objeto es proporcionar una vacuna eficaz como un auxiliar para agentes anti-ECEH proteínas recombinantes. Otro objeto es proporcionar un plan de vacunación eficaz para reducir la colonización por ECEH de un rumiante. Otro objeto es proporcionar un plan de vacunación eficaz para reducir la excreción de ECEH por un rumiante. Otro objeto es proporcionar una vacuna eficaz para reducir la colonización por ECEH O157 de ganado vacuno, tal
como la colonización de ECEH O157:H7 y/o ECEH:NM.
Otro objeto es proporcionar una vacuna eficaz para prevenir la colonización por ECEH O157 de ganado vacuno, tal como la colonización de ECEH O157:H7 y/o ECEH:NM. Otro objeto es proporcionar una vacuna eficaz para eliminar la colonización por ECEH O157:H7 de ganado vacuno,
tal como la colonización de ECEH O157:H7 y/o ECEH:NM.
... [Seguir leyendo]
Reivindicaciones:
1. Una composición de vacuna que comprende una cantidad eficaz de un sobrenadante concentrado de cultivo celular de Escherichia coli enterohemorrágica (ECEH) , en donde el sobrenadante de cultivo celular, cultivado en medio mínimo M-9 suplementado con NaHCO.
2. 100 mM, MgSO4 5-10 mM, glucosa del 0, 1-1, 5% y casaminoácidos del 0, 05-0, 5%, comprende un antígeno secretado por un sistema de secreción de tipo III y es capaz de estimular una respuesta inmunitaria contra ECEH, y un adyuvante inmunológico.
2. La composición de vacuna de la reivindicación 1, en donde ECEH es ECEH O157:H7.
3. La composición de vacuna de la reivindicación 1, en donde ECEH es ECEH O157:NM.
4. La composición de vacuna de cualquiera de las reivindicaciones 1-3, en donde el adyuvante inmunológico
comprende una emulsión de aceite en agua. 15
5. La composición de vacuna de la reivindicación 4, en donde el adyuvante inmunológico comprende un aceite de aceite mineral y bromuro de dimetildioctadecilamonio.
6. La composición de vacuna de la reivindicación 5, en donde el adyuvante inmunológico es VSA3.
7. La composición de vacuna de cualquiera de las reivindicaciones 1-6, en donde el adyuvante inmunológico está presente en la composición a una concentración del 10% al 50% (v/v) .
8. La composición de vacuna de la reivindicación 7, en donde el adyuvante inmunológico está presente en la 25 composición a una concentración del 20% al 30% (v/v) .
9. La composición de vacuna de cualquiera de las reivindicaciones 1-8, que comprende además uno o más antígenos de ECEH recombinantes o purificados seleccionados del grupo que consiste en EspA, EspB, EspD, Tir e intimina.
10. La composición de vacuna de la reivindicación 9, en donde EspA + Tir comprenden al menos el 20% de la proteína celular presente en la composición.
11. Uso de un sobrenadante de cultivo celular de Escherichia coli enterohemorrágica (ECEH) , en donde el
sobrenadante de cultivo celular, cultivado en medio mínimo M-9 suplementado con NaHCO.
2. 100 mM, MgSO4 5-10 mM, glucosa del 0, 1-1, 5% y casaminoácidos del 0, 05-0, 5%, comprende un antígeno secretado por un sistema de secreción de tipo III, en la fabricación de una composición de vacuna para provocar una respuesta inmunológica en un mamífero contra un antígeno de ECEH secretado, en donde dicha respuesta inmunológica proporciona protección contra la infección por ECEH, y en donde dicha composición de vacuna comprende un adyuvante inmunológico.
12. El uso de la reivindicación 11, en donde ECEH es ECEH O157:H7.
13. El uso de la reivindicación 11 o la reivindicación 12, en donde el mamífero es un rumiante. 45
14. El uso de la reivindicación 13, en donde el rumiante es un sujeto bovino.
15. El uso de la reivindicación 11, en donde el adyuvante inmunológico comprende una emulsión de aceite en agua.
16. El uso de la reivindicación 15, en donde el adyuvante inmunológico comprende un aceite de aceite mineral y bromuro de dimetildioctadecilamonio.
17. El uso de la reivindicación 16, en donde el adyuvante inmunológico VSA3. 55
18. El uso de cualquiera de las reivindicaciones 11-17, en donde la composición comprende además uno o más antígenos de ECEH recombinantes o purificados seleccionados del grupo que consiste en EspA, EspB, EspD, Tir e intimina.
19. El uso de la reivindicación 18, en donde EspA + Tir comprenden al menos el 20% de la proteína celular presente en la composición.
20. Un sobrenadante de cultivo celular de ECEH, cultivado en medio mínimo M9 suplementado con NaHCO3 20
100 mM, MgSO4 5-10 mM, glucosa del 0, 1-1, 5% y casaminoácidos del 0, 05-0, 5%, en donde el sobrenadante 65 de cultivo celular comprende una mezcla de antígenos secretados por un sistema de secreción de tipo III, y un adyuvante inmunológico para su uso en reducir la colonización de Escherichia coli enterohemorrágica (ECEH) en un rumiante.
21. Un sobrenadante de cultivo celular de ECEH, cultivado en medio mínimo M9 suplementado con NaHCO3 20
100 mM, MgSO4 5-10 mM, glucosa del 0, 1-1, 5% y casaminoácidos del 0, 05-0, 5%, en donde el sobrenadante de cultivo celular comprende una mezcla de antígenos secretados por un sistema de secreción de tipo III, y un adyuvante inmunológico en la fabricación de una composición para su uso en reducir la excreción de Escherichia coli enterohemorrágica (ECEH) de un rumiante.
22. La composición de vacuna de cualquiera de las reivindicaciones 1-10 en donde la composición de vacuna producida por el proceso de incubar un cultivo celular de ECEH en medio que comprende medio mínimo M9 suplementado con casaminoácidos al 0, 1%, glucosa al 0, 4%, MgSO4 8 mM y NaHCO3 44 mM, y combinar el sobrenadante del cultivo celular con un adyuvante inmunológico.
23. La composición de vacuna de cualquiera de las reivindicaciones 1-10 en donde el sobrenadante del cultivo celular se obtiene del cultivo de uno o más serotipos de ECEH y se combina con un adyuvante inmunológico.
24. La composición de vacuna según la reivindicación 23, en donde el uno o más serotipos de ECEH se seleccionan del grupo que consiste en O157, O158, O5, O8, O18, O26, O45, O48, O52, O55, O75, O76, O78,
O84, O91, O103, O104, O111, O113, O114, O116, O118, O119, O121, O125, O28, O145, O146, O163 y O165.
25. Un método de producir una composición de vacuna que comprende:
a) incubar un cultivo celular de Escherichia coli enterohemorrágica (ECEH) en medio que comprende medio mínimo M9 suplementado con NaHCO.
2. 100 mM, MgSO4 5-10 mM, glucosa del 0, 1-0, 5% y casaminoácidos del 0, 05-0, 5%;
b) obtener un sobrenadante de cultivo celular de ECEH; y c) combinar el sobrenadante del cultivo celular de ECEH con un adyuvante inmunológico para producir la 30 composición de vacuna.
26. El método de la reivindicación 25, en donde el medio mínimo M9 está suplementado con casaminoácidos al 0, 1%, glucosa al 0, 4%, MgSO4 8 mM y NaHCO3 44 mM.
27. El método de la reivindicación 25 o la reivindicación 26 en donde el sobrenadante del cultivo celular de ECEH se concentra.
28. El método de cualquiera de las reivindicacione.
2. 27 en donde el sobrenadante del cultivo celular de ECEH
se obtiene del cultivo de uno o más serotipos de ECEH. 40
29. El método de la reivindicación 28 en donde el uno o más serotipos de ECEH se seleccionan del grupo que consiste en O157, O158, O5, O8, O18, O26, O45, O48, O52, O55, O75, O76, O78, O84, O91, O103, O104, O111, O113, O114, O116, O118, O119, O121, O125, O28, O145, O146, O163 y O165.
Patentes similares o relacionadas:
 Cepas de Bordetella vivas atenuadas como vacuna de dosis única contra la tos ferina, del 29 de Julio de 2020, de INSTITUT PASTEUR DE LILLE: Una vacuna que comprende una cepa viva, atenuada y mutada de Bordetella pertussis que comprende al menos una mutación del gen (ptx) de la toxina […]
Cepas de Bordetella vivas atenuadas como vacuna de dosis única contra la tos ferina, del 29 de Julio de 2020, de INSTITUT PASTEUR DE LILLE: Una vacuna que comprende una cepa viva, atenuada y mutada de Bordetella pertussis que comprende al menos una mutación del gen (ptx) de la toxina […]
Vacuna subunitaria contra Mycoplasma spp., del 1 de Julio de 2020, de Agricultural Technology Research Institute: Una composición para prevenir una infección por Mycoplasma spp., que comprende: un principio activo, que comprende una proteína de PdhA; y un adyuvante […]
Un nuevo antígeno de vacuna no de VIH de la microbiota vaginal capaz de inducir una respuesta de anticuerpos protectores neutralizadores de la mucosa contra la infección por VIH, del 13 de Mayo de 2020, de B Cell Design: Un antígeno de permeasa de Mycoplasma genitalium o un polinucleótido que codifica dicho antígeno en forma expresable, para su uso en la prevención y/o el tratamiento […]
Composición inmunogénica que comprende antígenos de micoplasma, del 13 de Mayo de 2020, de BOEHRINGER INGELHEIM VETMEDICA GMBH: Una composición inmunogénica que comprende: a) una vacuna bacteriana inactivada completa de M. hyorhinis y una vacuna bacteriana inactivada completa de M. […]
Arginina desiminasa con reactividad cruzada reducida hacia anticuerpos para ADI - PEG 20 para el tratamiento del cáncer, del 6 de Mayo de 2020, de TDW Group: Una composición terapéutica que comprende una arginina desiminasa (ADI) aislada y un vehículo farmacéuticamente aceptable, en donde la ADI aislada comprende la secuencia de […]
Composiciones de flagelina y usos, del 6 de Mayo de 2020, de Genome Protection, Inc: Una composición relacionada con la flagelina, comprendiendo la composición una secuencia de aminoácidos que tiene al menos un 95 % de identidad de […]
Una vacuna para usar contra la infección asintomática por Lawsonia en un cerdo, del 6 de Mayo de 2020, de INTERVET INTERNATIONAL B.V: Una vacuna que comprende antígeno de Lawsonia intracellularis no vivo y un vehículo farmacéuticamente aceptable para usar en un método para reducir en un cerdo el impacto negativo […]
Composiciones de vacunas contra el síndrome reproductivo y respiratorio porcino y las enfermedades asociadas al circovirus porcino, del 29 de Abril de 2020, de Reber Genetics Co., Ltd: Una proteína de fusión que comprende: (a) un dominio de unión a células presentadoras de antígeno (APC) ubicado en el N-terminal de la proteína de fusión, en la […]