PROCEDIMIENTO MEJORADO PARA LA FABRICACION DE GABALACTAMA.
Procedimiento para la fabricación de gabalactama de fórmula 1.
Tipo: Resumen de patente/invención. Número de Solicitud: W02000225IN.
Solicitante: HIKAL LTD.
KUPPUSWAMY, NAGARAJAN
HARIHARAN, SIVARAMAKRISHNAN
MARIADAS, ARULSELVAN.
Nacionalidad solicitante: India.
Dirección: 6, NAWAB BUILDING, 327, DR. D N ROAD FORT,400001 MUMBAI.
Inventor/es: KUPPUSWAMY,NAGARAJAN, HARIHARAN,SIVARAMAKRISHNAN, MARIADAS,ARULSELVAN.
Fecha de Publicación: .
Fecha Concesión Europea: 12 de Agosto de 2009.
Clasificación Internacional de Patentes:
- C07D209/54 QUIMICA; METALURGIA. › C07 QUIMICA ORGANICA. › C07D COMPUESTOS HETEROCICLICOS (Compuestos macromoleculares C08). › C07D 209/00 Compuestos heterocíclicos que contienen ciclos de cinco miembros, condensados con otros ciclos, con solamente un átomo de nitrógeno como heteroátomo. › espirocondensados.
Clasificación PCT:
- C07D209/54 C07D 209/00 […] › espirocondensados.
Clasificación antigua:
- C07D209/54 C07D 209/00 […] › espirocondensados.
Fragmento de la descripción:
Procedimiento mejorado para la fabricación de gabalactama.
La presente invención se refiere a un procedimiento mejorado para la fabricación de gabalactama. La gabalactama es químicamente conocida como 2-azaspiro(4,5)decano-3-ona. La gabalactama tiene la fórmula estructural 1 que se indica a continuación.
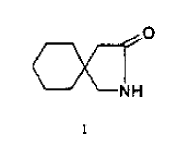
La gabalactama es útil como material de partida para el bien conocido antiepiléptico y analgésico, ácido 1-aminometilciclohexano-1-acético, conocido comúnmente como gabapentín que tiene la fórmula estructural 2.

También es un material de partida para algunos de los compuestos con fórmula estructural 3
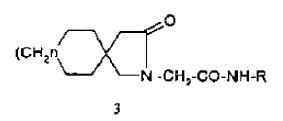
en la que (R) es un átomo de hidrógeno o un radical alifático de cadena corta saturado o insaturado y (n) es 0, 1o 2, tal como se indica en el documento USA 4228179, con actividad antiepiléptica. La gabalactama de fórmula 1 fue sintetizada por primera vez por Sircar en el laboratorio en 1928 (J. Ind. Chem. Soc., 1928, 5, 549; Chem. Abstracts, 1929, 23, 818). De manera especifica, Sircar llevó a cabo una reacción de Hofmann sobre la monoamida del ácido ciclohexano-1,1-diacético de la fórmula 4
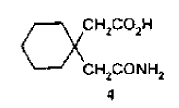
con hipobromito sódico alcalino a 55 grados C durante 2 horas. La solución de reacción fue acidificada con HCl y evaporada hasta estado seco. El residuo fue lavado con éter para eliminar ácidos orgánicos libres y, a continuación, extraído con acetona. El extracto de acetona fue evaporado hasta estado seco. El residuo fue neutralizado con un álcali y extraído en éter. Se indicó que la evaporación de este extracto había proporcionado gabalactama con un rendimiento de 46%.
El procedimiento publicado por Sircar (1928) si bien no es peligroso, tiene como resultado un rendimiento de 46% de gabalactama solamente. El procedimiento no es útil para la fabricación comercial de gabalactama a causa del número de etapas involucradas y del bajo rendimiento en gabalactama, haciendo el proceso caro y poco viable para la producción comercial de gabapentín para el que la gabalactama es el penúltimo y crucial intermediario.
No obstante, algunos procedimientos comerciales de preparación han aparecido más tarde (patentes USA nº 4152326 & nº 5091567 equivalentes a solicitud internacional PCT 9914184A & patente USA nº 5068413) que se explican a continuación.
La patente USA nº 4152326 da a conocer el tratamiento de la imida del ácido N-benceno sulfoniloxi-1,1-ciclohexano diacético con una solución alcohólica de etilato sódico que proporciona gabalactama.
La patente USA nº 5091567 (y la solicitud de patente internacional PCT 9914184A) da a conocer que la gabalactama puede ser fabricada a partir de ciclohexanona en 3 etapas:
1. Adición del reactivo de Wittig procedente de trietilfosfono acetato a ciclohexanona para proporcionar acetato de etil ciclohexilideno.
2. Adición de nitrometano al etil ciclohexilideno obtenido para formar acetato de etil 1-nitrometilciclohexano y
3. Reducción catalítica del derivado de nitrometilo.
La patente USA 5068413 da a conocer que la gabalactama puede ser obtenida a partir de ciclohexanona en 4 etapas, tal como se indica a continuación:
1. Conversión de la ciclohexanona en dietil ciclohexilideno malonato.
2. Adición de cianuro para formar dietil 1-cianociclohexil malonato.
3. Hidrólisis de dietil 1-cianociclohexil malonato a ácido 1-cianociclohexil malónico y
4. Hidrogenación catalítica del ácido 1-cianociclohexil malónico a temperatura elevada, resultando en una lactamización decarboxilativa.
De este modo, en los procesos descritos en la patente USA 5091567 y solicitud de patente internacional PTC 9914184A, se utilizaron nitrometano que es peligroso y reactivos de Wittig que son costosos. En la tercera etapa se utiliza hidrógeno gaseoso que es explosivo e inflamable y un catalizador pirofórico, tal como 10% Pd-C.
En la patente USA 5068413, existen las desventajas de manipular un cianuro sódico altamente tóxico en la segunda etapa y la utilización de rodio o níquel de Raney pirofórico que son caros como catalizador en la etapa final.
La patente USA 4152326 adolece del defecto de que se necesita manipular cloruro de benceno sulfonilo corrosivo y etóxido sódico, que son reactivos inflamables y tóxicos.
La patente USA 4024175 da a conocer la formación de gabalactama como subproducto en la reestructuración de Curtius de monometilciclohexano-1,1-diacetato. De este modo, el monometil ester es convertido en anhídrido mixto con etilcloroformato y trietil amina, que se expone a continuación a la azida sódica. La azida resultante es recogida en tolueno y sometida a descomposición térmica y la solución es evaporada. El acetato de metil 1-isocianato-1-ciclohexano residual es calentado con ácido clorhídrico al 20% y el extracto hidrolizado con cloroformo para eliminar la gabalactama como subproducto, mientras que el clorhidrato de gabapentín permanece en la solución acuosa.
Una reestructuración similar de Curtius del monometil ester del ácido cicloheptano-1,1-diacético proporciona el ácido 1-aminometil-1,1-cicloheptano. La formación de su lactama no ha sido observada.
Además, se ha descrito la reestructuración de Hofmann de la monoamida del ácido ciclopentano-1,1-diacético con hipobromito sódico. La reacción conduce al ácido 1-aminometilciclopentano-1-acético. La formación de la lactama correspondiente en la reacción no ha sido observada. El mismo ácido es asimismo obtenido por la reestructuración de Lossen del monohidroxamato diácido, sin que se forme lactama en la reacción.
Muy recientemente se ha dado a conocer un procedimiento para la fabricación de gabapentín en la patente india 186285. En el ejemplo 1 de dicha patente, para la preparación de clorhidrato del ácido 1 (amino metil) ciclohexano acético en crudo (conocido comúnmente como clorhidrato de gabapentín), se ha hecho referencia a la preparación de 2-aza espiro (4,5) decano-3 ona (conocido comúnmente como gabalactama) utilizando las condiciones estándar de la reacción de Hofmann empezando por la amida de la fórmula 4. Cuando los inventores siguieron dicho procedimiento para la preparación de 2-aza espiro (4,5) decano-3 ona (conocido habitualmente como gabalactama), el proceso dio resultados muy insatisfactorios, tal como se explica más adelante.
Los inventores llevaron a cabo la reacción de Hofmann sobre la amida de fórmula 4 utilizando bromo y variando las concentraciones de la solución de hidróxido sódico. Al final de la reacción, la solución fue acidificada con HCl. La solución ácida fue extraída con cloruro de metileno y la capa de cloruro de metileno fue evaporada hasta estado seco. El residuo, que se ha indicado que es gabalactama en el ejemplo 1 de dicha patente, era realmente una goma densa que muestra la presencia de gabalactama por métodos analíticos tales como HPLC. Este producto no solidifica incluso con sembrado con gabalactama estándar, que es un sólido muy cristalino, con punto de fusión en 88-92 grados C. El material gomoso se observó también que era fuertemente ácido y en la neutralización con un álcali, se liberó gabalactama de forma sólida. Se apreció, por lo tanto, que el producto extraído de la solución acidificada de la reacción de Hofmann podía ser el clorhidrato de gabalactama y no gabalactama propiamente, tal como se ha indicado en el ejemplo 1 de dicha patente. El producto gomoso fue sometido a HPLC. Si bien se encontró gabalactama como componente principal, otras impurezas se encontraban presentes, una de ellas más polar con un RRT (Tiempo de Retención Relativo) en medida significativa. Fue determinada la pureza de área en % en tres experimentos y en uno (a saber en el ejemplo nº 1) se determinó también el contenido de gabalactama (% peso). Los resultados se indican a continuación:
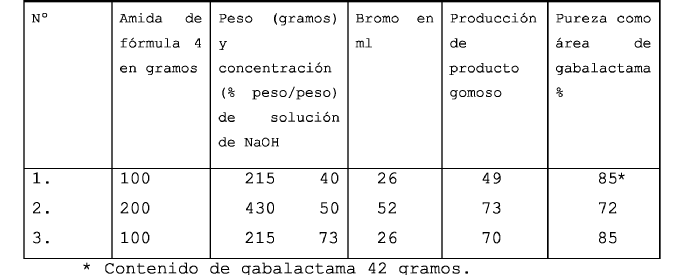
Los resultados de los experimentos anteriores...
Reivindicaciones:
1. Procedimiento para la fabricación de gabalactama de fórmula 1.
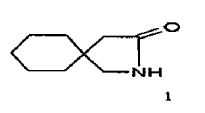
que comprende
(i) Preparar una solución acuosa de un hidróxido de un metal alcalino o alcalinotérreo con una concentración comprendida entre 10 y 20% en peso, añadiendo bromo a la solución resultante para conseguir la solución apropiada de hipobromito de un metal alcalino o alcalinotérreo con una concentración comprendida entre 5 y 10% en peso,
(ii) Añadir 1 parte en peso de una amida de fórmula 4
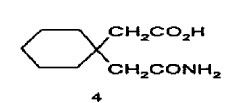
a 7,5-9,5 partes en peso de la solución del hipobromito de metal alcalino/alcalinotérreo obtenido en la etapa (1) durante un periodo de 1 a 4 horas, a una temperatura comprendida entre -10 y +10 grados C,
(iii) Mantener la mezcla resultante en reposo a una temperatura comprendida entre -10 y +10 grados C durante un periodo de tiempo entre 0,5 y 2 horas,
(iv) Calentar la mezcla gradualmente a una temperatura comprendida entre 80 y 100 grados C, durante un periodo comprendido entre 3 y 8 horas y con un periodo de reposo de 5-8 horas,
(v) Enfriar la mezcla de reacción a una temperatura comprendida entre 30 y 50 grados C,
(vi) Extraer la mezcla utilizando un disolvente no polar o una mezcla del mismo,
(vii) Someter la capa acuosa lavada de capa orgánica resultante a las etapas (iv) a (v) definidas anteriormente,
(viii) Combinar las capas orgánicas obtenidas en las etapas (vi) y (vii) entre si,
(ix) Lavar las capas orgánicas combinadas resultantes con agua a una temperatura comprendida entre 30 y 35 grados C, y
(x) Destilar el disolvente orgánico a una temperatura comprendida entre 60 y 110 grados C, a presión reducida.
2. Procedimiento, según la reivindicación 1, en el que en la etapa (1) el hidróxido de metal alcalino es hidróxido sódico.
3. Procedimiento, según las reivindicaciones 1 y 2, en el que en la etapa (i) la concentración de la solución de metal alcalino/alcalinotérreo se encuentra en un intervalo de 10 a 15%, más preferentemente 12,5%.
4. Procedimiento, según las reivindicaciones 1 a 3, en el que en la concentración del hipobromito se encuentra en el intervalo de 5 a 8% y más preferentemente es de 7% en peso.
5. Procedimiento, según las reivindicaciones 1 a 4, en el que se añade una parte de una amida de fórmula 4 a 8-9 partes, más preferentemente 8,5-9 partes de la solución de hipobromito sódico.
6. Procedimiento, según las reivindicaciones 1 a 5 en el que la adición es realizada durante un periodo comprendido entre 1 y 3 horas, más preferentemente 1-2 horas.
7. Procedimiento, según las reivindicaciones 1 a 6, en el que la temperatura utilizada durante la adición se mantiene preferentemente entre -5 a +5 grados C, más preferentemente entre -5 y 0 grados C.
8. Procedimiento, según las reivindicaciones 1 a 7, en el que el reposo de la mezcla de reacción se efectúa a una temperatura comprendida en el intervalo de -5 a -0 grados C, preferentemente durante un periodo en el intervalo de 0,5 y 1,5 horas y más preferentemente durante 1 hora.
9. Procedimiento, según las reivindicaciones 1 a 8, en el que en la etapa (iii) el calentamiento es efectuado preferentemente a una temperatura comprendida entre 80 y 90 grados C, más preferentemente entre 80 y 85 grados C.
10. Procedimiento, según la reivindicación 9, en el que el calentamiento es efectuado durante un periodo de 4 a 6 horas, más preferentemente de 4 horas.
11. Procedimiento, según las reivindicaciones 1 a 10, en el que el enfriamiento es efectuado a una temperatura comprendida en el intervalo de 35 a 45 grados C, más preferentemente 40 grados C.
12. Procedimiento, según las reivindicaciones 1 a 11, en el que la extracción es realizada utilizando un disolvente no polar alifático o aromático tal como dicloruro de etileno, dicloruro de metileno, hexano y tolueno, y más preferentemente un disolvente no polar aromático tal como tolueno.
13. Procedimiento, según las reivindicaciones 1 a 12, en el que la capa acuosa extraída mediante disolvente orgánico es calentada nuevamente a una temperatura en el intervalo de 80-100 grados C, durante un periodo de 3-8 horas, con reposo de 5-8 horas, siendo enfriado y reextraído con tolueno.
14. Procedimiento, según las reivindicaciones 1 a 13, en el que las capas orgánicas combinadas son tratadas con carbón activado para eliminar cualquier materia colorante presente en las mismas.
15. Procedimiento, según las reivindicaciones 1 a 14, en el que la destilación del disolvente orgánico se realiza preferentemente entre 60-90 grados C, y más preferentemente entre 60-65 grados C a presión reducida.
Patentes similares o relacionadas:
Procedimiento para la preparación de derivados de 1-H-pirrolidin-2,4-diona, del 22 de Julio de 2020, de BAYER CROPSCIENCE AKTIENGESELLSCHAFT: Compuestos de la fórmula (X) **(Ver fórmula)** en la que A, B y el átomo de carbono al que están unidos son cicloalquilo C6 saturado, […]
Nuevas 3-fenilpirrolidin-2,4-dionaa alquinil-sustituidas y su uso como herbicidas, del 20 de Marzo de 2019, de BAYER CROPSCIENCE AKTIENGESELLSCHAFT: N-Fenilpirrolidin-2,4-dionas alquinil-sustituidas de la fórmula (I),**Fórmula** o una sal agroquímicamente aceptable del mismo, en la que X = alquilo C1-C4, haloalquilo […]
Procedimiento para la preparación de derivados de 1-H-pirrolidin-2,4-diona, del 8 de Noviembre de 2018, de BAYER CROPSCIENCE AG: Procedimiento para la preparación de los compuestos de la fórmula (I) **Fórmula** en la que W representa hidrógeno, halógeno, alquilo, alquenilo, […]
Cetoenoles espirocíclicos sustituidos con bifenilo, del 9 de Octubre de 2018, de BAYER CROPSCIENCE AG: Compuestos de fórmula (I)**Fórmula** en la que W representa hidrógeno o metilo, X representa cloro o metilo, Y representa […]
Compuestos de tetraciclina sustituidos con 9-aminometilo, del 3 de Enero de 2018, de KBP BIOSCIENCES USA INC: Un compuesto de fórmula general I: **(Ver fórmula)** o una sal o solvato farmacéuticamente aceptable del mismo, en la que: R2a, R2b, R3, R10, R11 y R12 son cada […]
Cetoenoles sustituidos con haloalquilmetilenoxi-fenilo, del 19 de Abril de 2017, de Bayer Intellectual Property GmbH: Compuestos de fórmula (I)**Fórmula** en la que W representa hidrógeno, alquilo, halógeno, haloalquilo, alcoxi o haloalcoxi, X representa alquilo, alquenilo, […]
Proceso para preparar inhibidores del virus de la hepatitis C, del 27 de Julio de 2016, de Bristol-Myers Squibb Holdings Ireland: Un proceso para preparar un compuesto de formula (Z)**Fórmula** o una sal farmaceuticamente aceptable del mismo, en la que: R4 y R5 se seleccionan independientemente […]
Derivados de amina cíclica como antagonistas del receptor EP4, del 12 de Febrero de 2016, de Rottapharm Biotech S.r.l: Un compuesto de amina cíclica de Fórmula (I): **Fórmula** o una sal farmacéuticamente aceptable del mismo, en la que: A se selecciona […]