PEPTIDOS CONFORMACIONALMENTE RESTRINGIDOS QUE SE UNEN AL RECEPTOR ORL-1.
Ligando del receptor ORL-1, que comprende un segmento de dirección C-terminal del ligando nociceptina (NC) nativo,
que tiene la secuencia de aminoácidos de ID SEC Nº:3, habiéndose modificado dicho segmento de dirección mediante la sustitución de uno o más residuos de aminoácidos con uno o más aminoácidos promotores de hélices &945; (x&945;) o con uno o más análogos de aminoácidos promotores de hélices &945; (x&945;), en donde el por lo menos un análogo de aminoácido es AIB, en donde el segmento de dirección comprende una secuencia seleccionada del grupo consistente en: (X&945;)-RKS-A-RKL-A-NQ (ID SEC Nº:4); A-RKS-(X&945;)-RKL-A-NQ (ID SEC Nº:5); A-RKS-A-RKL-(X&945;)-NQ (ID SEC Nº:6); (X&945;)-RKS-(X&945;)-RKL-A-NQ (ID SEC Nº:7); (X&945;)-RKS-A-RKL-(X&945;)-NQ (ID SEC Nº:8); A-RKS-(X&945;)-RKL-(X&945;)-NQ (ID SEC Nº:9); y (X&945;)-RKS-(X&945;)-RKL-(X&945;)-NQ (ID SEC Nº:10); en donde el ligando comprende además un segmento de mensaje N-terminal de un ligando NC nativo, y sales y solvatos de los mismos farmacéuticamente aceptables
Tipo: Patente Internacional (Tratado de Cooperación de Patentes). Resumen de patente/invención. Número de Solicitud: PCT/US2003/013097.
Solicitante: EURO-CELTIQUE S.A..
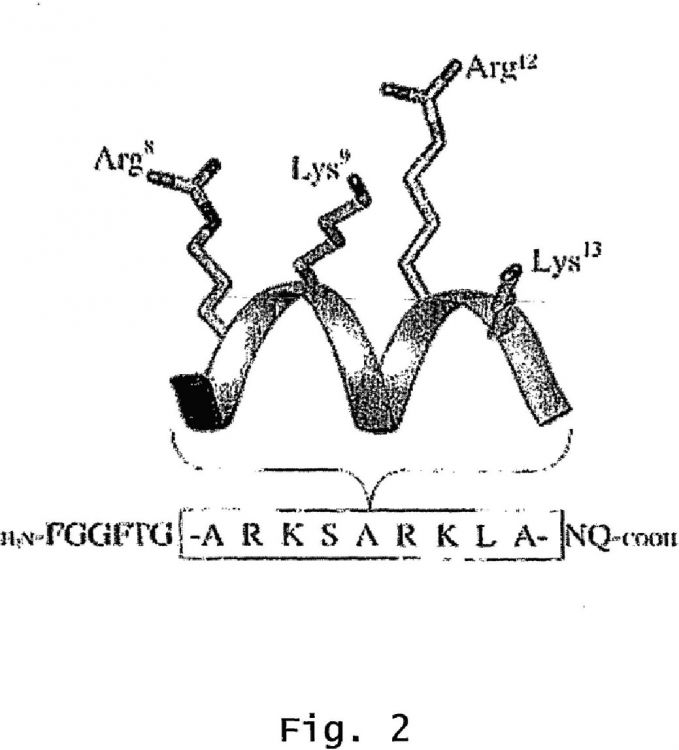
Nacionalidad solicitante: Luxemburgo.
Dirección: 2, AVENUE CHARLES DE GAULLE 1653 LUXEMBOURG LUXEMBURGO.
Inventor/es: KYLE,DONALD,J.
Fecha de Publicación: .
Fecha Solicitud PCT: 29 de Abril de 2003.
Fecha Concesión Europea: 7 de Julio de 2010.
Clasificación Internacional de Patentes:
- C07K14/575 QUIMICA; METALURGIA. › C07 QUIMICA ORGANICA. › C07K PEPTIDOS (péptidos que contienen β -anillos lactamas C07D; ipéptidos cíclicos que no tienen en su molécula ningún otro enlace peptídico más que los que forman su ciclo, p. ej. piperazina diones-2,5, C07D; alcaloides del cornezuelo del centeno de tipo péptido cíclico C07D 519/02; proteínas monocelulares, enzimas C12N; procedimientos de obtención de péptidos por ingeniería genética C12N 15/00). › C07K 14/00 Péptidos con más de 20 aminoácidos; Gastrinas; Somatostatinas; Melanotropinas; Sus derivados. › Hormonas.
- C07K14/665 C07K 14/00 […] › derivadas de pro-opiomelanocortina, pro-encefalina o pro-dinorfina.
Clasificación PCT:
- A01N37/18 NECESIDADES CORRIENTES DE LA VIDA. › A01 AGRICULTURA; SILVICULTURA; CRIA; CAZA; CAPTURA; PESCA. › A01N CONSERVACION DE CUERPOS HUMANOS O ANIMALES O DE VEGETALES O DE PARTES DE ELLOS (conservación de alimentos o productos alimenticios A23 ); BIOCIDAS, p. ej. EN TANTO QUE SEAN DESINFECTANTES, PESTICIDAS O HERBICIDAS (preparaciones de uso médico, dental o para el aseo que eliminan o previenen el crecimiento o la proliferación de organismos no deseados A61K ); PRODUCTOS QUE ATRAEN O REPELEN A LOS ANIMALES; REGULADORES DEL CRECIMIENTO DE LOS VEGETALES. › A01N 37/00 Biocidas, productos que atraen o repelen a los animales perjudiciales, o reguladores del crecimiento de los vegetales, que contienen compuestos orgánicos que tienen un átomo de carbono que posee tres enlaces a heteroátomos, con a lo más dos enlaces a un halógeno, p. ej. ácidos carboxílicos (conteniendo ácidos ciclopropanocarboxílicos o sus derivados, p. ej. nítrilos de ácidos ciclopropanocarboxílicos, A01N 53/00). › que contienen el grupo —CO—N , p. ej. amidas o imidas de ácido carboxílico; Sus tioanálogos.
- A61K38/00 A […] › A61 CIENCIAS MEDICAS O VETERINARIAS; HIGIENE. › A61K PREPARACIONES DE USO MEDICO, DENTAL O PARA EL ASEO (dispositivos o métodos especialmente concebidos para conferir a los productos farmacéuticos una forma física o de administración particular A61J 3/00; aspectos químicos o utilización de substancias químicas para, la desodorización del aire, la desinfección o la esterilización, vendas, apósitos, almohadillas absorbentes o de los artículos para su realización A61L; composiciones a base de jabón C11D). › Preparaciones medicinales que contienen péptidos (péptidos que contienen ciclos beta-lactama A61K 31/00; dipéptidos cíclicos que no tienen en su molécula ningún otro enlace peptídico más que los que forman su ciclo, p. ej. piperazina 2,5-dionas, A61K 31/00; péptidos basados en la ergolina A61K 31/48; que contienen compuestos macromoleculares que tienen unidades aminoácido repartidas estadísticamente A61K 31/74; preparaciones medicinales que contienen antígenos o anticuerpos A61K 39/00; preparaciones medicinales caracterizadas por los ingredientes no activos, p. ej. péptidos como soportes de fármacos, A61K 47/00).
- C07K1/00 C07K […] › Procedimientos generales de preparación de péptidos.
- C07K14/00 C07K […] › Péptidos con más de 20 aminoácidos; Gastrinas; Somatostatinas; Melanotropinas; Sus derivados.
- C07K17/00 C07K […] › Péptidos fijados sobre un soporte o inmovilizados; Su preparación.
- G01N33/53 FISICA. › G01 METROLOGIA; ENSAYOS. › G01N INVESTIGACION O ANALISIS DE MATERIALES POR DETERMINACION DE SUS PROPIEDADES QUIMICAS O FISICAS (procedimientos de medida, de investigación o de análisis diferentes de los ensayos inmunológicos, en los que intervienen enzimas o microorganismos C12M, C12Q). › G01N 33/00 Investigación o análisis de materiales por métodos específicos no cubiertos por los grupos G01N 1/00 - G01N 31/00. › Ensayos inmunológicos; Ensayos en los que interviene la formación de uniones bioespecíficas; Materiales a este efecto.
- G01N33/567 G01N 33/00 […] › utilizando un extracto de tejido o de órgano como agente de unión.
Clasificación antigua:
- A01N37/18 A01N 37/00 […] › que contienen el grupo —CO—N , p. ej. amidas o imidas de ácido carboxílico; Sus tioanálogos.
- A61K38/00 A61K […] › Preparaciones medicinales que contienen péptidos (péptidos que contienen ciclos beta-lactama A61K 31/00; dipéptidos cíclicos que no tienen en su molécula ningún otro enlace peptídico más que los que forman su ciclo, p. ej. piperazina 2,5-dionas, A61K 31/00; péptidos basados en la ergolina A61K 31/48; que contienen compuestos macromoleculares que tienen unidades aminoácido repartidas estadísticamente A61K 31/74; preparaciones medicinales que contienen antígenos o anticuerpos A61K 39/00; preparaciones medicinales caracterizadas por los ingredientes no activos, p. ej. péptidos como soportes de fármacos, A61K 47/00).
- C07K1/00 C07K […] › Procedimientos generales de preparación de péptidos.
- C07K14/00 C07K […] › Péptidos con más de 20 aminoácidos; Gastrinas; Somatostatinas; Melanotropinas; Sus derivados.
- C07K17/00 C07K […] › Péptidos fijados sobre un soporte o inmovilizados; Su preparación.
- G01N33/53 G01N 33/00 […] › Ensayos inmunológicos; Ensayos en los que interviene la formación de uniones bioespecíficas; Materiales a este efecto.
- G01N33/567 G01N 33/00 […] › utilizando un extracto de tejido o de órgano como agente de unión.
Países PCT: Austria, Bélgica, Suiza, Alemania, Dinamarca, España, Francia, Reino Unido, Grecia, Italia, Liechtensein, Luxemburgo, Países Bajos, Suecia, Mónaco, Portugal, Irlanda, Eslovenia, Finlandia, Rumania, Chipre, Lituania, Letonia, Ex República Yugoslava de Macedonia, Albania.
Fragmento de la descripción:
CAMPO DE LA INVENCIÓN [0001] La presente invención se refiere a ligandos peptidomiméticos del receptor tipo opioide 1 (“ORL-1”) que contienen ciertos aminoácidos conformacionalmente restringidos que favorecen conformaciones de hélices alfa. Los ligandos del receptor ORL-1 de la presente invención tienen uno o más residuos en un segmento de “dirección” para fomentar la formación de hélices alfa. Los ligandos de la presente invención incluyen agonistas del receptor ORL-1 que se pueden usar como analgésicos para tratar el dolor en un paciente que necesite dicho tratamiento, y también se pueden usar para tratar la ansiedad, la adicción, el síndrome de abstinencia y la tolerancia a los fármacos, así como para potenciar la memoria y el aprendizaje.
ANTECEDENTES DE LA INVENCIÓN [0002] El sistema opioide modula varios procesos fisiológicos incluyendo analgesia, respuestas al estrés, respuesta inmunes, respiración, y función neuroendocrina (Herz, Opioids 1993, Vol. 1, Springer-Verlag, Berlín). Estudios farmacológicos y de clonación molecular han identificado cuatro tipos de receptor opioide (μ, δ, κ, y ORL-1) que median estos diversos efectos (Miotto et al., The Pharmacology of Opioid Peptides (Ed. L. Tseng) 1995, 57-71, Harwood Acad. Publishers; Kieffer et al., Cell Mol. Neurobiol. 1995, 15:61535). Se sabe que los receptores opioides se acoplan a proteínas G sensibles a la toxina pertussis para modular la actividad adenilil ciclasa y corrientes de los canales de potasio y calcio (Handbook of Experimental Pharmacology, Vol. 104/I:Opioids I (Herz, A; Ed.) 1993, Springer-Verlag, Berlín; Duggan and North, Pharm. Rev. 1983, 35:219-282). [0003] Los opiáceos más usados clínicamente son los ligandos del receptor μ. Por ejemplo, las endorfinas y las encefalinas son ligandos endógenos para el receptor μ. La dinorfina A tiene también una alta afinidad para los receptores μ, aunque presenta una afinidad mayor para los receptores κ. La morfina y otros agonistas de tipo morfina producen analgesia principalmente a través de la interacción con receptores μ. Otros efectos fisiológicos que se asocian a la activación del receptor μ incluyen, entre otros, depresión respiratoria, miosis, motilidad gastrointestinal reducida, euforia (Pasternak, Clin. Neuropharmacol 1993, 16:1-18). Como consecuencia del efecto eufórico de los ligandos del receptor μ, se abusa de muchos de estos compuestos. Estudios de hibridación in situ han mostrado que hay presente ARNm del receptor μ en regiones cerebrales asociadas a la percepción del dolor (por ejemplo, la sustancia gris periacueductal, el núcleo trigeminal espinal, los núcleos cuneiforme y grácil, y el tálamo), a la respiración (por ejemplo, el núcleo del tracto solitario, el núcleo ambiguo, y el núcleo parabraquial), y a las náuseas y los vómitos (por ejemplo, neuronas del área postrema) (The Pharmacological Basis of Therapeutics, 9ª edición (Eds Hardman, JG and Limbird, LE) 1996, McGraw-Hill, Nueva York). Se establece como hipótesis que la adicción a ciertos analgésicos se produce a través de la hiperactivación de receptores μ. [0004] El receptor ORL-1 es un receptor acoplado a proteínas G identificado recientemente como miembro de la familia de receptores opioides que incluye los receptores μ, δ, y κ (Chen et al., FEBS Lett. 1994, 347: 279-83; Keith et al, Regul. Pept. 1994, 54: 143-44; Wick et al., Mol. Brain Res. 1994, 27:37-44; Wang et al., FEBS Lett. 1994, 348:75-79; Mollereau et al, FEBS Lett. 1994, 341:33-38; Lachowicz et al., J. Neurochem. 1995, 64: 34-40; Bunzow et al., FEBS Lett. 1994, 347:284-88; y Fukuda et al, FEBS Lett. 1994, 343:42-46). Varios estudios han demostrado un amplio espectro de funciones fisiológicas del receptor ORL-1 en los sistemas nerviosos tanto central como periférico y en tejidos no neuronales. Estas funciones incluyen modulación de la nocicepción (Meunier et al., Nature 1995, 377:532-5; Reinscheid et al., Science 1995, 270:792-94; Tian et a., Br. J. Pharmacology 1998, 124:21-6; Yamada et al., Br. J. Pharmacology 2002, 135:323-332; Yamada et al., J Med Chem 2000, 43:4667), actividad locomotora (Reinscheid et al., más arriba), reversión de la analgesia inducida por estrés (Mogil et al., Neuroscience 1996, 75:333-37), atenuación de las respuestas al estrés (Jenck et al., PNAS USA 1997, 94:14854-58), modulación del aprendizaje y la memoria (Mamiya et al., Brain Res. 1998, 783:236-40; Manabe et al., Nature 1998, 394:577-81; y Sandin et al., Eur. J. Neurosci. 1997, 9:194-97), regulación de la liberación de neurotransmisores y hormonas (Bryant et al., Brain Res. 1998, 807:228-33; Murphy et al., Neuroscience 1996, 75:1-4), modulación de la función renal (Kapusta et al., Life Sci. 1997, 60:PL15-21), y una función potencial en la diferenciación neuronal (Buzas et al., J. Neuroschem. 1999, 72:1882-89; Saito et al, Biochem. Biophs. Res. Commun. 1995, 217:539-45; y Saito et al., J. Bio. Chem. 1996, 271:15615-22). [0005] El agonista endógeno de este receptor es el heptadecapéptido, nociceptina (designado en el presente documento como “NC”), un péptido de 17 aminoácidos que tiene la secuencia FGGFTGARKSARKLANQ (ID SEC Nº: 1) (Meunier et al., 1995, más arriba), u orfanina FQ (Reinscheid et al., 1995, más arriba). Se ha sugerido que la porción N-terminal de la NC, es decir, FGGF (ID SEC Nº: 2), a la que se hace referencia frecuentemente como el “mensaje”, es principalmente responsable de la activación de la estimulación del receptor ORL-1. Al resto de NC, es decir, TGARKSARKLANQ (ID SEC Nº: 3), se le hace referencia como “dirección”, y se cree que está implicado en la unión y la especificidad de los receptores (Guerrini et al., J. Med. Chem. 1997, 40 (12): 1789-93). [0006] El receptor ORL-1 tiene siete dominios transmembrana. Debido a su compleja estructura unida a membrana, la estructura del complejo ligando-receptor NC-ORL-1 nativo no se puede resolver por métodos convencionales, tales como cristalografía de rayos X o espectroscopia de NMR. Como consecuencia, los investigadores han recurrido a métodos indirectos para determinar la estructura tridimensional del complejo ligando-receptor, tales como la modelización molecular (Huang et al., Acta Pharmacol. Sin. 2000, 21:536-46; y Facchiano et al., Protein Eng. 1999, 10:893-99), la dilucidación de la conformación de soluciones de NC mediante NMR (Biochem. Biophys. Res. Commun. 1997, 233:640-43), y la síntesis de ciertos análogos de la NC conformacionalmente restringidos (Ambo et al., J. Med. Chem. 2001, 44:4015-18. [0007] El fundamento para este último planteamiento se basa en la premisa de que los grados conformacionales de libertad en la secuencia de NC, lineal, nativa se podrían reducir significativamente mediante la introducción de restricciones conformacionales. Dichas restricciones pueden reducir la flexibilidad del péptido a un número pequeño de conformaciones predecibles y/o resolubles experimentalmente. Las afinidades y/o eficacias determinadas experimentalmente de dichos péptidos restringidos, cuando se consideran conjuntamente con la conformación tridimensional impuesta, pueden proporcionar claves tangibles en relación con la estructura bioactiva del ligando peptídico. [0008] Ambo et al. (más arriba) describe la síntesis de una serie de péptidos cíclicos mediante la formación de un enlace disulfuro de cadena lateral a cadena lateral entre dos residuos de cisteína. Como la NC no contiene cisteína en la secuencia nativa, este artículo informaba sobre la alteración de la secuencia nativa mediante sustitución con y/o inserción de una cisteína en varias posiciones. Adicionalmente, el artículo describía el truncamiento de la secuencia nativa eliminando ciertos residuos del extremo C-terminal. Los datos presentados en el artículo demostraban que ciclaciones en la porción N-terminal o central de la secuencia reducen significativamente la potencia de unión y funcional en el receptor ORL-1, mientras que la ciclación en el extremo C-terminal produce agonistas con potencias comparables a la NC nativa. De este modo, la forma bioactiva de la NC no es probablemente cíclica o seudocíclica en el extremo N-terminal o en la porción central de la secuencia nativa. No obstante, el estudio de Ambo et al. informaba sobre la aplicación de alteraciones sustanciales en la secuencia de NC nativa, lo cual limita la capacidad de interpretar la estructura real del complejo nativo ligando-receptor. [0009] Existe una necesidad continuada, en la técnica, de desarrollar ligandos que sean altamente selectivos para un receptor opioide con respecto a otro. La comprensión de cómo la NC nativa se une a y activa el receptor ORL-1 en el nivel molecular sería una herramienta valiosa que...
Reivindicaciones:
1. Ligando del receptor ORL-1, que comprende un segmento de dirección C-terminal del ligando nociceptina (NC) nativo, que tiene la secuencia de aminoácidos de ID SEC Nº:3, habiéndose modificado dicho segmento de dirección mediante la sustitución de uno o más residuos de aminoácidos con uno o más aminoácidos promotores de hélices α (xα) o con uno
o más análogos de aminoácidos promotores de hélices α (xα), en donde el por lo menos un análogo de aminoácido es AIB, en donde el segmento de dirección comprende una secuencia seleccionada del grupo consistente en:
(Xα)-RKS-A-RKL-A-NQ (ID SEC Nº:4); A-RKS-(Xα)-RKL-A-NQ (ID SEC Nº:5); A-RKS-A-RKL-(Xα)-NQ (ID SEC Nº:6); (Xα)-RKS-(Xα)-RKL-A-NQ (ID SEC Nº:7); (Xα)-RKS-A-RKL-(Xα)-NQ (ID SEC Nº:8); A-RKS-(Xα)-RKL-(Xα)-NQ (ID SEC Nº:9); y
(Xα)-RKS-(Xα)-RKL-(Xα)-NQ (ID SEC Nº:10);
en donde el ligando comprende además un segmento de mensaje N-terminal de
un ligando NC nativo, y sales y solvatos de los mismos farmacéuticamente
aceptables.
2. Ligando del receptor ORL-1, que comprende un segmento de dirección C-terminal del ligando nociceptina (NC) nativo, que tiene la secuencia de aminoácidos de ID SEC Nº:3, habiéndose modificado dicho segmento de dirección mediante la sustitución de uno o más residuos de aminoácidos con uno o más aminoácidos promotores de hélices α (Xα) o con uno
o más análogos de aminoácidos promotores de hélices α (xα), en donde el por lo menos un análogo de aminoácido es AIB, en donde el segmento de dirección comprende una secuencia seleccionada del grupo consistente en:
A-RKS-(Xα)-RK (ID SEC Nº:48); (Xα)-RKS-A-RK (ID SEC Nº:49); y (Xα)-RKS-(Xα)-RK (ID SEC Nº:50);
en donde el ligando comprende además un segmento de mensaje N-terminal de un ligando NC nativo, y sales y solvatos de los mismos farmacéuticamente aceptables.
3. Ligando del receptor ORL-1 según la reivindicación 1, que comprende una secuencia seleccionada del grupo consistente en: FGGF-TG-(Xα)-RKS-A-RKL-A-NQ (ID SEC Nº:18); FGGF-TG-A-RKS-(Xα)-RKL-A-NQ (ID SEC Nº:19); FGGF-TG-A-RKS-A-RKL-(Xα)-NQ (ID SEC Nº:20); FGGF-TG-(Xα)-RKS-(Xα)-RKL-A-NQ (ID SEC Nº:21); FGGF-TG-(Xα)-RKS-A-RKL-(Xα)-NQ (ID SEC Nº:22; FGGF-TG-A-RKS-(Xα)-RKL-(Xα)-NQ (ID SEC Nº:23); y FGGF-TG-(Xα)-RKS-(Xα)-RKL-(Xα)-NQ (ID SEC Nº:24);
en donde cada Xα es un aminoácido inductor de hélices alfa o análogo de aminoácido inductor de hélices alfa, igual o diferente, seleccionado de forma independiente, en donde el por lo menos un análogo de aminoácido es AIB; y sales y solvatos de los mismos farmacéuticamente aceptables.
4. Ligando del receptor ORL-1 según la reivindicación 2, que comprende una secuencia seleccionada del grupo consistente en: FGGF-TG-A-RKS-(Xα)-RK-NH2 (ID SEC Nº:51); FGGF-TG-(Xα)-RKS-A-RK-NH2 (ID SEC Nº:52); y FGGF-TG-(Xα)-RKS-(Xα)-RK-NH2 (ID SEC Nº:53);
en donde cada Xα es un aminoácido inductor de hélices alfa o análogo de aminoácido inductor de hélices alfa, igual o diferente, seleccionado de forma independiente, en donde el por lo menos un análogo de aminoácido es AIB; y sales y solvatos de los mismos farmacéuticamente aceptables.
5. Ligando del receptor ORL-1 de cualquiera de las reivindicaciones anteriores, en el que el grupo carboxilo en el residuo de aminoácido C-terminal está sustituido con una fracción seleccionada del grupo consistente en un éster, una cetona, una amida sustituida, una amida no sustituida, un éter, y una amina.
6. Uso del ligando del ORL de cualquiera de las reivindicaciones anteriores en la fabricación de un medicamento para tratar el dolor en un paciente que necesite dicho tratamiento, en donde el tratamiento comprende administrar al paciente una cantidad eficaz analgésica del ligando del ORL.
7. Uso del ligando del ORL de cualquiera de las reivindicaciones 1 a 5 en la fabricación de un medicamento para tratar la ansiedad, la adicción a fármacos, la abstinencia de fármacos, o la tolerancia a fármacos en un paciente que necesite dicho tratamiento, en donde el tratamiento comprende administrar al paciente una cantidad terapéuticamente eficaz del ligando del ORL.
8. Uso del ligando del ORL de cualquiera de las reivindicaciones 1 a 5 en la fabricación de un medicamento para potenciar la función cognitiva en un paciente que necesite dicho tratamiento, en donde el tratamiento comprende administrar al paciente una cantidad terapéuticamente eficaz del ligando del ORL.
9. Uso del ligando del ORL de cualquiera de las reivindicaciones 1 a 5 en la fabricación de un medicamento para modular una respuesta farmacológica de un receptor ORL-1, en donde la modulación de la respuesta farmacológica comprende hacer entrar en contacto el receptor ORL-1 con el ligando del receptor ORL-1 y en donde el medicamento se puede usar para tratar el dolor, la ansiedad, la adicción a fármacos, la abstinencia de fármacos, o la tolerancia a fármacos, o para potenciar la función cognitiva.
10. Composición farmacéutica que comprende el ligando del receptor ORL-1 de cualquiera de las reivindicaciones 1 a 5, siendo dicho ligando del receptor ORL-1 un agonista, combinado con un vehículo farmacéuticamente aceptable.
11. Kit, que comprende un recipiente estéril que comprende la composición farmacéutica de la reivindicación 10, y una etiqueta impresa o un conjunto de instrucciones impresas que guían el uso del agonista para tratar el dolor, la ansiedad, la adicción a fármacos, la abstinencia de fármacos o la tolerancia a fármacos, o para potenciar la función cognitiva, en un paciente que necesite dicho tratamiento.
12. Método de cribado para compuestos capaces de modular la actividad del receptor ORL-1, que comprende:
(a) obtener un ligando del ORL-1 según la reivindicación 1;
(b) combinar el ligando de la etapa (a) con un receptor ORL-1, o una porción del mismo de unión al ligando, bajo condiciones que permitan o induzcan la formación de un complejo ligando-receptor;
(c) exponer el complejo ligando-receptor de la etapa (b) a un compuesto de prueba; y
(d) detectar: (i) el desplazamiento del ligando con respecto al complejo
ligando-receptor, o (ii) un cambio en la actividad del receptor ORL-1; en donde un compuesto de prueba del que se determina que desplaza el ligando del ORL-1 con respecto al complejo ligando-receptor, o que provoca un cambio en la actividad del receptor ORL-1, se identifica como compuesto capaz de modular la actividad del receptor ORL-1.
13. Ligando de la reivindicación 1, en el que el ligando se une al receptor con una Ki de unión de por lo menos aproximadamente la Ki de unión de un ligando NC nativo.
14. Ligando de la reivindicación 1, en el que el ligando es un agonista total, agonista parcial, antagonista total, antagonista parcial, o agonista inverso.
15. Método de cribado para compuestos capaces de interaccionar con un receptor ORL-1, que comprende:
(a) obtener un compuesto según la reivindicación 1.
(b) someter a prueba el compuesto en relación con su capacidad de unirse a un receptor ORL-1, o en relación con su capacidad de potenciar o antagonizar el receptor ORL-1;
en donde un compuesto del que se determina que se une a, potencia, o antagoniza, el receptor ORL-1 se identifica como compuesto capaz de interaccionar con el receptor ORL-1.
16. Ligando del receptor ORL-1 de cualquiera de las reivindicaciones 1 a 5 para su uso en el tratamiento del dolor, la ansiedad, la adicción a fármacos, la abstinencia de fármacos, o la tolerancia a fármacos, o para potenciar la función cognitiva en un paciente que necesite dicho tratamiento, en donde el tratamiento comprende administrar al paciente una cantidad eficaz del ligando del ORL.
Patentes similares o relacionadas:
Antagonistas peptídicos de la familia calcitonina CGRP de hormonas peptídicas y su uso, del 17 de Junio de 2020, de Soares, Christopher, J: Un antagonista del péptido relacionado con el gen de la calcitonina, o una sal farmacéuticamente aceptable del mismo, teniendo dicho antagonista la estructura […]
Una composición para el tratamiento de la diabetes que comprende un análogo de oxintomodulina, del 11 de Marzo de 2020, de HANMI PHARM. CO., LTD.: Una composición para su uso en la prevención o el tratamiento de la diabetes, la composición comprende un conjugado de análogo de oxintomodulina como un ingrediente […]
Modelo de cerdo para la diabetes, del 29 de Enero de 2020, de AARHUS UNIVERSITET: Un cerdo transgénico que comprende un gen de polipéptido amiloide de los islotes (IAPP) mutado humano o parte del mismo, y que muestra al menos […]
Variantes mejoradas de unión de anti-albúmina sérica, del 18 de Diciembre de 2019, de GLAXO GROUP LIMITED: Un conjugado que comprende un fármaco NCE conjugado a un dominio variable único de inmunoglobulina antialbúmina sérica (SA) que comprende la secuencia de aminoácidos de SEQ […]
POLIPÉPTIDOS, del 4 de Diciembre de 2019, de NOVO NORDISK A/S: Un polipéptido de acuerdo con la Fórmula (I): Xaa1-Cys-Xaa3-Thr-Ala-Thr-Cys-Ala-Thr-Gln-Arg-Leu-Ala-Xaa14-Phe-Leu- Xaa17-Xaa18-Ser-Ser- Xaa21- […]
Polipéptidos de acción prolongada y métodos para producirlos y administrarlos, del 4 de Diciembre de 2019, de OPKO Biologics Ltd: Un polipéptido que comprende una actividad biológica, dicho polipéptido comprende un péptido de interés, un solo péptido carboxilo terminal (CTP) de gonadotropina coriónica unido […]
Análogos de cortistatina para el tratamiento de enfermedades inflamatorias y/o inmunes, del 23 de Octubre de 2019, de BCN PEPTIDES, S.A.: Un compuesto análogo de cortistatina de fórmula general (I), R1-AA1-AA2-AA3-AA4-c[Cys-AA5-Asn-X-Y-Trp-Lys-Thr-Z-AA6-Ser-Cys]-AA7-R2 sus […]
Compuestos coagonistas de GIP y GLP-1, del 14 de Agosto de 2019, de ELI LILLY AND COMPANY: Un compuesto de Fórmula: YX1EGTFTSDYSIX2LDKIAQKAX3VQWLIAGGPSSGAPPPS; en la que X1 es Aib; X2 es Aib; K en la posición 20 se modifica químicamente […]