PÉPTIDO OBTENIDO DEL RECEPTOR 1 DEL FACTOR DE CRECIMIENTO ENDOTELIAL VASCULAR QUE SE ENLAZA CON LA INTEGRINA ALFA5BETA1 QUE PRESENTA UNA ACTIVIDAD PROANGIOGÉNICA.
Péptido que consiste en la secuencia de aminoácidos YLXHR que presenta efecto proangiogénico caracterizado porque X se selecciona de entre el grupo que consiste en:
Ala/A, Arg/R, Asn/N, Asp/D, Cys/C, Glu/E, Gln/Q, Gly/G, Ile/I, Leu/L, Lys/K, Met/M, Phe/F, Pro/P, Ser/S, Thr/T, Trp/W, Tyr/Y y Val/V
Tipo: Patente Internacional (Tratado de Cooperación de Patentes). Resumen de patente/invención. Número de Solicitud: PCT/IT2007/000551.
Solicitante: Provincia Italiana Della Congregazione Dei Figli Dell'Immacolata Concezione - Istituto Dermopatico Dell'Immacolata
Consiglio Nazionale delle Ricerche
UNIVERSITA' DEGLI STUDI DI ROMA "LA SAPIENZA".
Nacionalidad solicitante: Italia.
Dirección: Via dei Monti di Creta 104 00167 Roma ITALIA.
Inventor/es: TRAMONTANO, ANNA, D\'ATRI,Stefania, FAILLA,Cristina Maria, LACAL,Pedro Miguel, ORECCHIA,Angela, ZAMBRUNO,Giovanna, SORO,Simonetta, MOREA,Veronica.
Fecha de Publicación: .
Fecha Solicitud PCT: 31 de Julio de 2007.
Clasificación Internacional de Patentes:
- C07K14/71 QUIMICA; METALURGIA. › C07 QUIMICA ORGANICA. › C07K PEPTIDOS (péptidos que contienen β -anillos lactamas C07D; ipéptidos cíclicos que no tienen en su molécula ningún otro enlace peptídico más que los que forman su ciclo, p. ej. piperazina diones-2,5, C07D; alcaloides del cornezuelo del centeno de tipo péptido cíclico C07D 519/02; proteínas monocelulares, enzimas C12N; procedimientos de obtención de péptidos por ingeniería genética C12N 15/00). › C07K 14/00 Péptidos con más de 20 aminoácidos; Gastrinas; Somatostatinas; Melanotropinas; Sus derivados. › para factores de crecimiento; para reguladores de crecimiento.
Clasificación PCT:
- A61K38/18 NECESIDADES CORRIENTES DE LA VIDA. › A61 CIENCIAS MEDICAS O VETERINARIAS; HIGIENE. › A61K PREPARACIONES DE USO MEDICO, DENTAL O PARA EL ASEO (dispositivos o métodos especialmente concebidos para conferir a los productos farmacéuticos una forma física o de administración particular A61J 3/00; aspectos químicos o utilización de substancias químicas para, la desodorización del aire, la desinfección o la esterilización, vendas, apósitos, almohadillas absorbentes o de los artículos para su realización A61L; composiciones a base de jabón C11D). › A61K 38/00 Preparaciones medicinales que contienen péptidos (péptidos que contienen ciclos beta-lactama A61K 31/00; dipéptidos cíclicos que no tienen en su molécula ningún otro enlace peptídico más que los que forman su ciclo, p. ej. piperazina 2,5-dionas, A61K 31/00; péptidos basados en la ergolina A61K 31/48; que contienen compuestos macromoleculares que tienen unidades aminoácido repartidas estadísticamente A61K 31/74; preparaciones medicinales que contienen antígenos o anticuerpos A61K 39/00; preparaciones medicinales caracterizadas por los ingredientes no activos, p. ej. péptidos como soportes de fármacos, A61K 47/00). › Factores de crecimiento; Reguladores de crecimiento.
- C07K14/71 C07K 14/00 […] › para factores de crecimiento; para reguladores de crecimiento.
Países PCT: Austria, Bélgica, Suiza, Alemania, Dinamarca, España, Francia, Reino Unido, Grecia, Italia, Liechtensein, Luxemburgo, Países Bajos, Suecia, Mónaco, Portugal, Irlanda, Eslovenia, Finlandia, Rumania, Chipre, Lituania, Letonia, Ex República Yugoslava de Macedonia, Albania.
PDF original: ES-2358370_T3.pdf
Fragmento de la descripción:
Péptido obtenido del receptor 1 del factor de crecimiento endotelial vascular que se enlaza con la integrina α5β1, que presenta una actividad proangiogénica.
La presente invención se refiere al campo de la biología molecular y, en particular, a la secuencia peptídica aislada en el dominio de la Ig de tipo II del VEGFR-1 que se puede enlazar con la integrina α5β1 y activar la misma. En particular, la secuencia peptídica aislada, objetivo de la presente invención, se puede utilizar ventajosamente en la preparación de fármacos que presenten una actividad proangiogénica en el tratamiento de patologías que se benefician de la formación de nuevos vasos sanguíneos.
El receptor 1 del factor de crecimiento endotelial vascular (VEGFR-1) es una tirosina cinasa del receptor para elementos específicos de la familia del factor de crecimiento endotelial vascular (VEGF). El VEGFR-1 está estrechamente relacionado con los receptores del factor de crecimiento obtenidos de la tirosina cinasa-Fms/kit/trombocito de tipo III, pero se clasifican, con el VEGFR-2 y el VEGFR-3, en una clase distinta de receptores extracelulares cuya región se compone de siete dominios de tipo inmunoglobulina (Ig). El dominio de tipo Ig II comprende la región que participa en el enlace con el VEGF y del factor de crecimiento placentario (PIGF), mientras que los dominios de tipo Ig III y IV intervienen en el enlace con la heparina, y el dominio III es asimismo responsable de la interacción con la neuropilina-1.
El VEGFR-1 se expresa principalmente en las células endoteliales y musculares lisas, pero también en otros tipos celulares de génesis hematopoyética y de las células del músculo esquelético. No se conoce bien la transducción de señales en la célula procedente del VEGFR-1, como resultado de la interacción con el factor de crecimiento.
Los estudios con genes desactivados demostraron que el VEGFR-1 resulta esencial para el desarrollo y la diferenciación de la vasculatura embrionaria, y que sus resultados de inactivación en la participación en el aumento hemangioblástico y la desorganización de los vasos sanguíneos. Sin embargo, los ratones con una deleción homocigótica del dominio cinasa intracelular presentan un desarrollo correcto de los vasos sanguíneos, lo que indica que la región extracelular del VEGFR-1 resulta suficiente para soportar la angiogénesis embrionaria.
La actividad con respecto a la tirosina cinasa del VEGFR-1 resulta esencial para la señalización quimiotáctica provocada por el VEGF y el PIGF en monocitos y macrófagos y las células germinales hematopoyéticas.
Los estudios sobre el PIGF, un ligando específico del VEGFR-1, han demostrado que dicho receptor se interviene en la angiogénesis patológica en adultos.
Más recientemente se ha demostrado que los factores de crecimiento que se enlazan con el VEGFR-1 pueden provocar la transfosforilación del VEGFR-2 y que la estimulación de la angiogénesis se puede obtener mediante la formación de complejos heterodiméricos VEGFR-1/VEGFR-2.
Además de la isoforma transmembrana del VEGFR-1, las células endoteliales (EC) producen una forma soluble del receptor, procedente del corte y empalme alternativo del mismo gen. El VEGFR-1 soluble (sVEGFR-1) comprende los primeros seis dominios de tipo Ig de la región extracelular del receptor y una cola específica de 30 aminoácidos en su extremo carboxiterminal. Ambas isoformas del VEGF se enlazan con gran afinidad y el sVEGFR-1 actúa como un potente antagonista de la señalización del VEGF secuestrando el factor de crecimiento y, por lo tanto, inhibiendo su interacción con los receptores transmembrana.
Los presentes inventores demostraron anteriormente que el sVEGFR-1 secretado por las EC en cultivo pasa a formar parte de la matriz extracelular y puede intervenir en la adherencia de las EC mediante el enlace directo con la integrina α5β1. (Orecchia A. et al., 2003).
Se ha destacado anteriormente un papel clave de dicha integrina en la estimulación de la vasculogénesis y la angiogénesis mediante el fenotipo vascular defectuoso de ratones con genes inactivados α5 y por la capacidad de cualquiera de tanto los anticuerpos contra dicha integrina como de péptidos antagonistas para bloquear in vitro e in vivo la angiogénesis.
El enlace de la integrina con sus ligandos se realiza habitualmente mediante el reconocimiento de secuencias cortas de aminoácidos. Muchas integrinas, entre ellas la α5β1, se enlazan con péptidos que contienen arginina - glicina - ácido aspártico (RGD), aunque se han identificado otros motivos.
Basándose en lo que se conoce en el estado de la técnica y suponiendo que la secuencia del sVEGFR-1 no contiene el motivo RGD, los inventores de la presente invención se centraron en la identificación de los determinantes moleculares responsables de su interacción con la integrina α5β1.
Los experimentos, que se describen detalladamente a continuación, dieron a conocer por primera vez que un anticuerpo contra un péptido cartografiado en el dominio de la Ig de tipo II impide el enlace del VEGF-1 con la integrina α5β1. Por lo tanto, los esfuerzos experimentales se centraron en dicho dominio II que soporta tanto la adherencia de las EC como el enlace directo con la integrina α5β1.
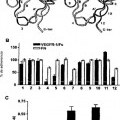
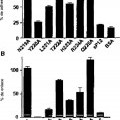
Posteriormente, basándose en la información disponible en las estructuras determinadas experimentalmente de dicho dominio II, se desarrollaron doce péptidos que imitaban supuestamente toda la superficie del dominio, que se probaron posteriormente con respecto a la interacción con la integrina. De dichos doce péptidos, uno pudo soportar la adherencia de las EC así como competir con la adherencia entre el sVEGFR-1 y las EC y la migración de las EC hacia la sVEGFR-1.
Además, el péptido presentó actividad proangiogénica in vitro. La sustitución de alanina explorando la mutagenia del péptido ha permitido, finalmente, identificar los aminoácidos del péptido responsables de su actividad biológica, que representan un motivo de enlace de la integrina α5β1.
Por lo tanto, un objetivo de la presente invención es un péptido que consiste en la secuencia de aminoácidos NYLTHRQ con el mismo efecto proangiogénico, así como el péptido que consiste en la secuencia YLXHR en el que X puede ser cualquier aminoácido según la reivindicación 1, pero preferentemente es Thr/T.
Otro objetivo de la presente invención es la utilización de dichos péptidos en la preparación de un compuesto farmacéutico apto para el tratamiento de estados clínicas que requieran la inducción de la angiogénesis, tales como: la hipertensión arterial periférica, las patologías vasculares dependientes de la diabetes, las heridas, la isquemia del músculo, el cerebro, el riñón, el intestino, el corazón o las extremidades, las patologías vasculares oclusivas u obstructivas graves, las enfermedades vasculares periféricas, la isquemia pericárdica, el infarto o cualquier patología vascular.
Otro objetivo de la presente invención es la utilización de los péptidos de la presente invención para dirigir moléculas o partículas, asimismo partículas víricas, hacia la integrina α5β1 in vitro.
Otras características de la presente invención se pondrán más claramente de manifiesto a partir de la siguiente descripción detallada, provista de los experimentos, haciendo referencia a las figuras adjuntas en las que:
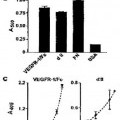
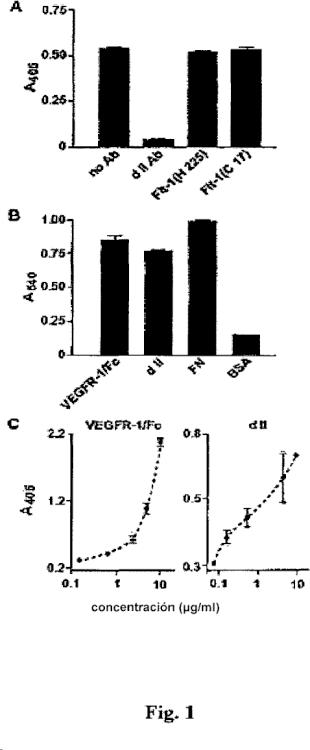
La figura 1A representa los resultados de una prueba de ensayo de enlace en fase sólida de la integrina α5β1 con el sVEGFR-1 en presencia/ausencia de anticuerpos dirigidos contra regiones específicas de la proteína sVEGFR-1; la cantidad de proteínas se determinó mediante ensayo colorimétrico (absorbancia a 405 nm).
La figura 1B representa los resultados de una prueba de adherencia de las células endoteliales (EC) incubadas en placas cubiertas con la proteína de fusión VEGFR-1 con el dominio de FC de las inmunoglobulinas humanas (VEGFR-1 Fe), con el dominio de la Ig de tipo II recombinante (d II), con la fibronectina (FN) o la seroalbúmina bovina (BSA), seguido por un ensayo colorimétrico (absorbancia a 540 nm).
La figura 1C representa los resultados de una prueba de adherencia en fase sólida de la integrina α5β1 en placas cubiertas con el dominio de la Ig de tipo II recombinante o con el VEGFR-1 Fe, seguido por... [Seguir leyendo]
Reivindicaciones:
1. Péptido que consiste en la secuencia de aminoácidos YLXHR que presenta efecto proangiogénico caracterizado porque X se selecciona de entre el grupo que consiste en: Ala/A, Arg/R, Asn/N, Asp/D, Cys/C, Glu/E, Gln/Q, Gly/G, Ile/I, Leu/L, Lys/K, Met/M, Phe/F, Pro/P, Ser/S, Thr/T, Trp/W, Tyr/Y y Val/V.
2. Péptido que consiste en la secuencia de aminoácidos YLXHR que presenta efecto proangiogénico según la reivindicación 1 caracterizado porque X es Thr/T.
3. Péptido que consiste en la secuencia de aminoácidos NYLTHRQ que presenta efecto proangiogénico.
4. Utilización del péptido según cualquiera de las reivindicaciones 1 a 3 en la preparación de una composición farmacéutica.
5. Utilización del péptido según cualquiera de las reivindicaciones 1 a 3 en la preparación de una composición farmacéutica que se pueda emplear para el tratamiento de procesos clínicos que requieran la provocación de angiogénesis.
6. Utilización según la reivindicación 5 caracterizada porque el proceso clínico que requiere angiogénesis se selecciona de entre el grupo que consiste en: hipertensión, patologías vasculares periféricas que dependen de la diabetes, heridas, isquemia del músculo, isquemia cerebral, isquemia renal, isquemia intestinal, isquemia cardíaca o isquemia de las extremidades, patologías vasculares oclusivas u obstructivas graves, patologías vasculares periféricas, isquemia pericárdica, infarto de miocardio, enfermedades de las arterias coronarias, patologías vasculares cerebrales, patologías vasculares viscerales.
7. Utilización del péptido según cualquiera de las reivindicaciones 1 a 3 para dirigir moléculas o partículas, también víricas, hacia la integrina α5β1 in vitro.
Patentes similares o relacionadas:
Anticuerpo biespecífico o mezcla de anticuerpos con cadenas ligeras comunes, del 15 de Julio de 2020, de Jiangsu Alphamab Biopharmaceuticals Co., Ltd: Anticuerpo biespecífico o parte de unión a antígeno del mismo, en el que el anticuerpo biespecífico o la parte de unión a antígeno del mismo tiene una cadena […]
Detección de interacciones proteína a proteína, del 15 de Julio de 2020, de THE GOVERNING COUNCIL OF THE UNIVERSITY OF TORONTO: Un método para medir cuantitativamente la fuerza y la afinidad de una interacción entre una primera proteína de membrana o parte de la misma y una […]
Un polipéptido de receptor de factor de crecimiento de fibroblastos 3 (FGR3) soluble para su uso en la prevención o tratamiento de trastornos de retraso del crecimiento esquelético, del 15 de Abril de 2020, de INSTITUT NATIONAL DE LA SANTE ET DE LA RECHERCHE MEDICALE (INSERM): Un polipéptido de receptor del factor de crecimiento de fibroblastos 3 soluble (sFGFR3) aislado para su uso en la prevención o tratamiento de una enfermedad […]
Variantes derivadas de ActRIIB y usos de los mismos, del 8 de Abril de 2020, de ACCELERON PHARMA, INC: Una proteína ActRIIB variante para su uso en el tratamiento de la caquexia, en donde la proteína ActRIIB variante comprende una secuencia de aminoácidos que es al menos 90% […]
Endodermo que expresa pdx1, del 8 de Abril de 2020, de VIACYTE, INC: Un método para producir una población celular que comprende células humanas de endodermo positivas para PDX1, dicho método comprende los pasos de: cultivar […]
Uso combinado de trampas de GDF y activadores del receptor de la eritropoyetina para aumentar los niveles de glóbulos rojos, del 11 de Marzo de 2020, de ACCELERON PHARMA, INC: Un polipéptido para su uso para tratar o prevenir la anemia o aumentar los niveles de glóbulos rojos en un paciente, donde dicho aumento, tratamiento o prevención comprende […]
Composiciones y métodos para tratar la hipertensión pulmonar, del 8 de Enero de 2020, de THE BRIGHAM AND WOMEN'S HOSPITAL, INC.: Una trampa del ligando de TGF-β que comprende un dominio de unión al ligando de TGF-β de un receptor tipo II de TGF-β y un dominio Fc de una inmunoglobulina […]
Receptores de antígenos quiméricos (CARS) con mutaciones en la región del espaciador Fc y métodos para su uso, del 23 de Octubre de 2019, de CITY OF HOPE: Un receptor de antígeno quimérico (CAR) recombinante que tiene una unión deteriorada a un receptor Fc (FcR), que comprende: un dominio de reconocimiento de antígeno; […]