Nuevos métodos y composiciones para suministro por vía transmucosa potenciado de péptidos y proteínas.
Una composición farmacéutica para administración por vía transmucosa de una exendina o análogo de exendina,
que comprende una exendina o análogo de exendina bioactivo que no tiene más de 5 sustituciones, deleciones y/oadiciones de aminoácidos, un poliaminoácido catiónico, y un tampón, siendo el pH de la composición entre pH 4,0 ypH 6,0; donde al pH de la composición el tampón no provoca precipitación del poliaminoácido catiónico y tiene unacarga neta mono-aniónica o neutra; y donde la absorción por vía transmucosa de la exendina o análogo de exendinaaumenta en relación con la absorción de la exendina o análogo de exendina en ausencia del poliaminoácido.
Tipo: Patente Internacional (Tratado de Cooperación de Patentes). Resumen de patente/invención. Número de Solicitud: PCT/US2004/017456.
Solicitante: Amylin Pharmaceuticals, LLC.
Nacionalidad solicitante: Estados Unidos de América.
Dirección: 9360 TOWNE CENTRE DRIVE SAN DIEGO, CA 92121 ESTADOS UNIDOS DE AMERICA.
Inventor/es: STETSKO, GREGG, ONG,John T.H, JENNINGS,ROBERT.
Fecha de Publicación: .
Clasificación Internacional de Patentes:
- A61K38/00 NECESIDADES CORRIENTES DE LA VIDA. › A61 CIENCIAS MEDICAS O VETERINARIAS; HIGIENE. › A61K PREPARACIONES DE USO MEDICO, DENTAL O PARA EL ASEO (dispositivos o métodos especialmente concebidos para conferir a los productos farmacéuticos una forma física o de administración particular A61J 3/00; aspectos químicos o utilización de substancias químicas para, la desodorización del aire, la desinfección o la esterilización, vendas, apósitos, almohadillas absorbentes o de los artículos para su realización A61L; composiciones a base de jabón C11D). › Preparaciones medicinales que contienen péptidos (péptidos que contienen ciclos beta-lactama A61K 31/00; dipéptidos cíclicos que no tienen en su molécula ningún otro enlace peptídico más que los que forman su ciclo, p. ej. piperazina 2,5-dionas, A61K 31/00; péptidos basados en la ergolina A61K 31/48; que contienen compuestos macromoleculares que tienen unidades aminoácido repartidas estadísticamente A61K 31/74; preparaciones medicinales que contienen antígenos o anticuerpos A61K 39/00; preparaciones medicinales caracterizadas por los ingredientes no activos, p. ej. péptidos como soportes de fármacos, A61K 47/00).
- A61K38/17 A61K […] › A61K 38/00 Preparaciones medicinales que contienen péptidos (péptidos que contienen ciclos beta-lactama A61K 31/00; dipéptidos cíclicos que no tienen en su molécula ningún otro enlace peptídico más que los que forman su ciclo, p. ej. piperazina 2,5-dionas, A61K 31/00; péptidos basados en la ergolina A61K 31/48; que contienen compuestos macromoleculares que tienen unidades aminoácido repartidas estadísticamente A61K 31/74; preparaciones medicinales que contienen antígenos o anticuerpos A61K 39/00; preparaciones medicinales caracterizadas por los ingredientes no activos, p. ej. péptidos como soportes de fármacos, A61K 47/00). › que provienen de animales; que provienen de humanos.
- A61K38/22 A61K 38/00 […] › Hormonas (derivados de pro-opiomelanocortina, pro-encefalina o pro-dinorfina A61K 38/33, p. ej. corticotropina A61K 38/35).
- A61K38/26 A61K 38/00 […] › Glucagón.
- A61K47/12 A61K […] › A61K 47/00 Preparaciones medicinales caracterizadas por los ingredientes no activos utilizados, p. ej. portadores o aditivos inertes; Agentes de direccionamiento o agentes modificadores enlazados químicamente al ingrediente activo. › Acidos carboxílicos; Sus sales o anhídridos.
- A61K47/18 A61K 47/00 […] › Aminas; Amidas; Ureas; Compuestos de amonio cuaternario; Aminoácidos; Oligopéptidos que tienen hasta cinco aminoácidos.
- A61K47/34 A61K 47/00 […] › Compuestos macromoleculares obtenidos por reacciones distintas a aquellas en las que intervienen solamente enlaces insaturados carbono-carbono, p. ej. poliésteres, poly(amino ácidos), polisiloxanos, polifosfacinas, copolímeros de polialquilenglicol o poloxámeros (A61K 47/10 tiene prioridad).
- A61K9/00 A61K […] › Preparaciones medicinales caracterizadas por un aspecto particular.
PDF original: ES-2425221_T3.pdf
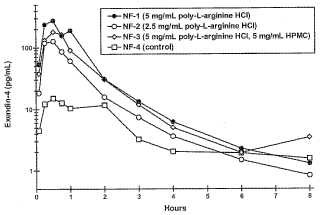
Fragmento de la descripción:
Nuevos métodos y composiciones para suministro por vía transmucosa potenciado de péptidos y proteínas
Campo de la invención La presente invención se refiere en general al campo del suministro de fármacos. Más particularmente, la presente invención se refiere a nuevos métodos y composiciones para el suministro por vía transmucosa potenciado de péptidos y proteínas bioactivos.
Antecedentes La administración de péptidos y proteínas terapéuticamente activos se ha limitado en general a inyección debido a las dificultades para conseguir la biodisponibilidad requerida mediante vías alternativas, menos invasivas, tales como oral, transmucosa o transdérmica. Por ejemplo, la administración por ingestión puede dar como resultado degradación química y enzimática en el tracto gastrointestinal, dando como resultado una pérdida sustancial de actividad y baja biodisponibilidad. El suministro por vía transmucosa a través de membranas mucosas absorbentes tales como membranas oral, bucal, sublingual, ocular, nasal, pulmonar, rectal y vaginal, por otro lado, tiene la ventaja de ser no invasivo y de evitar la eliminación hepato/gastrointestinal (al menos inicialmente) . Los péptidos y proteínas, sin embargo, generalmente no se absorben bien a través de las mucosas debido a su tamaño molecular y su hidrofilia. En general, los inhibidores de enzima y potenciadores de la absorción necesitan coadministrarse para suministro por vía transmucosa exitoso de péptidos y proteínas bioactivos.
Las clases de potenciadores de la absorción usados para suministro por vía transmucosa incluyen sales biliares y sus derivados, taurodihidrofusidados, ácidos mono y policarboxílicos, ciclodextrinas, tensioactivos (especialmente no iónicos) , agentes quelantes, polímeros catiónicos, lípidos y fosfolípidos (véase Davis y Illum, Clin Pharmacokinet., 42:1107-1128, 2003 para una revisión) . Cada uno de estos agentes ejerce sus efectos potenciadores por un mecanismo diferente, y muchos se han asociado con diversos grados de efectos adversos. No obstante, se ha demostrado que estos potenciadores potencian la absorción y, en consecuencia, biodisponibilidad de péptidos y proteínas a través de la membrana mucosa.
La cavidad nasal proporciona una vía atractiva para suministro de péptidos y proteínas, debido a su permeabilidad relativamente alta y facilidad de administración. Se ha mostrado que las composiciones de pulverización nasal que contienen un agente quelante tal como etilendiaminotetraacetato disódico, o sal biliar, potencian la absorción de nona y decapéptidos que tienen actividad agonista o antagonista de LHRH (patente de Estados Unidos Nº 4.476.116 y 5.116.817) . Se ha usado una combinación de sal biliar y dimetil-1-ciclodextrina para potenciar la absorción nasal de hormonas paratiroideas (patente de Estados Unidos Nº 5.977.070) . También se han usado lisofosfolípidos, acilcarnitinas y polioxietilen (20) sorbitán monooleato (Tween® 80) como potenciadores para el suministro de insulina y calcitonina a través de membranas mucosas (patentes de Estado Unidos Nº 5.804.212 y 6.440.392) . Se ha demostrado que el polisacárido catiónico quitosano, usado como polvo, nanopartícula o en solución, potencia la absorción por vía mucosa de insulina, otros péptidos y proteínas, y vacunas (patente de Estados Unidos Nº 6.391.318; Dyer et al., Pharm. Res., 19:998-1008, 2002; Illum et al., Pharm. Res., 11:1186-1189, 1994; Fernandez-Urrusuno et al., Pharm. Res., 16:1576-1581, 1999) . Adicionalmente, se han usado agentes bioadhesivos, tales como carbómeros y policarbofilo, para aumentar el tiempo de residencia y por lo tanto la biodisponibilidad de insulina de una forma de dosificación en polvo (Callen y Remon, Controlled Rel..., 66:215-220, 2000) .
El poliaminoácido catiónico, polilisina, se mencionó en una formulación de aerosol para suministro pulmonar y nasal, pero no se ha proporcionado explicación para su función (patente de Estados Unidos Nº 6.294.153) . Se ha indicado que otro poliaminoácido catiónico, poli-L-arginina potencia la absorción de dextrano marcado con isotiocianato de fluoresceína (Nasume et al., Intl. J. Pharm., 185:1-12, 1999) , pero no se investigaron péptidos o proteínas bioactivas. Otras aplicaciones para usos potenciales de poliaminoácidos catiónicos para mejorar el suministro por vía transmucosa de moléculas pueden encontrarse en las patentes de Estados Unidos Nº 5.554.388 y 5.788.959; Solicitudes de Patente Japonesas 1998095738A, 2000281589A; McEwan et al., Biochim. Biophys. Acta, 1148:51-60, 1993; Uchida et al., Exp. Lung, Res., 22:85-99, 1996; Natsume et al., Drug Deliv. Systems, 14:21-25, 1999; Miyamoto et al, Intl. J. Pharma., 226:127-138, 2001; Miyamoto et al., Eur. J. Pharma Biopharma., 52:21-30, 2001; Ohtake et al., J. Controlled Res., 82:263-275, 2002 y Ohtake et al., Pharm. Res., 20:1838-1845, 2003. Muchos de estos artículos describen el uso de poliaminoácidos catiónicos para suministrar moléculas marcadoras tales como dextrano marcado en lugar de proteínas o péptidos. Por lo tanto, sigue existiendo la necesidad de potenciadores de la absorción mejorados para uso en el suministro por vía transmucosa de péptidos y proteínas bioactivos.
Sumario Entre los varios aspectos de la invención se proporciona una composición farmacéutica para administración por vía transmucosa de una exendina o análogo de exendina, que comprende una exendina o análogo de exendina bioactivo que no tiene más de 5 sustituciones, deleciones y/o adiciones de aminoácidos, un poliaminoácido catiónico, y un tampón, siendo el pH de la composición entre pH 4, 0 y pH 6, 0; donde al pH de la composición el tampón no provoca precipitación del poliaminoácido catiónico y tiene carga neta mono-aniónico o neutra; y donde la absorción transmucosa de la exendina o análogo de exendina aumenta en relación con la absorción de la exendina
En otras realizaciones, la composición comprende además un agente tonificante, un agente de aumento de la viscosidad, un agente bioadhesivo, un conservante o cualquier combinación de un agente tonificante, un agente de aumento de la viscosidad, un agente bioadhesivo y un conservante. En una realización el agente tonificante usado se selecciona de cloruro sódico, manitol, sacarosa, glucosa y cualquier combinación de cloruro sódico, manitol, sacarosa y glucosa. En otra realización, en la que se usa un agente de aumento de la viscosidad, el agente puede seleccionarse de hidroxipropilcelulosa, hidroxipropil metilcelulosa, metilcelulosa con un peso molecular medio entre aproximadamente 10 y aproximadamente 1.500 kDa, almidón, gomas y cualquier combinación de los agentes de aumento de la viscosidad enumerados. En otra realización, en la que se usa un agente bioadhesivo, el agente bioadhesivo puede seleccionarse de carbómero, policarbofilo y cualquier combinación de carbómero y policarbofilo. En realizaciones que utilizan un conservante, el conservante puede seleccionarse de alcohol feniletílico, metilparabeno, etilparabeno, propilparabeno, butilparabeno, clorobutanol, ácido benzoico, ácido sórbico, fenol, mcresol, alcohol, y cualquier combinación de los conservantes enumerados en el presente documento.
La proteína o péptido bioactivo o es una exendina o análogo de exendina. En diversas realizaciones los péptidos... [Seguir leyendo]
Reivindicaciones:
1. Una composición farmacéutica para administración por vía transmucosa de una exendina o análogo de exendina, que comprende una exendina o análogo de exendina bioactivo que no tiene más de 5 sustituciones, deleciones y/o adiciones de aminoácidos, un poliaminoácido catiónico, y un tampón, siendo el pH de la composición entre pH 4, 0 y pH 6, 0; donde al pH de la composición el tampón no provoca precipitación del poliaminoácido catiónico y tiene una carga neta mono-aniónica o neutra; y donde la absorción por vía transmucosa de la exendina o análogo de exendina aumenta en relación con la absorción de la exendina o análogo de exendina en ausencia del poliaminoácido.
2. La composición de la reivindicación 1, donde el pH de la composición está entre pH 4, 0 y pH 5, 0.
3. La composición de la reivindicación 2, donde dicha composición comprende entre 0, 10% y 5, 0% (p/v) de la exendina o análogo de exendina; entre 0, 01% y 1, 0% (p/v) del poliaminoácido catiónico; y entre 0, 01% y 10, 0% (p/v) del tampón.
4. La composición de una cualquiera de las reivindicaciones precedentes, donde el tampón se selecciona del grupo que consiste en ácido acético, ácido 5-aminocaproico o ácido glutámico.
5. La composición de la reivindicación 4, donde el tampón comprende ácido glutámico.
6. La composición de una cualquiera de las reivindicaciones precedentes, que comprende además un agente tonificante, un agente que aumenta la viscosidad, un agente bioadhesivo, un conservante, o cualquier combinación de los mismos.
7. La composición de una cualquiera de las reivindicaciones precedentes, donde el poliaminoácido catiónico comprende poli-histidina, poli-arginina, poli-lisina o cualquier combinación de los mismos.
8. La composición de la reivindicación 7, donde el poliaminoácido catiónico tiene un peso molecular medio de entre 10 kDa y 200 kDa.
9. La composición de una cualquiera de las reivindicaciones precedentes, donde el poliaminoácido catiónico tiene un peso molecular medio de entre 100 kDa y 200 kDa.
10. La composición de una cualquiera de las reivindicaciones precedentes, donde la exendina o análogo de exendina se selecciona de al menos uno del grupo que consiste en exendina-3, exendina-4, ácido de exendina-4, exendina-4 (1-30) , amida de exendina-4 (1-30) , exendina-4 (1-28) , amida de exendina-4 (1-28) , amida de 14Leu, 25Phe exendina-4 y amida de 14Leu, 25Phe exendina-4 (1-28) .
11. La composición de una cualquiera de las reivindicaciones 1-9, donde la exendina o análogo de exendina comprende exendina-4.
12. La composición de una cualquiera de las reivindicaciones 1-9, donde la exendina o análogo de exendina comprende exendina-3.
13. La composición de una cualquiera de las reivindicaciones 1-9, donde la exendina o análogo de exendina comprende al menos una exendina o análogo de exendina seleccionado del grupo que consiste en SEC ID Nº: 9-39, 187 y 188.
14. La composición de una cualquiera de las reivindicaciones 1-9, donde la exendina o análogo de exendina comprende al menos una exendina o análogo de exendina seleccionado del grupo que consiste en SEC ID Nº: 6-8 .
4. 186.
15. La composición de una cualquiera de las reivindicaciones 1-9, donde la exendina o análogo de exendina comprende una secuencia de aminoácidos de acuerdo con SEC ID Nº 3.
16. La composición de una cualquiera de las reivindicaciones 1-9, donde la exendina o análogo de exendina comprende una secuencia de aminoácidos de acuerdo con SEC ID Nº 4.
17. La composición de una cualquiera de las reivindicaciones 1-9, donde la exendina o análogo de exendina comprende una secuencia de aminoácidos de acuerdo con SEC ID Nº 5.
18. La composición de la reivindicación 6, donde el agente tonificante se selecciona del grupo que consiste en cloruro sódico, manitol, sacarosa, glucosa y cualquier combinación de los mismos.
19. La composición de la reivindicación 6, donde el agente que aumenta la viscosidad se selecciona del grupo que consiste en hidroxipropil celulosa, hidroxipropil metilcelulosa, metilcelulosa de peso molecular medio entre 10 y
1.500 kDa, gomas de almidón y cualquier combinación de los mismos.
20. La composición de la reivindicación 6, donde el agente bioadhesivo se selecciona del grupo que consiste en carbómero, policarbofilo y cualquier combinación de los mismos. 5
21. La composición de la reivindicación 6, donde el conservante se selecciona del grupo que consiste en alcohol feniletílico, metilparabeno, etilparabeno, propilparabeno, butilparabeno, clorobutanol, ácido benzoico, ácido sórbico, fenol, m-cresol, alcohol y cualquier combinación de los mismos.
22. La composición de una cualquiera de las reivindicaciones 1-9, donde la absorción aumenta al menos 2 veces.
23. La composición de una cualquiera de las reivindicaciones 1-9, donde la absorción aumenta al menos 5 veces.
24. La composición de una cualquiera de las reivindicaciones 1-9, donde la absorción aumenta al menos 10 veces. 15
25. Un método para aumentar la biodisponibilidad de una exendina o análogo de exendina bioactivo que no tiene más de 5 sustituciones, deleciones y/o adiciones de aminoácidos después de administración transdérmica que comprende combinar dicha exendina o análogo de exendina, con un poliaminoácido catiónico y un tampón compatible para producir una composición que tiene un pH entre pH 4, 0 y pH 6, 0, donde al pH de la composición,
dicho tampón compatible no provoca precipitación del poliaminoácido catiónico, y tiene una carga neta monoaniónica o neutra; y donde la biodisponibilidad de dicha exendina o análogo de exendina aumenta en relación con la biodisponibilidad de dicha exendina o análogo de exendina en ausencia de dicho poliaminoácido catiónico.
26. El método de la reivindicación 25, donde la exendina o análogo de exendina comprende exendina-4.
Patentes similares o relacionadas:
Preparación externa líquida, del 29 de Julio de 2020, de HISAMITSU PHARMACEUTICAL CO. INC.: Una preparación tópica líquida, que comprende: agua; oxibutinina o una sal farmacéuticamente aceptable de la misma; y un éster de ácido dicarboxílico, […]
Preparación sólida que contiene colorante, del 29 de Julio de 2020, de DAIICHI SANKYO COMPANY, LIMITED: Preparación farmacéutica sólida que comprende monobencenosulfonato de ácido [(1R,5S,6S)-6-(aminometil)-3- etilbiciclo[3.2.0]hept-3-en-6-il]acético […]
Método de tratamiento del cáncer, del 22 de Julio de 2020, de Intensity Therapeutics, Inc: Una composición que comprende una cantidad terapéuticamente efectiva de un agente terapéutico y un agente mejorador de la permeación intracelular para uso en el tratamiento […]
Preparaciones ácidas de insulina con estabilidad mejorada, del 15 de Julio de 2020, de SANOFI-AVENTIS DEUTSCHLAND GMBH: Formulación farmacéutica que contiene insulina humana Gly(A21),Arg(B31),Arg(B32) y un tensioactivo, elegido de un grupo que contiene Tween 20® y Tween 80®; siendo […]
Métodos para el tratamiento de la enfermedad ocular en sujetos humanos, del 10 de Junio de 2020, de Clearside Biomedical, Inc: Una formulación farmacéutica que comprende un fármaco para su uso en un método de tratamiento de un trastorno ocular posterior en un sujeto humano que […]
Preparación liofilizada de dipéptidos citotóxicos, del 3 de Junio de 2020, de ONCOPEPTIDES AB: Una preparación farmacéutica liofilizada que comprende (i) melfalán flufenamida, o una sal farmacéuticamente aceptable de la misma; y (ii) al menos un […]
Método y composiciones para el tratamiento de la psoriasis, del 29 de Abril de 2020, de Anaplasi Pharmaceuticals LLC: Una composición tópica en forma de aerosol, espuma o mousse, para el uso en el tratamiento de la psoriasis, en donde la composición comprende: a) del 30 % en […]
Formulación farmacéutica acuosa de tapentadol para administración por vía oral, del 22 de Abril de 2020, de GRUNENTHAL GMBH: Una composición farmacéutica acuosa que contiene tapentadol o una sal fisiológicamente aceptable del mismo y que está adaptada para administración […]