Motivos de la familia de polipéptidos pancreáticos, polipéptidos y métodos que los comprenden.
Un polipéptido PPF, en el que dicho polipéptido comprende: la secuencia de aminoácidos de SEC ID Nº 438.
Tipo: Patente Internacional (Tratado de Cooperación de Patentes). Resumen de patente/invención. Número de Solicitud: PCT/US2005/045471.
Solicitante: Amylin Pharmaceuticals, LLC.
Nacionalidad solicitante: Estados Unidos de América.
Dirección: 9360 TOWNE CENTRE DRIVE SAN DIEGO, CA 92121 ESTADOS UNIDOS DE AMERICA.
Inventor/es: GHOSH, SOUMITRA, S., PRICKETT, KATHRYN, S., LEVY,ODILE ESTHER, JODKA,CAROLYN M, PARKES,DAVID, PITTNER,RICHARD A, D\'SOUZA,LAWRENCE J, AHN,JOHN S, ROTH,JONATHAN DAVID, ADAMS,SEAN H.
Fecha de Publicación: .
Clasificación Internacional de Patentes:
- A61K38/17 NECESIDADES CORRIENTES DE LA VIDA. › A61 CIENCIAS MEDICAS O VETERINARIAS; HIGIENE. › A61K PREPARACIONES DE USO MEDICO, DENTAL O PARA EL ASEO (dispositivos o métodos especialmente concebidos para conferir a los productos farmacéuticos una forma física o de administración particular A61J 3/00; aspectos químicos o utilización de substancias químicas para, la desodorización del aire, la desinfección o la esterilización, vendas, apósitos, almohadillas absorbentes o de los artículos para su realización A61L; composiciones a base de jabón C11D). › A61K 38/00 Preparaciones medicinales que contienen péptidos (péptidos que contienen ciclos beta-lactama A61K 31/00; dipéptidos cíclicos que no tienen en su molécula ningún otro enlace peptídico más que los que forman su ciclo, p. ej. piperazina 2,5-dionas, A61K 31/00; péptidos basados en la ergolina A61K 31/48; que contienen compuestos macromoleculares que tienen unidades aminoácido repartidas estadísticamente A61K 31/74; preparaciones medicinales que contienen antígenos o anticuerpos A61K 39/00; preparaciones medicinales caracterizadas por los ingredientes no activos, p. ej. péptidos como soportes de fármacos, A61K 47/00). › que provienen de animales; que provienen de humanos.
- C07K14/435 QUIMICA; METALURGIA. › C07 QUIMICA ORGANICA. › C07K PEPTIDOS (péptidos que contienen β -anillos lactamas C07D; ipéptidos cíclicos que no tienen en su molécula ningún otro enlace peptídico más que los que forman su ciclo, p. ej. piperazina diones-2,5, C07D; alcaloides del cornezuelo del centeno de tipo péptido cíclico C07D 519/02; proteínas monocelulares, enzimas C12N; procedimientos de obtención de péptidos por ingeniería genética C12N 15/00). › C07K 14/00 Péptidos con más de 20 aminoácidos; Gastrinas; Somatostatinas; Melanotropinas; Sus derivados. › de animales; de humanos.
PDF original: ES-2550536_T3.pdf




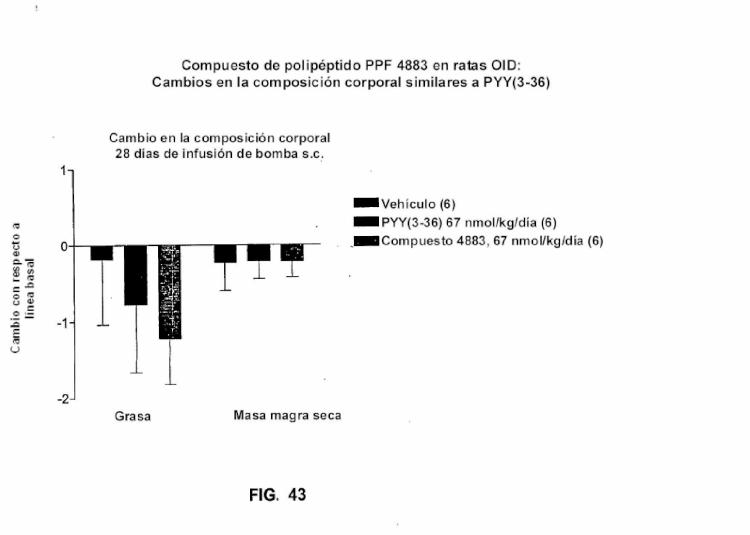
Fragmento de la descripción:
Motivos de la familia de polipéptidos pancreáticos, polipéptidos y métodos que los comprenden Solicitudes relacionadas
La presente solicitud reivindica la prioridad con respecto a la solicitud de EE.UU. N° 11/055.098 en trámite, presentada el 11 de febrero de 2005; PCT/US05/04351; y la solicitud provisional de EE.UU. N° 60/635.897, presentada el 13 de diciembre de 2004.
Listado de secuencias
El listado de secuencias de la presente solicitud se presenta como una copia en papel y en soporte informático (CRF) en un disco compacto con el nombre de archivo "0406PCT2 seq list.txt".
Antecedentes
Una serie de hormonas relacionadas componen la familia de los polipéptidos pancreáticos ("PPF"). El polipéptido pancreático ("PP") fue descubierto como un contaminante de los extractos de insulina, y recibió el nombre por su órgano de origen en lugar de por su importancia funcional (Kimmel et al., Endocrinology 83:1323-1330 (1968)). El PP es un péptido de 36 aminoácidos (SEC ID N° 1) que contiene motivos estructurales distintivos. Más tarde, se descubrió un péptido relacionado en extractos de intestino, y se denominó péptido YY ("PYY") (SEC ID N° 2) debido a las tirosinas N- y C-terminales (Tatemoto, Proc. Nati. Acad. Sci. EE.UU. 79: 2514-8 (1982)). Más tarde, se encontró un tercer péptido relacionado en extractos de cerebro, y se denominó neuropéptido Y ("NPY") (SEC ID N° 4) (Tatemoto, Proc. Nati. Acad. Sci. EE.UU. 79: 5485-9 (1982); Tatemoto etal., Nature 296: 659-60 (1982)).
Se ha publicado que estos tres péptidos relacionados ejercen diversos efectos biológicos. Los efectos del PP incluyen la inhibición de la secreción pancreática y la relajación de la vesícula biliar. Administrado a nivel central, el PP produce aumentos modestos en la alimentación que pueden estar mediados por los receptores ubicados en el hipotálamo y en el tronco cerebral (revisado en Gehlert, Proc. Soc Exp. Biol Med. 218: 7-22 (1998)).
La liberación de PYY(SEC ID N° 2) se produce después de una comida. Una forma molecular alternativa del PYY es PYY(3-36) (SEC ID N° 3) (Eberlein et al, Peptides 10:797-803 (1989); Grandt et al., Regul. Pept. 51:151-9 (1994)). Este fragmento constituye aproximadamente el 40 % de la inmunorreactividad total de tipo PYY en extractos intestinales humanos y caninos, y aproximadamente el 36 % de la inmunorreactividad plasmática total del PYY en ayunas hasta poco más del 50 % después de una comida. Aparentemente, se trata de un producto de escisión de dipeptidil peptidasa-IV (DPP4) de PYY. Se dice que PYY(3-36) es un ligando selectivo en los receptores Y2 e Y5, que aparecen farmacológicamente únicos en análogos de NPY truncados N-terminalmente de preferencia (es decir, fragmentos C-terminales). Se dice que la administración periférica de PYY reduce la secreción de ácido gástrico, la motilidad gástrica, la secreción pancreática de exocrina (Yoshinaga et al, Am. J. Physiol 263: G695-701 (1992); Guan et al., Endocrinology 128: 911-6 (1991); Pappas et al, Gastroenterology 91:1386-9 (1986)), la contracción de la vesícula biliar y la motilidad intestinal (Savage et al, Gut 28: 166-70 (1987)). Los efectos de la inyección central de PYY en el vaciado gástrico, la motilidad gástrica y la secreción de ácido gástrico, como se observa después de la inyección directa en o en torno al cerebro posterior/tallo cerebral (Chen y Rogers, Am. J. Physiol. 269: R787-92 (1995); Chen et al., Regul Pept. 61: 95-98 (1996); Yang y Tache, Am. J. Physiol. 268:G943-8 (1995); Chen et al., Neurogastroenterol Motil. 9: 109-16 (1997)), pueden diferir de los efectos observados después de la inyección periférica. Por ejemplo, el PYY administrado a nivel central tuvo ciertos efectos opuestos a los descritos en el presente documento para el PYY(3-36) inyectado periféricamente en tanto en cuanto la secreción de ácido gástrico se estimuló, en lugar de inhibirse. La motilidad gástrica solo se suprimió en combinación con la estimulación de TRH, pero no cuando se administró solo y, de hecho, fue estimulante a dosis más altas a través de la presunta interacción con los receptores de PP. Se ha observado que el PYY estimula la ingesta de alimento y agua tras la administración central (Morley et al., Brain Res. 341: 200-3 (1985); Corp etal., Am. J Physiol 259: R317-23 (1990)).
Del mismo modo, uno de los efectos centrales del NPY antes en publicarse (SEC ID N° 4) fue el aumento de la ingesta de alimentos, en particular, en el hipotálamo (Stanley etal., Peptides 6:1205-11 (1985)). Se ha publicado que PYY y PP imitan estos efectos, y que PYY es más potente o tan potente como NPY (Morley et al., Brain Res. 341:200-3 (1985); Kanatani et al., Endocrinology 141: 1011-6 (2000); Nakajima et al., J Pharmacol Exp. Ther. 268: 1010-4 (1994)). Varios grupos encontraron la magnitud de la alimentación inducida por NPY superior a la inducida por cualquier agente farmacológico previamente ensayado, así como de una duración sumamente prolongada. Se ha reproducido la estimulación inducida por NPY de la alimentación en una serie de especies. Entre los tres macronutrientes básicos (grasa, proteína e hidratos de carbono), se estimuló preferentemente la ingesta de hidratos de carbono. No se observó tolerancia hacia el efecto orexigénico de NPY, y cuando se repitió la administración del péptido durante 10 días, se observó un aumento notable de la tasa de aumento de peso. Tras la inanición, la concentración de NPY en el PVN hipotalámico aumentó con el tiempo, y volvió rápidamente a los niveles de control después de la ingestión de alimentos.
Los estudios farmacológicos y los esfuerzos de clonación han revelado una serie de siete receptores transmembrana para la familia de péptidos PP, y estos receptores han recibido los nombres de Y1 a Y6 (y un supuesto receptor con preferencia por los PYY Y7). Las respuestas de señalización típicas de estos receptores son similares a las de otros receptores acoplados a G¡/Go, en concreto, la inhibición de la adenilato ciclasa. Incluso con una homología de secuencias bastante baja entre los receptores, es evidente que hay un agrupamiento con similitud en las secuencias de aminoácidos entre los receptores Y1, Y4 e Y6, mientras que Y2 e Y5 definen otras familias. Se han identificado otros sitios de unión por el orden de rango de la potencia de los diversos péptidos. El receptor con preferencia por NPY, que no se ha clonado, se ha denominado Y3, y no hay pruebas de la existencia de receptores con preferencia por los PYY(el/los supuesto/s receptor/es Y7) (revisado en Michel et al., Pharmacol. Rev. 50: 143-50 (1998); Gehlert, Proc. Soc. Exp. Biol Med. 218: 7-22 (1998)).
Los receptores Y5 e Y1 se han sugerido como los mediadores primarios de la respuesta a la ingesta de alimentos (Marsh et al, Nat. Med. 4:718-21 (1998); Kanatani et al., Endocrinology 141:1011-6 (2000)). La idea prevalente ha sido que el NPY endógeno, a través de estos receptores, aumenta el comportamiento alimentario. Las terapias propuestas para la obesidad, invariablemente, se han dirigido hacia el antagonismo de los receptores de NPY, mientras que las terapias para el tratamiento de la anorexia se han dirigido hacia los agonistas de esta familia de ligandos (véanse, por ejemplo, las patentes de EE.UU. N° 5.939.462; 6.013.622; y 4.891.357). En general, se dice que PYY y NPY son equipotentes e igualmente eficaces en todos los ensayos de receptores Y1, Y5 (e Y2) estudiados (Gehlert, Proc. Soc. Exp. Biol. Med. 218: 7-22 (1998)).
Farmacológicamente, el receptor Y2 se distingue de Y1 en que presenta afinidad por los fragmentos C-terminales del neuropéptido Y. El receptor Y2 se diferencia más a menudo por la afinidad del neuropéptido Y( 13-36), aunque el fragmento 3-36 del neuropéptido Y y el péptido YY proporcionó mejores afinidad y selectividad (véase Dumont et al., Soc., for Neurosci. Abstracts 19: 726 (1993)). La transmisión de señales a través de los receptores Y1 e Y2 está relacionada con la inhibición de la adenilato ciclasa. También se ha encontrado que la unión al receptor Y2 reduce los niveles intracelulares de calcio en la sinapsis mediante la inhibición selectiva de los canales de calcio de tipo N. Además, el receptor Y2, al igual que los receptores Y1, presenta el acoplamiento diferencial a los segundos mensajeros (véase la patente de EE.UU. N° 6.355.478). Los receptores Y2 se encuentran en una variedad de regiones del cerebro, incluyendo el hipocampo, la sustancia negra-lateralis, el tálamo, el hipotálamo y el tronco cerebral. Se han clonado los receptores Y2 humano, murino, de mono y de rata (por ejemplo, véase la patente de EE.UU. N° 6.420.352 y la patente de EE.UU. N° 6.355.478)).
La principal característica de los supuestos receptores Y3 es que reconocen a NPY,... [Seguir leyendo]
Reivindicaciones:
1. Un polipéptido PPF, en el que dicho polipéptido comprende: la secuencia de aminoácidos de SEC ID N° 438.
2. Un polipéptido PPF de acuerdo con la reivindicación 1, en el que dicho polipéptido PPF comprende además una protección N-terminal.
3. Un polipéptido PPF de acuerdo con la reivindicación 1 o 2, en el que dicho polipéptido está ligado a uno o más polímeros hidrosolubles.
4. El polipéptido PPF de la reivindicación 3, en el que dicho polímero se selecciona del grupo que consiste en polietilenglicol y una molécula de ácido graso, en el que dicho polímero está ligado al extremo N o C del polipéptido, o la cadena lateral de un resto de aminoácido de lisina o serina de la secuencia del polipéptido.
5. Un polipéptido PPF de una cualquiera de las reivindicaciones 1-4, para su uso en la modificación de la composición corporal de un sujeto, en el que el polipéptido PPF modifica la proporción de la grasa con respecto a la masa magra, mediante lo que se modifica la composición corporal.
6. El polipéptido PPF para el uso de acuerdo con la reivindicación 5, en el que la grasa corporal se reduce y la masa corporal magra se mantiene o se aumenta.
7. El polipéptido PPF para el uso de acuerdo con la reivindicación 6, en el que la grasa corporal y la masa corporal magra se miden como el porcentaje de grasa corporal y el porcentaje de masa corporal magra, respectivamente.
8. El polipéptido PPF para el uso de acuerdo con una cualquiera de las reivindicaciones 5-7, en el que la composición corporal se mide mediante un método seleccionado del grupo que consiste en peso bajo el agua, pletlsmografía por desplazamiento de aire, radiografía, MRI, exploración DEXA, exploraciones porTC y calorimétrica de bomba adiabática.
9. El polipéptido PPF para el uso de acuerdo con una cualquiera de las reivindicaciones 5-8, en el que el peso corporal se reduce.
10. El polipéptido PPF para el uso de acuerdo con una cualquiera de las reivindicaciones 5-9, en el que el polipéptido PPF se administra a nivel periférico.
11. El polipéptido PPF para el uso de acuerdo con una cualquiera de las reivindicaciones 5-10, que comprende además la administración al sujeto de al menos un agente seleccionado del grupo que consiste en una amilina, un agonista de la amilina o un análogo agonista de la amilina, calcitonina de salmón, una colecistocinina (CCK) o agonista de CCK, una leptina (proteína OB) o agonista de leptina, una exendina o análogo agonista de la exendina, un GLP-1, agonista de GLP-1 o análogo agonista de GLP-1, una CCK o agonista de CCK, calcitonina, un agonista de la calcitonina, un antagonista del receptor CB1 de cannabinoides de molécula pequeña, rimonabant, un inhibidor de 11-p-hidroxiesteroide deshidrogenasa 1, sibutramina y fentermina.
12. El polipéptido PPF para el uso de acuerdo con una cualquiera de las reivindicaciones 5-11, en el que el sujeto tiene sobrepeso o es obeso.
13. El polipéptido PPF para el uso de acuerdo con una cualquiera de las reivindicaciones 5-12, que comprende además hacer dieta.
14. El polipéptido PPF para el uso de acuerdo con una cualquiera de las reivindicaciones 5-13, en el que el sujeto es un mamífero.
15. El polipéptido PPF para el uso de acuerdo con la reivindicación 14 en el que el mamífero es un ser humano.
16. El polipéptido PPF para el uso de acuerdo con la reivindicación 14 en el que el mamífero se selecciona del grupo que consiste en un primate, una rata, un ratón, un gato, un perro, un cerdo, una vaca, un buey, un caballo, una oveja y una cabra.
17. Un polipéptido PPF de acuerdo con una cualquiera de las reivindicaciones 1-4 para su uso preferentemente en la reducción de los niveles de triglicéridos en plasma en un sujeto, que comprende administrar al sujeto una cantidad del polipéptido PPF eficaz para reducir los niveles de triglicéridos en plasma, en el que los niveles de colesterol se reducen en menor grado.
18. El polipéptido PPF para el uso de acuerdo con la reivindicación 17, en el que los niveles de triglicéridos se reducen y los niveles de colesterol no se reducen.
19. El polipéptido PPF para el uso de acuerdo con la reivindicación 17, en el que los niveles de triglicéridos se reducen y los niveles de colesterol LDL no se reducen.
20. El polipéptido PPF para el uso de acuerdo con la reivindicación 17, en el que los niveles de triglicéridos se 5 reducen y los niveles de colesterol LDL se reducen en menor grado.
21. El polipéptido PPF para el uso de acuerdo con la reivindicación 17, en el que también se reducen los niveles de amilasa.
10 22. Un polipéptido PPF de acuerdo con una cualquiera de las reivindicaciones 1-4 para su uso en la reducción de la
grasa corporal o del aumento de la grasa corporal en un sujeto a la vez que se mantiene o se aumenta la masa corporal magra, que comprende administrar al sujeto una cantidad de un polipéptido PPF eficaz para reducir la grasa corporal o el aumento de grasa corporal a la vez que se mantiene o se aumenta la masa corporal magra.
15 23. Un polipéptido PPF de acuerdo con una cualquiera de las reivindicaciones 1-4 para su uso en la reducción de la
grasa corporal central en un sujeto mediante la administración al sujeto de una cantidad del polipéptido PPF eficaz para readucir la grasa corporal central y preservar o aumentar la masa corporal magra.
24. Un polipéptido PPF de acuerdo con una cualquiera de las reivindicaciones 1-4 para su uso en el aumento de la 20 (5-oxidación de ácidos grasos a la vez que se preserva o se aumenta la masa corporal magra en un sujeto mediante
la administración al sujeto de una cantidad del polipéptido PPF eficaz para aumentar la (3-oxidación de ácidos grasos a la vez que se preserva o se aumenta la masa corporal magra.
25. Un polipéptido PPF de acuerdo con una cualquiera de las reivindicaciones 1-4 para su uso en el tratamiento de 25 la esteatohepatitis no alcohólica o la lipodistrofia en un sujeto que comprende administrar al sujeto una cantidad del
polipéptido PPF eficaz para tratar la esteatohepatitis no alcohólica o la lipodistrofia.
Patentes similares o relacionadas:
Método para producir inmunoconjugados de anticuerpo-SN-38 con un enlazador CL2A, del 22 de Julio de 2020, de IMMUNOMEDICS, INC.: Un método para producir un compuesto, CL2A-SN-38, que presenta la estructura, **(Ver fórmula)** que comprende realizar un esquema de reacción como el que se muestra: **(Ver […]
Composición para el tratamiento de enfermedades isquémicas o trastornos inflamatorios neurogénicos, que contienen el secretoma de células progenitoras neurales como ingrediente activo, del 22 de Julio de 2020, de S-BIOMEDICS: Una composición para uso en el tratamiento de enfermedad cerebrovascular isquémica, cardiopatía isquémica, infarto de miocardio, enfermedad de Alzheimer, enfermedad […]
Biomarcador de enfermedad autoinmunitaria, del 15 de Julio de 2020, de Tzartos, Socrates: Un método de diagnóstico o pronóstico de una enfermedad autoinmunitaria asociada con la formación de lesiones desmielinizadas del sistema nervioso central (SNC) […]
Compuestos de TAFA4 y usos de los mismos para tratar el dolor, del 1 de Julio de 2020, de CENTRE NATIONAL DE LA RECHERCHE SCIENTIFIQUE (C.N.R.S.): Una proteína TAFA4 aislada o un agonista de la misma, para uso como ingrediente activo para prevenir o tratar el dolor en un sujeto, en donde […]
Nueva inmunoterapia contra diversos tumores como el cáncer gastrointestinal y gástrico, del 24 de Junio de 2020, de IMMATICS BIOTECHNOLOGIES GMBH: Péptido seleccionado del grupo siguiente: a) péptido consistente en la secuencia conforme a la SEQ ID N.º 86, b) el péptido conforme a a), en la […]
Usos de composiciones de caseína, del 17 de Junio de 2020, de FONTERRA CO-OPERATIVE GROUP LIMITED: Uso de una composicion de caseina para aumentar la concentracion de leucina libre en suero sanguineo en un sujeto, en donde la composicion de caseina comprende o la caseina […]
Inmunoterapia WT1 para enfermedad angiogénica intraocular, del 17 de Junio de 2020, de INTERNATIONAL INSTITUTE OF CANCER IMMUNOLOGY, INC.: Una composición farmacéutica que comprende un péptido WT1 o péptido WT1 variante para su uso en el tratamiento y/o prevención de una enfermedad […]
Péptidos inhibidores derivados del transcrito de tipo TREM-1 (TLT-1) y sus usos, del 10 de Junio de 2020, de INSERM (INSTITUT NATIONAL DE LA SANTE ET DE LA RECHERCHE MEDICALE): Un polipéptido de 6 a 16 aminoácidos que comprende al menos 6 aminoácidos consecutivos de la secuencia de aminoácidos sec. con núm. de ident.: 4 para su uso en el tratamiento […]