Modificaciones de CST-II para una expresión de poroteína aumentada.
Una proteína sialiltransferasa con etiqueta que comprende un polipéptido sialiltransferasa con al menos el 95% de identidad a SEQ ID NO:
4 y una etiqueta MGS en el extremo amino de SEQ ID NO:4, en donde la proteína sialiltransferasa con etiqueta tiene actividad sialiltransferasa y la etiqueta MGS es el tripéptido Met-Gly-Ser.
Tipo: Patente Internacional (Tratado de Cooperación de Patentes). Resumen de patente/invención. Número de Solicitud: PCT/US2007/002878.
Solicitante: BIOGENERIX AG.
Nacionalidad solicitante: Alemania.
Dirección: Janderstrasse 3 68199 Mannheim ALEMANIA.
Inventor/es: JOHNSON,Karl,F, MOBASSERI,Aliakbar, BAI,Xiaomei, KINEALY,Kyle.
Fecha de Publicación: .
Clasificación Internacional de Patentes:
- C12P21/02 QUIMICA; METALURGIA. › C12 BIOQUIMICA; CERVEZA; BEBIDAS ALCOHOLICAS; VINO; VINAGRE; MICROBIOLOGIA; ENZIMOLOGIA; TECNICAS DE MUTACION O DE GENETICA. › C12P PROCESOS DE FERMENTACION O PROCESOS QUE UTILIZAN ENZIMAS PARA LA SINTESIS DE UN COMPUESTO QUIMICO DADO O DE UNA COMPOSICION DADA, O PARA LA SEPARACION DE ISOMEROS OPTICOS A PARTIR DE UNA MEZCLA RACEMICA. › C12P 21/00 Preparación de péptidos o de proteínas (proteína monocelular C12N 1/00). › que tienen una secuencia conocida de varios aminoácidos, p. ej. glutation.
PDF original: ES-2381504_T3.pdf
Fragmento de la descripción:
Modificaciones de CST-II para una expresión de proteína aumentada
Campo de la invención
La presente invención proporciona proteínas sialiltransferasa de Campylobacter que muestran expresión aumentada comparadas con su forma sin modificar. También se incluyen los ácidos nucleicos que codifican las proteínas sialiltransferasa, como lo son los métodos para producir y usar las proteínas sialiltransferasas.
Antecedentes de la invención
Se reconoce ahora que los hidratos de carbono son de una importancia principal en muchos sucesos de reconocimiento célula-célula, notablemente la adhesión de bacterias y virus a células de mamífero en patogénesis y la interacción leucocito-célula endotelial a través de selectinas en inflamación (Varki (1993) Glycobiology 3: 97-130) . Además, se piensa que los gliconjugados sialilados que se encuentran en bacterias (Preston et al. (1996) Crit. Rev. Microbiol. 22:139-180; Reuter et al. (1996) Biol. Chem. Hoppe-Seyler 377:325-342) imitan a oligosacáridos encontrados en glicolípidos de mamíferos para evadir la respuesta inmune del huésped (Moran et al. (1996) FEMS Immunol. Med. Microbiol. 16:105-115) . Se considera que la imitación molecular de estructuras del huésped por la parte sacárido del lipopolisacárido (LPS) es un factor de virulencia de varios patógenos de las mucosas, que usan esta estrategia para evadir una respuesta inmune del huésped (Moran. et al. (1996) FEMS Immunol. Med. Microbiol.
16: 105-115; Moran et al. (1996) J. Endotoxin Res. 3: 521-531) .
Las estructuras de oligosacáridos implicados en estos y otros procesos son potenciales agentes terapéuticos, pero se necesita mucho tiempo y son caros para hacerlos por medios químicos tradicionales. Una vía muy prometedora para la producción de estructuras de oligosacáridos específicos es mediante el uso de enzimas que los hacen in vivo, las glicosiltransferasas. Tales enzimas se pueden usar como catalizadores regio-y estereoselectivos para la síntesis in vitro de oligosacáridos (Ichikawa et al. (1992) Anal. Biochem. 202: 215-238) . Las sialiltransferasas son un grupo de glicosiltransferasas que transfieren ácido siálico de un nucleótido azúcar activado a oligosacáridos aceptores encontrados en glicoproteínas, glicolípidos o polisacáridos. El gran número de estructuras de oligosacárido sialiladas ha llevado a la caracterización de muchas sialiltransferasas diferentes implicadas en la síntesis de varias estructuras. Se han aislado y caracterizado sialiltransferasas de mamíferos y otros eucariotas y de microbios incluyendo C. jeuni, Neisseria, Haemophilus, y E. coli. (Tsuji et al. (1996) Glycobiology 6:v-vii; patentes en EE UU No. 6.503.744; 6.699.705; 6.096.529; 6.210.933; y Weisgerber et al. (1991) Glycobiol. 1:357-365) .
La síntesis enzimática de oligosacáridos a gran escala depende de la disponibilidad de cantidades suficientes de las glicosiltransferasas requeridas. Sin embargo, la producción de glicosiltransferasas en cantidades suficientes para su uso en la preparación de estructuras de oligosacáridos ha sido problemática. La presente invención resuelve este y otros problemas.
Breve compendio de la invención
En un aspecto, la presente invención proporciona una proteína sialiltransferasa con etiqueta que incluye una secuencia de aminoácidos con al menos el 95% de identidad a SEQ ID NO:4 y una etiqueta MGS en el extremo amino de SEQ ID NO:4. La proteína sialiltransferasa con etiqueta tiene actividad sialiltransferasa.
En otro aspecto, la presente invención proporciona un ácido nucleico que codifica la proteína sialiltransferasa con etiqueta anterior. En una forma de realización, la invención proporciona un vector de expresión que incluye el ácido nucleico. En otra forma de realización, la presente invención proporciona un vector de expresión de SEQ ID NO:3 para expresar una proteína sialiltransferasa con etiqueta. En una forma de realización más, la invención proporciona una célula huésped que comprende el vector de expresión.
En otro aspecto la invención proporciona un método de hacer una proteína sialiltransferasa con etiqueta, cultivando la célula huésped anterior en condiciones adecuadas para la expresión de la proteína sialiltransferasa con etiqueta. El método de hacer la proteína sialiltransferasa con etiqueta también puede incluir un paso de purificación de la proteína sialiltransferasa con etiqueta.
En otro aspecto, la presente invención proporciona un método in vitro para producir un producto de oligosacárido sialilado, poniendo en contacto un sustrato aceptor que comprende un oligosacárido con una sialiltransferasa con etiqueta de antes, y un sustrato donante de ácido siálico; y después permitir la transferencia de ácido siálico del sustrato donante al sustrato aceptor para producir el producto de oligosacárido sialilado. La producción del producto de oligosacárido sialilado ocurre in vitro.
Breve descripción de las figuras
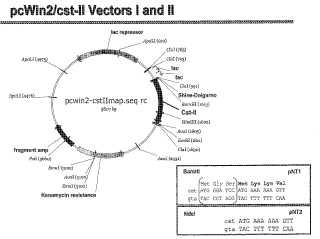
La figura 1 proporciona un mapa de restricción del plásmido pNT1, el vector pcwin2 construido para expresar una proteína CSTII con etiqueta MGS. El recuadro muestra las secuencias de aminoácidos N-terminales y de ácido nucleico 5' de la proteína CSTII en los vectores de expresión pNT1 y pNT2.
La figura 2 proporciona la secuencia de aminoácidos traducida completa de la proteína CSTII expresada del vector de expresión pNT1. La etiqueta MGS amino-terminal está entre paréntesis.
La figura 3 proporciona los componentes de medios rico y simple.
La figura 4 proporciona un esquema del proceso de purificación de CST-II.
La figura 5 proporciona un gradiente en pasos en Q-Sepharosa. Columna: XK26 con resina Q-Sepharosa FF (40 ml) . Equilibrio: 5 volúmenes de columna (VC) Tris 20 mM, pH 8, 3 (tampón A) . Carga de 130 ml de homogenizado clarificado (13 g de precipitado sin EDTA) . La columna se lavó con 5 VC de tampón A. Elución en gradiente en pasos con tampón B (NaCl 1 M en tampón A) : 4 VC de tampón B al 15%, 4 VC de tampón B al 25%, 4 VC de tampón B al 50%. Velocidad de flujo: 115 cm/h. Absorbancia a 280 nm. Se tomaron muestras de las fracciones para SDS-PAGE (figura 4) y ensayo enzimático de CST-II. El histograma de la actividad enzimática de CST-II se representa en el cromatograma en rojo. Se juntó la fracción 5 de elución de Q-Sepharosa para una purificación posterior. FT = flujo que pasa (Flow Through) .
La figura 6 proporciona el análisis por SDS-PAGE de las fracciones del gradiente por pasos de Q-Sepharosa. Se muestran las muestras de las fracciones de Q-Sepharosa de la figura 3. Est = See Blue Plus 2 (15 μl) . Carril 1: Homogenizado de CST-II (10 μl) . Carril 2: fracción 1 del flujo que pasa (10 μl) . Carril 3: fracción 2 del flujo que pasa (10 μl) . Carril 4: fracción 3 del flujo que pasa (10 μl) . Carril 5: fracción 4 del flujo que pasa (10 μl) . Carril 6: fracción 5 del flujo que pasa (10 μl) . Carril 7: fracción 6 del flujo que pasa (10 μl) . Carril 8: Mezcla flujo que pasa/lavado (22, 5 μl) . Carril 9: Fracción de elución 1 (14 μl) . Carril 10: Fracción de elución 2 (2, 8 μl) . Carril 11: Fracción de elución 3 (2, 4 μl) . Carril 12: Fracción de elución 4 (3 μl) . Carril 13: Fracción de elución 5 (1, 5 μl) . Carril 14: Fracción de elución 4 (4, 4 μl) . Carril 15: Fracción de elución 7 (4, 4 μl) . Carril 16: Fracción de elución 8 (11, 8 μl) . Carril 17: Fracción de elución 9 (3 μl) . Carril 18: Fracción de elución 10 (1, 8 μl) . Los geles de SDS PAGE de Tris-glicina del 4-20% se tiñeron mediante Simply Blue Safe Stain. La fracción de elución 5 de Q-Sepharosa (mostrada en el carril 13) se recogió para purificación posterior.
La figura 7 proporciona los gradientes en pasos en Q-Sepharosa con y sin dilución de la solución de carga. Columna: XK16 Q-Sepharosa FF (20 ml) . Homogenizado clarificado cargado (2 g con EDTA 5 mM, 20 ml) . Figura 7A: sin diluir, conductividad: 4, 66 ms/cm. Figura 7B: diluido 1:1 con tampón A (Tris 50 mM, pH 8, 3) , conductividad: 3, 3 ms/cm. Las columnas se lavaron con 5 CV de tampón A. Elución de gradiente en pasos con tampón B (NaCl 1 M en tampón A) : 5 VC de tampón B al 15%, 5 VC de tampón B al 100%. Velocidad de flujo: 115 cm/h. Absorbancia a 280 nm. El histograma de la actividad enzimática de CST-II se representa en el cromatograma en rojo. Las fracciones de CST-II se juntaron como se indica.
La figura 8 proporciona el análisis por... [Seguir leyendo]
Reivindicaciones:
1. Una proteína sialiltransferasa con etiqueta que comprende un polipéptido sialiltransferasa con al menos el 95% de identidad a SEQ ID NO:4 y una etiqueta MGS en el extremo amino de SEQ ID NO:4, en donde la proteína sialiltransferasa con etiqueta tiene actividad sialiltransferasa y la etiqueta MGS es el tripéptido Met-Gly-Ser.
2. La proteína sialiltransferasa con etiqueta de la reivindicación 1, en donde el polipéptido sialiltransferasa es SEQ ID NO:4.
3. La proteína sialiltransferasa con etiqueta según la reivindicación 1 que comprende un polipéptido sialiltransferasa y una etiqueta MGS en el extremo amino, en donde el polipéptido sialiltransferasa con etiqueta comprende el motivo A de sialiltransferasa, DVFRCNQF YFED/E (SEQ ID NO:11) y motivo B de sialiltransferasa, RITSGVYMC (SEQ ID NO: 12) , y en donde la proteína sialiltransferasa con etiqueta tiene actividad sialiltransferasa.
4. Un ácido nucleico que codifica la proteína sialiltransferasa con etiqueta de la reivindicación 1, 2 o 3.
5. Un vector de expresión que comprende el ácido nucleico de la reivindicación 4.
6. El vector de expresión de la reivindicación 5 que tiene la secuencia de SEQ ID NO: 3.
7. Una célula huésped que comprende el vector de expresión de la reivindicación 5.
8. Un método de hacer una proteína sialiltransferasa con etiqueta, el método comprende cultivar la célula huésped de la reivindicación 7 en condiciones adecuadas para la expresión de la proteína sialiltransferasa con etiqueta.
9. El método de la reivindicación 8, que comprende además el paso de purificar la proteína sialiltransferasa con etiqueta.
10. Un método in vitro de producir un producto oligosacárido sialilado, el método comprende los pasos de a) poner en contacto un sustrato aceptor que comprende un oligosacárido con la sialiltransferasa con etiqueta de la reivindicación 1, 2 o 3 y con un sustrato donante que comprende un grupo ácido siálico; y b) permitir la transferencia del grupo ácido siálico del sustrato donante al sustrato aceptor, produciendo de esta manera el producto oligosacárido sialilado.
11. Un método in vitro de producir una proteína eritropoyetina sialilada, el método comprende los pasos de a) poner en contacto una proteína eritropoyetina que comprende un oligosacárido con la sialiltransferasa con etiqueta de la reivindicación 1, 2 o 3 y con un sustrato donante que comprende un grupo ácido siálico; y b) permitir la transferencia del grupo ácido siálico del sustrato donante a la proteína eritropoyetina, produciendo de esta manera la proteína eritropoyetina sialilada.
12. El método de la reivindicación 11, en donde el grupo ácido siálico es un ácido siálico PEGilado.
FIGURA 2
Figura 4 Figura 5 Figura 6
Figura 7
Figura 8 Figura 9 Figura 10 Figura 11 Figura 12 Figura 13 Figura 14 Figura 15 Figura 16 Figura 17 Figura 18 Figura 19 Figura 20 Figura 21 Figura 22 Figura 23 Figura 24 Figura 25 Figura 26 Figura 27 Figura 28 Figura 29 Figura 30 Figura 31 Figura 32 Figura 33 Figura 34 Figura 35 Figura 36 Figura 37 Figura 38 Figura 39 Figura 40 Figura 41 Figura 42 Figura 43 Figura 44
Patentes similares o relacionadas:
Método para preparar una disolución acuosa que contiene medio de cultivo y agente quelante, del 22 de Julio de 2020, de Kyowa Kirin Co., Ltd: Método para preparar una disolución acuosa que presenta una filtrabilidad de membrana mejorada que comprende un medio de cultivo, en el que el medio de […]
PROCEDIMIENTO DE OBTENCIÓN DE SUBPRODUCTOS A PARTIR DE RESIDUOS DE CAFÉ Y APLICACIONES DE LOS MISMOS, del 13 de Julio de 2020, de UNIVERSIDAD DE GRANADA: Procedimiento de obtención de subproductos a partir de residuos de café y aplicaciones de los mismos. La presente invención consiste en un proceso […]
Biblioteca de péptidos y su uso, del 8 de Julio de 2020, de DAIICHI SANKYO COMPANY, LIMITED: Una biblioteca de péptidos que comprende una pluralidad de péptidos diferentes en la que los péptidos comprenden cada uno una secuencia de aminoácidos […]
Métodos para controlar la producción de proteasas, del 1 de Julio de 2020, de ROAL OY: Una célula hospedadora que comprende al menos un gen cromosómico inactivado en donde el gen cromosómico inactivado comprende una secuencia de ácido nucleico que codifica un […]
Señal para el empaquetamiento de vectores del virus de la gripe, del 24 de Junio de 2020, de WISCONSIN ALUMNI RESEARCH FOUNDATION: Un vector del virus de la gripe para la expresión y empaquetamiento de ARNv recombinante, en el que el vector comprende: secuencias correspondientes […]
Proceso para la purificación de daptomicina, del 6 de Mayo de 2020, de Cubist Pharmaceuticals LLC: Un método para purificar daptomicina que comprende: a) someter a la daptomicina a condiciones en las que una solución micelar de daptomicina se forma alterando el pH; y […]
Lipopéptidos de alta pureza, micelas de lipopéptidos y procesos para preparar los mismos, del 6 de Mayo de 2020, de Cubist Pharmaceuticals LLC: Un método para purificar daptomicina a partir de moléculas o agregados de alto peso molecular, en donde la daptomicina se proporciona en forma micelar, dicho […]
Métodos para ajustar los niveles de producción de carotenoides y composiciones en géneros de Rhodosporidium y Rhodotorula, del 15 de Abril de 2020, de TEMASEK LIFE SCIENCES LABORATORY LIMITED: Un método para ajustar el nivel de producción y la composición de carotenoides en un huésped fúngico que comprende: (a) manipular genéticamente […]