LIPOSOMAS PREPARADOS A PARTIR DE LIPIDOS EXTRAIBLES DE MYCOBACTERIUM.
Un liposoma que comprende uno o varios lípidos obtenibles a partir de una especie de micobacteria,
y que se seleccionan entre el fosfatidilinositol (PI), el fosfatidilinositol manósido (PIM1), el fosfatidilinositol dimanósido (PIM2), las formas mono y dipalmitoiladas de PIM1 y PIM2, fosfolípidos acilados que tienen picos de espectrometría de masas con bombardeo de átomos rápidos en 899, 1139 y 1155 m/z, la fosfatidiletanolamina y el cardiolípido, en donde dichos lípidos que se pueden obtener a partir de una micobacteria, son solubles en cloroformo y extraíbles con el mismo
Tipo: Patente Internacional (Tratado de Cooperación de Patentes). Resumen de patente/invención. Número de Solicitud: PCT/CA02/01217.
Solicitante: NATIONAL RESEARCH COUNCIL OF CANADA.
Nacionalidad solicitante: Canadá.
Dirección: 1200 MONTREAL ROAD,OTTAWA, ONTARIO K1A 0R6.
Inventor/es: SPROTT,G.,DENNIS, KRISHNAN,LAKSHMI, SAD,SUBASH.
Fecha de Publicación: .
Fecha Concesión Europea: 23 de Junio de 2010.
Clasificación Internacional de Patentes:
- A61K39/39 NECESIDADES CORRIENTES DE LA VIDA. › A61 CIENCIAS MEDICAS O VETERINARIAS; HIGIENE. › A61K PREPARACIONES DE USO MEDICO, DENTAL O PARA EL ASEO (dispositivos o métodos especialmente concebidos para conferir a los productos farmacéuticos una forma física o de administración particular A61J 3/00; aspectos químicos o utilización de substancias químicas para, la desodorización del aire, la desinfección o la esterilización, vendas, apósitos, almohadillas absorbentes o de los artículos para su realización A61L; composiciones a base de jabón C11D). › A61K 39/00 Preparaciones medicinales que contienen antígenos o anticuerpos (materiales para ensayos inmunológicos G01N 33/53). › caracterizados por los aditivos inmunoestimulantes, p. ej. por los adyuvantes químicos.
Clasificación PCT:
- A61K39/39 A61K 39/00 […] › caracterizados por los aditivos inmunoestimulantes, p. ej. por los adyuvantes químicos.
- A61K9/127 A61K […] › A61K 9/00 Preparaciones medicinales caracterizadas por un aspecto particular. › Liposomas.
- A61P35/00 A61 […] › A61P ACTIVIDAD TERAPEUTICA ESPECIFICA DE COMPUESTOS QUIMICOS O DE PREPARACIONES MEDICINALES. › Agentes antineoplásicos.
- A61P37/04 A61P […] › A61P 37/00 Medicamentos para el tratamiento de problemas inmunológicos o alérgicos. › Inmunoestimulantes.
Clasificación antigua:
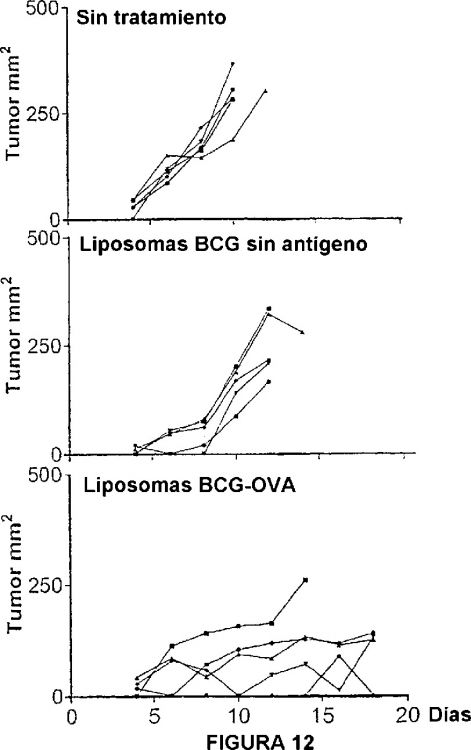
Fragmento de la descripción:
Liposomas preparados a partir de lípidos extraíbles de Mycobacterium.
Campo de la invención
Esta invención se refiere al uso de lípidos polares extraíbles con cloroformo a partir de la cepa BCG de la vacuna humana de Mycobacterium bovis, y de otras micobacterias con lípidos similares, para preparar liposomas con actividad inmunomoduladora y complementaria para estimular una respuesta inmune frente a un antígeno asociado. Los lípidos polares totales de BCG o de las fracciones lipídicas purificadas, de PI (fosfatidilinositol), PIM (fosfatidilinositol manósido), PIM2 (fosfatidilinositol dimanósido) y sus formas palmitoiladas, o los fosfolípidos acilados de 899, 1139 y 1155 m/z, se utilizan para formar liposomas a temperaturas elevadas y para activar las células presentadoras de antígeno de modo específico. La invención se refiere más específicamente al desarrollo de una vacuna, proporcionando un vehículo estable para el suministro del antígeno a las células presentadoras de antígeno, empleando glicerolípidos de BCG polares, extraíbles con cloroformo e inmunoestimuladores, que da como resultado una mejora de las respuestas del MHC de clase I y de clase II en un animal.
Antecedentes de la invención
A lo largo de la historia, las vacunas humanas han consistido en agentes patógenos víricos o bacterianos vivos y atenuados. La tolerancia y la seguridad del paciente suponen una preocupación que se basa en posibles reacciones secundarias de vacunas complejas y mal definidas, y la posibilidad de una vuelta a la virulencia. Un enfoque más actual es emplear antígenos definidos y muy purificados. Las reacciones secundarias se minimizan, pero la eficacia de estas vacunas de subunidades es generalmente baja, debido a una pérdida en inmunogenicidad cuando se purifica el antígeno. Otra dificultad es dirigir hacia la diana de forma eficaz, tanto el antígeno como el aditivo precisamente hacia las mismas células que presentan el antígeno. Además, la falta de eficacia se puede explicar por una respuesta inmune inadecuada, porque la protección puede requerir que predominen las respuestas humorales, las mediadas por células o con linfocitos T citotóxicos (CTL), dependiendo del agente patógeno en cuestión. Por ejemplo, la inmunidad protectora contra el carbunco está pensada para que requiera solamente una respuesta humoral, mientras que, una vacuna protectora contra agentes patógenos intracelulares tales como M. tuberculosis o el cáncer, requiere una respuesta fuerte de los CTL. El uso del alumbre como aditivo (aprobado para el uso en seres humanos) se basa en la formación de un complejo con el antígeno para proporcionar un efecto de depósito, que produce solamente una respuesta Th2, y no CTL. Además, las reacciones locales pueden tener lugar en el sitio de la inyección de los aditivos basados en aluminio, tales como alumbre (Koike y col. 1998).
Otros sistemas de aditivos, tales como los arqueosomas (Krishnan y col. 2001) y los complejos inmunoestimuladores (ISCOMS), son especialmente adecuados como aditivos transmitidos por células, pero solamente producen respuestas moderadas de los anticuerpos. Los ISCOMS tienen problemas relacionados con la toxicidad de las preparaciones de saponina, utilizadas en su construcción, y con el uso con antígenos solubles en agua (Bowersock y Martin 1999). En casos en los que el antígeno y el aditivo no se suministran conjuntamente como un sistema en partículas, tiene lugar una falta de eficacia en el suministro del antígeno a las mismas células presentadoras de antígeno, activadas con el aditivo. Muchos sistemas de suministro también requieren aditivos tales como Quil A o Lípido A (ej. ISCOMS, liposomas convencionales) con problemas de coste, estabilidad y toxicidad asociados con su uso. La simplicidad de la producción y los costes pueden ser un problema para muchos de estos sistemas complementarios. Finalmente, la falta de retención del antígeno encapsulado, volverá ineficaz a un sistema de vesículas de una vacuna.
La Mycobacterium spp. está asociada frecuentemente con la patogénesis y se conoce bien como agente causante de la tuberculosis (M. tuberculosis), la lepra (M. leprae), y como agente patógeno oportunista (M. avium). La capacidad del sistema inmune para responder a las células micobacterianas o a sus componentes, ha sido un área de intenso interés durante décadas, debido a la patogenicidad asociada con este género.
La vacuna actual contra la tuberculosis en los seres humanos es el cultivo del bacilo de Calmette-Guérin (BCG) de Mycobacterium bovis, que se pudo atenuar mediante pases en medio de laboratorio. Aunque las razones exactas para la atenuación todavía se están investigando (Behr y col. 2000), se descubrió pronto que las células completas termodestruidas de Mycobacterium tuberculosis mezcladas con aceite y un antígeno, daban como resultado una fuerte actividad como aditivo. Esto llegó a ser conocido como aditivo completo de Freund (FCA) y ha sido utilizado en numerosos laboratorios para potenciar a un anticuerpo fuerte, así como a una respuesta fuerte de los linfocitos T citotóxicos (CTL) (Skinner y col. 2001), frente a un antígeno proteico. Los componentes activos en el FCA incluyen el dipéptido de muramilo y el 6,6'-dimicolato de trehalosa, procedentes de la pared celular (Retzinger y col. 1981). El aditivo completo de Freund es tóxico por lo que causa una inflamación aguda, granulomas y toxicidad crónica (Retzinger y col. 1981) y es inaceptable, por lo tanto, para el uso en seres humanos o veterinario. La superficie de la Mycobacterium spp. está compuesta por la membrana citoplásmica rodeada por una pared celular formada por arabinogalactano de micoloilo, fijado covalentemente a peptidoglicano, y lipoarabinomanano asociado (LAM) (Chatterjee y Khoo 1998). Todas las cepas tienen estas capas, aunque la capa exterior parece diferir en detalles estructurales entre las cepas (Ortalo-Magné y col. 1996). Los lípidos comprenden parte de estas diferentes capas exteriores y representan hasta el 60% en peso de la pared celular micobacteriana. Esto incluye el micolil-arabinogalactano-peptidoglicano, el polímero unido covalentemente, y varios tipos de lípidos "extraíbles". Los lípidos "extraíbles" encontrados en diferentes cepas incluyen: (1) glicolípidos que contienen trehalosa, (2) lípidos de glicopéptido, (3) glicolípidos fenólicos, (4) lipooligosacáridos, (5) fosfatidilinositol manósidos (PIMs), (6) fosfatidiletanolamina y (7) triacilgliceroles (Wang y col. 2000; Besra y Brennan 1994). Las estructuras completadas para nuevos palmitoil- y dipalmitoil-PIMs se han descrito recientemente (Gilleron y col. 2001). Además, estos autores mostraron que el fosfatidilinositol (PI) tenía la misma capacidad que PIM1 y PIM2 (todo adsorbido aparentemente sobre alumbre) para inducir el reclutamiento de los linfocitos T citolíticos naturales, indicando que no había diferencias en la respuesta biológica con la adición de residuos de manosa al PI (Gilleron y col. 2001). Este efecto biológico está en contraste directo con la estimulación de las células dendríticas para secretar IL-12 mediante PIMs, y no PI, según se observa en la presente invención.
Los LAMs representan el equivalente micobacteriano de los lipopolisacáridos Gram negativos. Estos lípidos están compuestos por un anclaje de fosfatidilinositol, un núcleo de manano, un dominio de arabinano, y también casquetes de manooligosacárido en el caso de ManLAMs (Chatterjee y Khoo 1998). Los LAMs ejercen sus efectos sobre el sistema inmune en distintos modos. Por ejemplo, el LAM aislado a partir de micobacterias que crecían activamente, activaba células que expresaban un receptor 2 similar a Toll (TLR2) en una forma dependiente de TLR, pero el LAM aislado a partir de BCG no podía (Means y col. 1999). El LAM es un polímero hidrosoluble y, por lo tanto, no será un componente de los lípidos solubles en cloroformo utilizados en esta memoria (Nigou y col. 1997).
Otros lípidos de las micobacterias tienen actividad inmunomoduladora. El glicolípido fenólico 6,6-dimicolato de trehalosa (factor de cordón) es un componente activo en FCA capaz de promover una respuesta de tipo CTL específica del antígeno (Skinner y col. 2001), y moderar los títulos de anticuerpo cuando se inyecta con un antígeno (Koike y col. 1998). Esto contrasta con la presente invención en 1) los liposomas no se utilizaron, 2) los títulos de los anticuerpos no eran altos con el factor de cordón y 3) el factor de cordón estaba ausente de los lípidos utilizados en esta invención.
Se ha observado que los glicolípidos fenólicos...
Reivindicaciones:
1. Un liposoma que comprende uno o varios lípidos obtenibles a partir de una especie de micobacteria, y que se seleccionan entre el fosfatidilinositol (PI), el fosfatidilinositol manósido (PIM1), el fosfatidilinositol dimanósido (PIM2), las formas mono y dipalmitoiladas de PIM1 y PIM2, fosfolípidos acilados que tienen picos de espectrometría de masas con bombardeo de átomos rápidos en 899, 1139 y 1155 m/z, la fosfatidiletanolamina y el cardiolípido, en donde dichos lípidos que se pueden obtener a partir de una micobacteria, son solubles en cloroformo y extraíbles con el mismo.
2. Un liposoma de acuerdo con la reivindicación 1, en donde la especie de micobacteria es Mycobacterium bovis BCG.
3. Un liposoma de acuerdo con una de las reivindicaciones 1 ó 2, en donde el lípido soluble en cloroformo y extraíble con el mismo es PIM1.
4. Un liposoma de acuerdo con una de las reivindicaciones 1 ó 2, en donde el lípido soluble en cloroformo y extraíble con el mismo es PIM2.
5. Un liposoma de acuerdo con una de las reivindicaciones 1 ó 2, en donde el lípido soluble en cloroformo y extraíble con el mismo es palmitoil-PIM1.
6. Un liposoma de acuerdo con una de las reivindicaciones 1 ó 2, en donde el lípido soluble en cloroformo y extraíble con el mismo es palmitoil-PIM2.
7. Un liposoma de acuerdo con una de las reivindicaciones 1 ó 2, en donde el lípido polar soluble en cloroformo y extraíble con el mismo se puede obtener mediante extracción con etanol caliente al 50%.
8. Un liposoma de acuerdo con una de las reivindicaciones 1 ó 2, que comprende el lípido fosfatidiletanolamina.
9. Un liposoma de acuerdo con las reivindicaciones 1 ó 2, que comprende adicionalmente otro lípido, en donde el otro lípido es fosfatidilcolina, fosfatidilglicerol, colesterol o una mezcla de cualquiera de ellos.
10. Una composición de vacuna con liposoma que comprende un liposoma de acuerdo con una cualquiera de las reivindicaciones 1 a 9, en donde el liposoma contiene un antígeno asociado.
11. Una composición de vacuna con liposoma de acuerdo con la reivindicación 10, en donde el antígeno es una proteína.
12. Un método para preparar un liposoma de acuerdo con una cualquiera de las reivindicaciones 1 a 9, cuyo método comprende secar el lípido soluble en cloroformo y extraíble con el mismo procedente de Mycobacterium SPP y a continuación hidratar dicho lípido seco a una temperatura de 65 a 75ºC en agua o en solución salina tamponada con fosfato (PBS).
13. Un método de acuerdo con la reivindicación 12, en donde dicha temperatura es 65ºC.
14. Un método de acuerdo con la reivindicación 12, en donde dicho liposoma resultante de dicho método es multilamelar.
15. Un método de acuerdo con la reivindicación 14, que comprende adicionalmente reducir el tamaño de un liposoma multilamelar a una temperatura de 65ºC para obtener un liposoma unilamelar.
16. Un método de acuerdo con la reivindicación 14, en donde un antígeno está atrapado en dicho liposoma multilamelar mediante la inclusión de dicho antígeno en dicha agua o dicha solución salina tamponada con fosfato.
17. Un método de acuerdo con la reivindicación 16, en donde un antígeno está atrapado en dicho liposoma unilamelar mediante la inclusión de dicho antígeno en dicha agua o dicha solución salina tamponada con fosfato.
18. Uso de un liposoma de acuerdo con una cualquiera de las reivindicaciones 1 a 9, en la preparación de un medicamento para estimular una respuesta inmune en un mamífero.
19. Uso de acuerdo con la reivindicación 18, en donde la estimulación de la respuesta inmune en un mamífero se consigue activando las células dendríticas en donde la activación produce la secreción de interleucina-12 (IL-12) a través de dichas células dendríticas.
20. Uso de acuerdo con la reivindicación 18, en donde la estimulación de la respuesta inmune en un mamífero se consigue activando las células dendríticas en donde la activación produce la secreción del factor de necrosis tumoral (TNF) a través de dichas células dendríticas.
21. Uso de acuerdo con la reivindicación 18, en donde la estimulación de la respuesta inmune en un mamífero se consigue activando las células dendríticas en donde la activación produce la secreción de interleucina 12 (IL-12) y el factor de necrosis tumoral (TNF) a través de dichas células dendríticas.
22. El uso de un liposoma de acuerdo con una cualquiera de las reivindicaciones 18 a 21, en donde dicho liposoma comprende adicionalmente un antígeno.
23. Uso de una composición de vacuna con liposoma de acuerdo con la reivindicación 10 u 11, para preparar un medicamento para producir una respuesta inmune en un mamífero.
24. El uso de acuerdo con la reivindicación 23, en donde el liposoma sirve a la vez como vehículo para el antígeno y como estimulador de una respuesta inmune.
25. El uso de acuerdo con la reivindicación 23, en donde la respuesta inmune es una respuesta de un anticuerpo específica del antígeno y una respuesta de linfocitos T citotóxicos específica del antígeno.
26. Uso de una composición de vacuna con liposoma de acuerdo con la reivindicación 10 u 11, para preparar un medicamento para el tratamiento terapéutico o profiláctico del cáncer.
27. Uso de una composición de vacuna con liposoma de acuerdo con la reivindicación 10 u 11, para preparar un medicamento para dirigir una respuesta inmune de manera que confiera una protección contra un agente patógeno o un cáncer.
Patentes similares o relacionadas:
Composición de vacuna que contiene un adyuvante sintético, del 22 de Julio de 2020, de INFECTIOUS DISEASE RESEARCH INSTITUTE: Una composición farmacéutica que comprende: un adyuvante lípido de glucopiranosilo (GLA), que tiene la fórmula: **(Ver fórmula)** en la que: […]
Métodos mejorados para la preparación de escualeno, del 15 de Julio de 2020, de NOVARTIS AG: Un procedimiento para la preparación de escualeno a partir de una composición que comprende escualeno a partir de una fuente animal, dicho procedimiento comprendiendo […]
Respuesta inmune mejorada en especies aviares, del 1 de Julio de 2020, de Bayer Intellectual Property GmbH: Una composición de inmunomodulador, en que la composición del inmunomodulador comprende: a. un vehículo catiónico de administración de liposomas; y […]
Composición farmacéutica que comprende un complejo de carga portador polimérico y al menos un antígeno proteínico o peptídico, del 1 de Julio de 2020, de CureVac AG: Composición farmacéutica que incluye: (A) un complejo de carga portador polimérico, que comprende: a) un portador polimérico que comprende componentes catiónicos reticulados […]
Formulaciones de inulina y de acetato de inulina, del 5 de Junio de 2020, de SOUTH DAKOTA STATE UNIVERSITY (100.0%): Una composición que comprende micropartículas o nanopartículas de acetato de inulina (InAc) y una molécula de carga, en la que la molécula de carga está encapsulada […]
Métodos para proporcionar virosomas con adyuvante y virosomas con adyuvante obtenibles de esta manera, del 3 de Junio de 2020, de BESTEWIL HOLDING B.V: Un método para preparar los virosomas con adyuvante, que comprende las etapas de: (i) proporcionar una composición acuosa de los virosomas sin adyuvante que comprende […]
Composición de medio para preparar toxina botulínica, del 6 de Mayo de 2020, de Daewoong Co., Ltd: Una composición de medio libre de EET para su uso en el cultivo de Clostridium botulinum, la composición de medio comprende: peptonas de origen […]
Inmunomodulación mediante inhibidores de IAP, del 6 de Mayo de 2020, de NOVARTIS AG: Una vacuna que comprende una cantidad inmunogénica de un antígeno procedente de tumor o antígeno tumoral y un adyuvante que comprende un inhibidor de IAP […]