INHIBICION DE UNA ASOCIACION TAU-TAU.
Fenotiazina de fórmula:
Tipo: Patente Europea. Resumen de patente/invención. Número de Solicitud: E00121739.
Solicitante: THE UNIVERSITY COURT OF THE UNIVERSITY OF ABERDEEN.
Nacionalidad solicitante: Reino Unido.
Dirección: UNIVERSITY OFFICE, REGENT WALK,ABERDEEN AB24 3FX.
Fecha de Publicación: .
Fecha Solicitud PCT: 25 de Marzo de 1996.
Fecha Concesión Europea: 9 de Junio de 2010.
Clasificación Internacional de Patentes:
- A61K31/5415 NECESIDADES CORRIENTES DE LA VIDA. › A61 CIENCIAS MEDICAS O VETERINARIAS; HIGIENE. › A61K PREPARACIONES DE USO MEDICO, DENTAL O PARA EL ASEO (dispositivos o métodos especialmente concebidos para conferir a los productos farmacéuticos una forma física o de administración particular A61J 3/00; aspectos químicos o utilización de substancias químicas para, la desodorización del aire, la desinfección o la esterilización, vendas, apósitos, almohadillas absorbentes o de los artículos para su realización A61L; composiciones a base de jabón C11D). › A61K 31/00 Preparaciones medicinales que contienen ingredientes orgánicos activos. › condensados en orto o en peri con sistemas carbocíclicos, p. ej. fenotiazina, clorpromazina, piroxicam.
- C07K14/47A3
- G01N33/50D2
- G01N33/50D2E
- G01N33/68V2
Clasificación PCT:
- A61K31/54 A61K 31/00 […] › que tienen ciclos con seis eslabones con al menos un nitrógeno y al menos un azufre como heteroátomos de un ciclo, p. ej. sultiam.
- G01N33/50 FISICA. › G01 METROLOGIA; ENSAYOS. › G01N INVESTIGACION O ANALISIS DE MATERIALES POR DETERMINACION DE SUS PROPIEDADES QUIMICAS O FISICAS (procedimientos de medida, de investigación o de análisis diferentes de los ensayos inmunológicos, en los que intervienen enzimas o microorganismos C12M, C12Q). › G01N 33/00 Investigación o análisis de materiales por métodos específicos no cubiertos por los grupos G01N 1/00 - G01N 31/00. › Análisis químico de material biológico, p. ej. de sangre o de orina; Ensayos mediante métodos en los que interviene la formación de uniones bioespecíficas con grupos coordinadores; Ensayos inmunológicos (procedimientos de medida o ensayos diferentes de los procedimientos inmunológicos en los que intervienen enzimas o microorganismos, composiciones o papeles reactivos a este efecto, procedimientos para preparar estas composiciones, procedimientos de control sensibles a las condiciones del medio en los procedimientos microbiológicos o enzimáticos C12Q).
- G01N33/68 G01N 33/00 […] › en los que intervienen proteínas, péptidos o aminoácidos.
Clasificación antigua:
- A61K31/54 A61K 31/00 […] › que tienen ciclos con seis eslabones con al menos un nitrógeno y al menos un azufre como heteroátomos de un ciclo, p. ej. sultiam.
- G01N33/50 G01N 33/00 […] › Análisis químico de material biológico, p. ej. de sangre o de orina; Ensayos mediante métodos en los que interviene la formación de uniones bioespecíficas con grupos coordinadores; Ensayos inmunológicos (procedimientos de medida o ensayos diferentes de los procedimientos inmunológicos en los que intervienen enzimas o microorganismos, composiciones o papeles reactivos a este efecto, procedimientos para preparar estas composiciones, procedimientos de control sensibles a las condiciones del medio en los procedimientos microbiológicos o enzimáticos C12Q).
- G01N33/68 G01N 33/00 […] › en los que intervienen proteínas, péptidos o aminoácidos.
Países PCT: Austria, Bélgica, Suiza, Alemania, Dinamarca, España, Francia, Reino Unido, Grecia, Italia, Liechtensein, Luxemburgo, Países Bajos, Suecia, Portugal, Irlanda, Finlandia.
Fragmento de la descripción:
Inhibición de una asociación tau-tau.
La presente descripción se refiere a procedimientos novedosos para la detección de sustancias capaces de modular o inhibir la asociación tau-tau patológica de proteína y la agregación patológica de neurofilamentos. Los procedimientos de la presente invención son especialmente útiles para examinar sustancias para la profilaxis y tratamiento de la enfermedad de Alzheimer.
La enfermedad de Alzheimer (AD) es la causa única más común de demencia en la tercera edad (Livingstone (1994). The scale of the problem. En: Dementia (Eds. Burns y Levy), Chapman & Hill, London, pp. 21-35). Los individuos con la enfermedad de Alzheimer se caracterizan por la demencia progresiva que se presenta con pérdida de memoria creciente, alteraciones en el juicio, percepción y habla, y deterioro global del intelecto (Roth e Iversen Brit. Med. Bull. volumen especial (1986)).
Los contrastes patológicos mayores de la enfermedad de Alzheimer son las placas seniles y las marañas neurofibrilares, ambas de las cuales contienen filamentos helicoidales emparejados (PHF), de los cuales es constituyente la proteína tau (Wischik et al., Proc. Natl. Acad. Sci. USA 85:4506-4510 (1988)). Las placas también contienen fibras ß-amiloideas derivadas de una anormalidad, todavía no definida, en el procesamiento de la proteína precursora amiloidea (APP; Kang et al., Nature 325:733-736 (1987)).
Los estudios de la enfermedad de Alzheimer han apuntado a la pérdida de la proteína tau normal asociada a microtúbulo (Mukaetova-Landinska, Am. J. Pathol. 143:565-578 (1993); Wischik et al., Neurobiol. Ageing 16:409-417 (1995a); Lai et al., Neurobiol. Ageing 16:433-445 (1995b)), a la acumulación de filamentos helicoidales emparejados patológicos (PHF; Mukaetova-Landinska, loc. cit. (1993); Harrington et al., Dementia 5:215-228 (1994a); Harrington et al., Am. J. Pathol. 145:1472-1484 (1994b); Wischik et al., loc. cit. (1995a)), y la pérdida de sinapsis en el córtex frontal medio (Terry et al., Ann. Neurol. 30:572-580 (1991)) como marcadores discriminantes fuertes del deterioro intelectual. En la enfermedad de Alzheimer, la pérdida de sinapsis (Terry et al., loc. cit.) y la pérdida de células piramidales (Bondareff et al., Arch. Gen. Psychiatry 50:350-356 (1993)) están correlacionadas ambas con medidas morfométricas de la patología neurofibrilar reactiva a la tau, y esto se correlaciona, a nivel molecular, con una redistribución prácticamente completa del "pool" de proteína tau, de la forma soluble a la forma polimerizada (PHF) (Mukaetova-Landinska, loc. cit. (1993); Lai et al., loc. cit. (1995)). Una posible explicación para estos cambios es que la redistribución patológica de la proteína tau en PHF causa un fallo en el transporte axonal en circuitos de asociación cortico-cortical, a través de la incapacidad de mantener la tubulina axonal en el estado polimerizado dentro de las células piramidales (Wischick et al., loc. cit. (1995); Wischik et al., Neurobiol. Ageing, en prensa; Wischik et al., Structure, biochemistry and molecular pathogenesis of paired helical filaments in Alzheimer's disease. Eds. A. Goate y F. Ashall, en prensa; Lai et al., loc. cit. (1995)). Un fallo resultante del transporte de constituyentes sinápticos desde el soma de proyección hasta el neocórtex de asociación distante conduciría a la pérdida sináptica y al deterioro intelectual. Otros factores incluyen la toxicidad directa de la acumulación de PHF en células piramidales (Bondareff et al., Arch. Gen. Psychiat. 50:350-356 (1993); J. Neuropath. Exp. Neurol. 53:158-164 (1994)), y la posible toxicidad directa de la acumulación truncada de tau, que perjudica la función celular (Mena et al., J. Neuropath. Exp. Neurol. 50:474-490 (1991)).
Aunque los estudios de la patogénesis molecular en sistemas modelo ha enfatizado el papel neurotóxico de la acumulación de ß-amiloidea (revisada en Harrington y Wischik, Molecular Pathobiology of Alzheimer's disease. En: Dementia (Eds. Burns y Levy), Chapman & Hill, London, pp. 211-238), la evidencia que une la deposición de ß-amiloidea con el deterioro intelectual en humanos es débil. Es más probable que el procesamiento alterado de la APP sea sólo uno de los varios factores posibles que podrían iniciar el procesamiento alterado de la proteína tau. Otros factores iniciadores incluyen procesos desconocidos asociados con la apoE4 (Harrington et al., loc. cit. (1994)), la trisomía del cromosoma 21 (Mukaetova-Ladinska et al., Dev. Brain. Dysfunct. 7:311-329 (1994)), y factores medioambientales tales como la exposición prolongada a niveles subtóxicos de aluminio (Harrington et al., Lancet 343:993-997 (1994c)). Distintos factores etiológicos son capaces de iniciar un patrón común de alteración en el procesamiento de la proteína tau, los cuales incluyen: la truncamiento C-terminal en el Glu-391, la formación de polímeros de tau PHF, la pérdida de tau soluble, y la acumulación de especies de tau anormalmente fosforiladas (Wischik et al., Int. Rev. Psychiat. en prensa (1996)).
El fragmento de la proteína tau asociada a microtúbulo que se ha observado es un constituyente integral de la estructura nuclear resistente a las proteasas del PHF, es un fragmento de 93/95 residuos de aminoácidos derivado del dominio de unión a microtúbulo de la tau (Wischick et al., loc. cit. (1988); Kondo et al., Neuron 1:827-834 (1988); Jakes et al., EMBO J. 10:2725-2729 (1991); Novak et al., EMBO J. 12:365-370 (1993)). La proteína tau existe en 6 isoformas de 352-411 residuos de aminoácidos en el cerebro adulto (Goedert et al., Neuron 3:519-526 (1989)). En general, la estructura de la molécula de tau consiste en un extenso dominio N-terminal de 252 residuos, el cual se proyecta a partir del microtúbulo, una región de repetición en tándem de 93-125 residuos, consistente en 3 ó 4 repeticiones en tándem, y la cual es el dominio de unión al microtúbulo, y una cola C-terminal de 64 residuos. Cada repetición en tándem está compuesta de un segmento de unión a tubulina de 19 residuos, y un segmento de engarce de 12 residuos (Burtner y Kischner, J. Cell. Biol. 115:717-730 (1991); Figura 1). El constituyente mayoritario de tau que se puede extraer a partir de preparaciones enriquecidas en el núcleo de PHF resistente a proteasas es un fragmento de 12 kDa derivado de ambas, las isoformas de 3 y 4 repeticiones, pero restringido al equivalente a 3 repeticiones en tándem, con independencia de la isoforma (Jakes et al., loc. cit.; Figura 2). Los límites N- y C-terminal del fragmento definen la extensión precisa de la unidad de tau del núcleo del PHF resistente a proteasas. Tiene la fase desplazada 14/16 residuos con respecto a la organización unidor/engarce de la molécula normal definida por Butner y Kirschner(loc. cit., Figura 1), y está truncada de forma C-terminal en el Glu-391, o en una posición homóloga en la tercera repetición de la isoforma de 4 repeticiones (Novak et al., loc. cit. (1993); Figura 3). Hay disponible un anticuerpo monoclonal (mAb 423) que reconoce específicamente este punto de truncamiento C-terminal, y los estudios histológicos usando este anticuerpo han mostrado la presencia de proteína tau truncada C-terminalmente en el Glu-391 en todas las etapas de degeneración neurofibrilar (Mena et al., Acta Neuropathol. 89:50-56 (1995); Mena et al., Acta Neuropathol., en prensa). Por tanto, la proteolisis anormal es una posible modificación post-traducción implicada en el ensamblaje del PHF.
Se han desarrollado procedimientos que permiten la discriminación entre los diversos "pooles" de tau que se hallan en los tejidos cerebrales en AD: tau soluble normal, tau fosforilada, y PHF resistentes a proteasas (Harrington et al., loc. cit. (1990), (1991), (1994a)). Estos procedimientos se han desplegado en estudios de AD grave y del Síndrome de Down (Mukaetova-Ladinska et al., loc. cit. (1993; 1995)), en casos verificados prospectivamente en las primeras etapas de la AD (Wischik et al., loc. cit. (1995a); Lai et al., loc. cit. (1995)), y en casos con otros diagnósticos neuropatológicos, incluyendo la demencia senil del tipo cuerpo de Lewy y la enfermedad de Parkinson (Harrington et al.,...
Reivindicaciones:
1. Fenotiazina de fórmula:
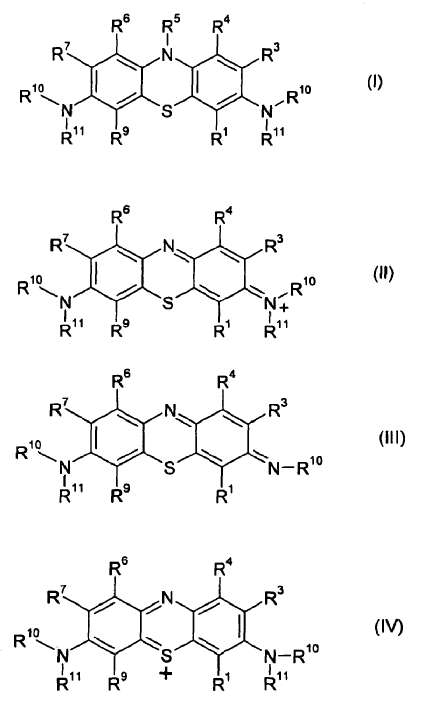
en donde:
R1, R3, R4, R6, R7 y R9 se seleccionan independientemente entre hidrógeno, halógeno, hidroxilo, carboxilo, alquilo sustituido o no sustituido, haloalquilo o alcoxi;
R5, cada R10 y cada R11 se seleccionan entre hidrógeno, hidroxilo, carboxilo, alquilo sustituido o no sustituido, haloalquilo o alcoxi;
y sales farmacéuticamente aceptables de los mismos, para la utilización en la profilaxis o tratamiento de una enfermedad neurodegenerativa de la agregación patológica tau-tau mediante la inhibición de dicha asociación tau-tau sin inhibición de la unión normal tau-tubilina.
2. Fenotiazina según la reivindicación 1, en donde dicha fenotiazina se selecciona del grupo donde:
R1, R3, R4, R5, R6, R7, R9, cada R10 y cada R11 se seleccionan independientemente entre -CH3, -C2H5 ó -C3H7.
3. Fenotiazina según la reivindicación 1, en donde dicha fenotiazina tiene la fórmula (i) de más arriba.
4. Fenotiazina según la reivindicación 3, en donde R5 es hidrógeno.
5. Fenotiazina según la reivindicación 1, en donde dicho compuesto se selecciona entre el Azul de metileno, el Azul de Toluidina O, la tionina, el Azure A, el Azure B o el Azul de 1,9-dimetil-metileno.
6. Fenotiazina según la reivindicación 1, en donde el agente está presente en una cantidad terapéuticamente eficaz en un material portador terapéuticamente inerte en una composición farmacéutica.
7. Azul de metileno para utilizar en el tratamiento de la enfermedad de Alzheimer.
Patentes similares o relacionadas:
Procedimiento de preparación de compuestos de diaminofenotiazinio, del 3 de Junio de 2020, de Provepharm Life Solutions: Procedimiento de preparación de un compuesto que responde a la fórmula (I) siguiente: **(Ver fórmula)** en la que cada uno de R1, R2, R3, R4, R5, R6, […]
Compuestos de atropisómeros tricíclicos, del 15 de Abril de 2020, de BRISTOL-MYERS SQUIBB COMPANY: Un compuesto de fórmula (I) **(Ver fórmula)** o una de sus sales, en la que: las dos líneas de puntos representan dos enlaces sencillos o dos […]
Formulación de liberación sostenida de un fármaco antiinflamatorio no esteroideo, del 1 de Enero de 2020, de PACIRA PHARMACEUTICALS, INC: Procedimiento para la preparación de formulaciones de liposomas multivesiculares, comprendiendo el procedimiento: proporcionar una primera […]
Nuevos comprimidos de meloxicam de baja concentración, del 20 de Noviembre de 2019, de BOEHRINGER INGELHEIM VETMEDICA GMBH: Un comprimido sólido que está directamente prensado a partir de un polvo, que comprende meloxicam o una sal farmacéuticamente aceptable del mismo y excipientes, […]
Compuesto antiviral y terapia de combinación de inhibidores de la COX-2 para la fibromialgia, del 30 de Octubre de 2019, de Innovative Med Concepts, LLC: Una combinación para uso en un método para tratar a un sujeto susceptible o afectado por fibromialgia, que comprende una cantidad terapéuticamente efectiva de un componente […]
Compuestos tricíclicos que contienen nitrógeno para tratar infección por Neisseria gonorrhoeae, del 18 de Septiembre de 2019, de GlaxoSmithKline Intellectual Property Development Limited: Un compuesto para uso en el tratamiento de infección por Neisseria gonorrhoeae, cuyo compuesto se selecciona de la lista que consiste en: 2-({4-[(3,4-dihidro-2H-pirano[2,3-c]piridin-6-ilmetil)amino]-1-piperidinil}metil)-1,2-dihidro-3H,8H-2a,5,8a- […]
Composición y métodos de aumento de la sensibilidad a la insulina, del 11 de Septiembre de 2019, de Nalpropion Pharmaceuticals, Inc: Una composición que comprende una combinación de bupropión o una sal farmacéuticamente aceptable del mismo y un antagonista opioide para usar en un método para tratar […]
 Suministro de fármaco anti-inflamatorio no esteroideo de liberación sostenida, del 28 de Agosto de 2019, de Solani Therapeutics Ltd: Un depósito adecuado para administración parenteral y suministro de fármacos de liberación sostenida,
comprendiendo dicho depósito un cuerpo de material […]
Suministro de fármaco anti-inflamatorio no esteroideo de liberación sostenida, del 28 de Agosto de 2019, de Solani Therapeutics Ltd: Un depósito adecuado para administración parenteral y suministro de fármacos de liberación sostenida,
comprendiendo dicho depósito un cuerpo de material […]