VACUNA DERIVADA DE LEVADURA CONTRA IPNV.
Proceso para la producción de una vacuna bivalente para la utilización contra el virus de la necrosis pancreática infecciosa (IPNV) en peces,
caracterizado porque comprende: (i) cultivar células huésped de levadura que expresan dos polipéptidos diferentes de IPNV que son respectivamente: (a) un polipéptido VP3 de IPNV o un fragmento del mismo que comprende una secuencia que tiene por lo menos un 90% de identidad en la secuencia con la secuencia del Anexo B o el Anexo D (b) un polipéptido VP2 de IPNV o un fragmento del mismo que comprende una secuencia que tiene por lo menos un 90% de identidad en la secuencia con la secuencia del Anexo A o el Anexo C, en el que en cada caso el polipéptido o el fragmento es capaz de estimular la producción de anticuerpos que se unen a IPNV, cultivo, y en el que los polipéptidos de IPNV expresados se secretan de las células huésped en el sobrenadante de (ii) formular los polipéptidos de IPNV como una vacuna
Tipo: Patente Internacional (Tratado de Cooperación de Patentes). Resumen de patente/invención. Número de Solicitud: PCT/GB2001/004986.
Solicitante: THE UNIVERSITY COURT OF THE UNIVERSITY OF ABERDEEN.
Nacionalidad solicitante: Reino Unido.
Dirección: REGENT WALK ABERDEEN AB24 3FX REINO UNIDO.
Inventor/es: MELVIN, WILLIAM, THOMAS, BREEMAN,Suzanne, LABUS,Marie,Beagley.
Fecha de Publicación: .
Fecha Solicitud PCT: 12 de Noviembre de 2001.
Clasificación PCT:
- A61K39/12 NECESIDADES CORRIENTES DE LA VIDA. › A61 CIENCIAS MEDICAS O VETERINARIAS; HIGIENE. › A61K PREPARACIONES DE USO MEDICO, DENTAL O PARA EL ASEO (dispositivos o métodos especialmente concebidos para conferir a los productos farmacéuticos una forma física o de administración particular A61J 3/00; aspectos químicos o utilización de substancias químicas para, la desodorización del aire, la desinfección o la esterilización, vendas, apósitos, almohadillas absorbentes o de los artículos para su realización A61L; composiciones a base de jabón C11D). › A61K 39/00 Preparaciones medicinales que contienen antígenos o anticuerpos (materiales para ensayos inmunológicos G01N 33/53). › Antígenos virales.
- A61K39/295 A61K 39/00 […] › Antígenos virales polivalentes (virus de la viruela o de la varicela A61K 39/285 ); Mezclas de antígenos virales y bacterianos.
- A61K39/39 A61K 39/00 […] › caracterizados por los aditivos inmunoestimulantes, p. ej. por los adyuvantes químicos.
- A61P31/12 A61 […] › A61P ACTIVIDAD TERAPEUTICA ESPECIFICA DE COMPUESTOS QUIMICOS O DE PREPARACIONES MEDICINALES. › A61P 31/00 Antiinfecciosos, es decir antibióticos, antisépticos, quimioterápicos. › Antivirales.
- C07K14/08 QUIMICA; METALURGIA. › C07 QUIMICA ORGANICA. › C07K PEPTIDOS (péptidos que contienen β -anillos lactamas C07D; ipéptidos cíclicos que no tienen en su molécula ningún otro enlace peptídico más que los que forman su ciclo, p. ej. piperazina diones-2,5, C07D; alcaloides del cornezuelo del centeno de tipo péptido cíclico C07D 519/02; proteínas monocelulares, enzimas C12N; procedimientos de obtención de péptidos por ingeniería genética C12N 15/00). › C07K 14/00 Péptidos con más de 20 aminoácidos; Gastrinas; Somatostatinas; Melanotropinas; Sus derivados. › Virus ARN.
- C12N1/19 C […] › C12 BIOQUIMICA; CERVEZA; BEBIDAS ALCOHOLICAS; VINO; VINAGRE; MICROBIOLOGIA; ENZIMOLOGIA; TECNICAS DE MUTACION O DE GENETICA. › C12N MICROORGANISMOS O ENZIMAS; COMPOSICIONES QUE LOS CONTIENEN; PROPAGACION, CULTIVO O CONSERVACION DE MICROORGANISMOS; TECNICAS DE MUTACION O DE INGENIERIA GENETICA; MEDIOS DE CULTIVO (medios para ensayos microbiológicos C12Q 1/00). › C12N 1/00 Microorganismos, p.ej. protozoos; Composiciones que los contienen (preparaciones de uso médico que contienen material de protozoos, bacterias o virus A61K 35/66, de algas A61K 36/02, de hongos A61K 36/06; preparación de composiciones de uso médico que contienen antígenos o anticuerpos bacterianos, p. ej. vacunas bacterianas, A61K 39/00 ); Procesos de cultivo o conservación de microorganismos, o de composiciones que los contienen; Procesos de preparación o aislamiento de una composición que contiene un microorganismo; Sus medios de cultivo. › modificados por la introducción de material genético extraño.
- C12N15/40 C12N […] › C12N 15/00 Técnicas de mutación o de ingeniería genética; ADN o ARN relacionado con la ingeniería genética, vectores, p. ej. plásmidos, o su aislamiento, su preparación o su purificación; Utilización de huéspedes para ello (mutantes o microorganismos modificados por ingeniería genética C12N 1/00, C12N 5/00, C12N 7/00; nuevas plantas en sí A01H; reproducción de plantas por técnicas de cultivo de tejidos A01H 4/00; nuevas razas animales en sí A01K 67/00; utilización de preparaciones medicinales que contienen material genético que es introducido en células del cuerpo humano para tratar enfermedades genéticas, terapia génica A61K 48/00; péptidos en general C07K). › Proteínas de virus ARN, p. ej. Flavivirus.
- C12N15/81 C12N 15/00 […] › para levaduras.
Clasificación antigua:
- A61K39/12 A61K 39/00 […] › Antígenos virales.
- A61K39/295 A61K 39/00 […] › Antígenos virales polivalentes (virus de la viruela o de la varicela A61K 39/285 ); Mezclas de antígenos virales y bacterianos.
- A61K39/39 A61K 39/00 […] › caracterizados por los aditivos inmunoestimulantes, p. ej. por los adyuvantes químicos.
- A61P31/12 A61P 31/00 […] › Antivirales.
- C07K14/08 C07K 14/00 […] › Virus ARN.
- C12N1/19 C12N 1/00 […] › modificados por la introducción de material genético extraño.
- C12N15/40 C12N 15/00 […] › Proteínas de virus ARN, p. ej. Flavivirus.
- C12N15/81 C12N 15/00 […] › para levaduras.
Países PCT: Austria, Bélgica, Suiza, Alemania, Dinamarca, España, Francia, Reino Unido, Grecia, Italia, Liechtensein, Luxemburgo, Países Bajos, Suecia, Mónaco, Portugal, Irlanda, Eslovenia, Finlandia, Rumania, Chipre, Lituania, Letonia, Ex República Yugoslava de Macedonia, Albania.
PDF original: ES-2358733_T3.pdf



Fragmento de la descripción:
La presente invención se refiere a composiciones de vacunas para proteger los peces contra el virus de necrosis pancreática infecciosa.
Antecedentes
El virus de necrosis pancreática infecciosa (IPNV) es un virus de ARN de doble cadena bisegmentado icosaédrico sin envoltura y provoca una enfermedad altamente contagiosa del salmón joven criado en piscifactoría [1,2], así como otros peces criados en granjas [3]. Esta enfermedad, una vez establecida, es muy difícil de erradicar del pez infectado y es muy necesario el desarrollo de una vacuna segura, eficaz y barata contra el IPNC. La irrupción de dicha enfermedad provoca daños económicos muy serios a los criaderos de peces.
El IPNV presenta una proteína estructural principal, VP2 (52kD), y otras tres proteínas, VP1 (90kD), VP3 (30kD) y VP4 (28kD) [4-7]. VP1 es una polimerasa viral putativa [8], mientras que la VP2 es la proteína principal de la cápside exterior [9]. VP3 es otra proteína de la cápside y VP4 se ha considerado como una forma separada de VP3 durante la maduración viral [9,10].
Las secuencias de nucleótidos y aminoácidos para VP2 y VP3 son bien conocidas en la técnica, véase por ejemplo, Havarstein et al (1990) "Sequence of the large double-stranded RNA segment of the N1 strain of the infectious pancreatic necrosis virus: a comparison with other Birnaviridae" J Gen Virol 71: 299-308.
También se sabe que existen tres variaciones de cepa, véase, por ejemplo, Pryde et al, 1992 Archives of Virology 129, 287-293.
Entre las vacunas disponibles actualmente contra el IPNV se incluyen el virus IPN desactivado, que se desarrolla en líneas celulares de peces y a continuación se desactiva utilizando un desactivante viral estándar. Sin embargo, la producción a gran escala de vacunas a partir de líneas celulares de peces puede ser costosa. Existe también el riesgo de inversión del virus a la forma virulenta.
WO94/04565 de Proteus House se refiere a un péptido sintético que tiene por lo menos una propiedad antigénica de una cepa de IPNV, donde el péptido consiste sustancialmente en una secuencia de aminoácidos seleccionada. Los péptidos se sintetizaron utilizando química en fase sólida.
WO 99/50419 (University of Maryland) se refiere a métodos para la preparación de un virus de necrosis pancreática infecciosa no patogénico, que comprenden etapas que conducen a IPNV deficiente en la proteína NS. Estos viriones estaban destinados al uso como vacunas vivas atenuadas.
Además, en diversos documentos se describen vacunas de proteínas recombinantes.
Christie (1997), Fish Vaccinology, Dev Biol Stand. Basel, Karger, vol 90, pp 191-199, eds Gudding et al) da a conocer una vacuna producida en e. coli que contiene la proteína recombinante VP2.
US 5165925 (University of Oregon) describe métodos para inmunizar el pez contra los serotipos VR-299 y SP de IPNV, donde la vacuna consiste esencialmente en un polipéptido del segmento viral A e incluye por lo menos VP2 expresado en un huésped bacteriano.
Además, la patente coreana KR100227102 también se refiere a antígenos de IPNV y ADNc relacionado y vacunas.
Labus et al (2001) Fish & Shellfish Immunology 11: 203-216, que se publicó después de las fechas de prioridad reivindicadas aquí, compara la antigenicidad de las proteínas estructurales de IPNV cuando se preparan en diferentes sistemas huésped que incluyen bacterias y levadura. Una de estas proteínas era VP2 truncada que se dice que comprende los residuos 147-307 de VP2. Se cree que el plegamiento más verosímil aparece en células de CHSE (Embrión de Salmón de Chinook) y CHO (Ovario de Hámster Chino).
Frost et al "Analysis of the antibody response in Atlantic salmon against recombinant VP2 of infectious pancreatic necrosis virus (IPNV)" Fish & Shellfish Immunology, Volumen 8, Fascículo 6, Agosto 1998, Páginas 447456, describe una respuesta inmunológica humoral específica de IPNV en salmón “pre-smolt” del Atlántico y en conejos inmunizados con VP2 recombinante purificada expresada en E. coli.
A pesar de los documentos anteriores, existe una necesidad actual para nuevas preparaciones de vacunas que sean eficaces contra el IPNV.
Descripción de la invención
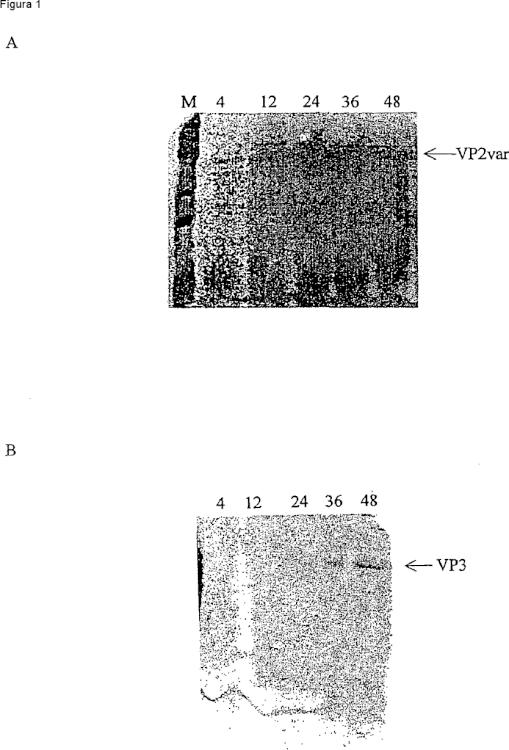
Los presentes inventores han clonado y expresado antígenos de IPNV en la cepa de levadura Pichia pastoris. Estas proteínas recombinantes expresadas se utilizaron a continuación como una preparación de vacuna en salmón del Atlántico (Salmo salar). Tal como se muestra en los ejemplos, dichas preparaciones de vacunas parecen ser altamente eficaces. Sorprendentemente, tal como se muestra en los ejemplos de la presente invención, se cree que pueden ser considerablemente más eficaces que las preparaciones disponibles de bacterias.
En otros aspectos de la presente invención tal como se define en las reivindicaciones, también se dan a conocer combinaciones específicas de antígenos eficaces, particularmente vacunas bivalentes, (por ejemplo, VP3 y una proteína VP2, referida en general en la presente invención como VP2var), ya que son fusiones de éstos y métodos de producción y utilización de las mismos.
Las vacunas preferidas son tal como se definen en las reivindicaciones y consisten esencialmente en polipéptidos VP3 y VP2var y son capaces de inducir inmunidad en peces a la infección posterior por el IPNV, habiéndose producido dichos polipéptidos en un huésped de levadura por un vector de expresión compatible con el huésped, los vectores de expresión que incluyen una secuencia de ADN insertada de ADN viral de IPNV que codifica el polipéptido de IPNV en la vacuna.
En las reivindicaciones se indican varios aspectos y realizaciones de la presente invención. La invención se describirá a continuación con más detalle.
En un aspecto de la presente invención se da a conocer un proceso para producir una composición de vacuna bivalente tal como se define en la reivindicación 1, por ejemplo, para utilizar en salmón del Atlántico (Salmo salar), cuyo proceso comprende expresar un polipéptido que codifica una proteína de IPNV (por ejemplo, de la cepa de IPNV Sp) en una cepa de levadura (por ejemplo, Pichia pastoris, preferiblemente P. pastoris GS115) y formular el polipéptido como vacuna.
En la presente invención se describen procesos que comprenden las etapas de:
(i) aislar una o más regiones codificantes de IPNV,
(ii) preparar un plásmido recombinante que contiene las regiones codificantes de IPNV (es decir, una adecuada para la expresión en líneas celulares de levadura, cuyo plásmido codifica uno o más polipéptidos de IPNV)
(iii) preparar líneas celulares de levadura que expresan los polipéptidos de IPNV (por ejemplo, mediante electroporación, opcionalmente plásmidos separados en células huésped separadas),
(iv) cribar la expresión de los polipéptidos de IPNV en las líneas celulares,
(v) inmunizar uno o más peces con líneas celulares que expresan los polipéptidos de IPNV (o preparaciones de los polipéptidos a partir de los mismos).
Las proteínas de IPNV preferidas, combinaciones de proteínas, y fusiones se describen con más detalle a continuación. Las más preferidas con VP3 y VP2var (una región más pequeña de toda la proteína VP2 que muestra el grado más elevado de variación de aminoácidos entre cadenas).
Preferiblemente, el método comprende dos proteínas de IPNV diferentes en Pichia pastoris, tal como para producir una vacuna bivalente.
En general, a la luz de la descripción de la presente invención, los expertos en la materia serán capaces de construir vectores apropiados y diseñar protocolos para la expresión recombinante de genes. Se pueden elegir o construir vectores adecuados, que contienen secuencias reguladoras apropiadas, incluyendo secuencias promotoras (ver a continuación), fragmentos terminadores, secuencias de poliadenilación, secuencias potenciadoras, genes marcadores, secuencias señal y otras secuencias apropiadas. Para una mayor evidencia del conocimiento general véase, por ejemplo, Molecular Cloning: a Laboratory Manual: 2nd edition, Sambrook et al, 1989, Cold Spring Harbor Laboratory Press (o ediciones posteriores de este trabajo). Muchas técnicas conocidas y protocolos para la manipulación de ácido nucleico, por ejemplo, en la... [Seguir leyendo]
Reivindicaciones:
1. Proceso para la producción de una vacuna bivalente para la utilización contra el virus de la necrosis pancreática infecciosa (IPNV) en peces, caracterizado porque comprende:
(i) cultivar células huésped de levadura que expresan dos polipéptidos diferentes de IPNV que son respectivamente:
(a) un polipéptido VP3 de IPNV o un fragmento del mismo que comprende una secuencia que tiene por lo menos un 90% de identidad en la secuencia con la secuencia del Anexo B o el Anexo D
(b) un polipéptido VP2 de IPNV o un fragmento del mismo que comprende una secuencia que tiene por lo menos un 90% de identidad en la secuencia con la secuencia del Anexo A o el Anexo C,
en el que en cada caso el polipéptido o el fragmento es capaz de estimular la producción de anticuerpos que se unen a IPNV,
y en el que los polipéptidos de IPNV expresados se secretan de las células huésped en el sobrenadante de cultivo,
(ii) formular los polipéptidos de IPNV como una vacuna.
2. Proceso según la reivindicación 1, en el que la célula huésped de levadura es Pichia Pastoris.
3. Proceso según la reivindicación 1, en el que las células huésped se separan del sobrenadante, y el sobrenadante que contiene los polipéptidos de IPNV secretados se formula como la vacuna.
4. Proceso según la reivindicación 1 o la reivindicación 3, en el que los polipéptidos de IPNV se secretan con una secuencia señal que es la secuencia señal del factor de apareamiento de levadura.
5. Proceso según cualquiera de las reivindicaciones anteriores, en el que la vacuna se formula mediante dilución con PBS o la adición de adyuvante o una combinación de los mismos.
6. Proceso según cualquiera de las reivindicaciones 1 a 5, que comprende las etapas de:
(i) aislar una región codificante de ácidos nucleicos de IPNV que codifica:
(a) un polipéptido VP3 de IPNV o un fragmento del mismo que comprende una secuencia que tiene por lo menos un 90% de identidad en la secuencia con la secuencia del Anexo B o el Anexo D, o
(b) un polipéptido VP2 de IPNV o un fragmento del mismo que comprende una secuencia que tiene por lo menos un 90% de identidad en la secuencia con la secuencia del Anexo A o el Anexo C,
en el que en cada caso el polipéptido o el fragmento es capaz de estimular la producción de anticuerpos que se unen a IPNV,
(ii) preparar un ADN plasmídico recombinante que contiene la región codificante de IPNV
(iii) preparar líneas celulares de levadura que expresan el polipéptido de IPNV,
(iv) cribar la expresión del polipéptido de IPNV en las líneas celulares.
7. Proceso según cualquiera de las reivindicaciones 1 a 6, en el que los polipéptidos de IPNV son codificados por múltiples copias de la región codificante de genes de IPNV unidos para formar un único marco de lectura abierto con un único codón de iniciación y de terminación para producir un antígeno de IPNV multivalente.
8. Proceso según cualquiera de las reivindicaciones 1 a 6 en el que los polipéptidos de IPNV se expresan en diferentes células huésped de levadura.
9. Proceso según cualquiera de las reivindicaciones 1 a 8 en el que cada uno de los polipéptidos de IPNV está
presente como dos o más copias de antígeno fusionadas en la orientación correcta para la expresión como un único polipéptido, de manera que se producen antígenos de IPNV multiméricos.
10. Proceso según cualquiera de las reivindicaciones 1 a 6, en el que los polipéptidos de IPNV son VP3 que presentan la secuencia del Anexo B o el anexo D y VP2 que presenta la secuencia del Anexo A o el Anexo C.
11. Proceso según la reivindicación 10 en el que el ácido nucleico que codifica las regiones codificantes de IPNV se aísla utilizando las parejas de cebadores directo e inverso específicos para VP3 o VP2, en el que las parejas de cebadores se seleccionan entre:
CTA ACA ACG GAA TTC ATG GAC AAA GTC VP2 cebador directo (SEC ID. NO. 1) GAAGCTGCAGAGGACAAAGTCAAC VP2var directo (SEC ID. NO. 2) CGT TGC CGA TTG GCG GCC GCT GGT TGA TC VP2 cebador inverso (SEC ID. NO. 3) ACCACTGCAGTCACAGTCCTGAATC VP2 directo (SEC ID. NO. 4) GAGCGCGGCCGCCGCAATTCCGTTCCCTG VP2 inverso (SEC ID. NO. 5) CCT GGG ACT GCA GAT GGC ATC AAA TG VP3 cebador directo (SEC ID. NO. 6) GTT ACA CCG CGG CCG CGT CTC CGC TGG G VP3 cebador inverso (SEC ID. NO. 7) GACGCTGCAGTGCAACGCCTCCTG VP3 directo (SEC ID. NO. 8) GTGCAGCGGCCGCCGGGGGTCGTCGTTTCATC VP3inverso (SEC ID. NO. 9) GACGCTGCAGTGCAACGCCTCCTG VP3 directo (SEC ID. NO. 10) CTCTCTAGAGTCTCCGCTGGG VP3 inverso (SEC ID. NO. 11) CCCTCAGAGTCACAGTCCTG VP2 directo (SEC ID. NO. 12) GAGCGCGGCCGCCGCAATTCCGTTCCCTG VP2 inverso (SEC ID. NO. 13)
12. Proceso según cualquiera de las reivindicaciones 1 a 11, en el que el polipéptido de IPNV o cada uno de ellos se une a un polipéptido enlazador adaptado para unir el polipéptido a una micropartícula.
13. Proceso según la reivindicación 12 que comprende además la etapa de formular el polipéptido de IPNV o cada uno de ellos para hacerlo adecuado para la administración mediante la incorporación por inmersión o por vía oral en el alimento de los peces por empaquetamiento en un sistema de liberación de micropartículas seleccionado entre: partícula de látex; microesferas de poli(láctido-co-glicólido); minipélets de atelocolágeno; bentonita; o cerámicas de apatita porosas.
14. Proceso según cualquiera de las reivindicaciones anteriores que comprende además la etapa de combinar la vacuna con otros antígenos bacterianos para controlar otras enfermedades.
15. Vector de expresión de levadura caracterizado porque el vector codifica dos polipéptidos diferentes de IPNV que son:
(a) un polipéptido VP3 de IPNV o un fragmento del mismo que comprende una secuencia que tiene por lo menos un 90% de identidad en la secuencia con la secuencia del Anexo B o el Anexo D
(b) un polipéptido VP2 de IPNV o un fragmento del mismo que comprende una secuencia que tiene por lo menos un 90% de identidad en la secuencia con la secuencia del Anexo A o el Anexo C,
en cada caso fusionado a una secuencia señal de secreción, y en el que en cada caso el polipéptido o fragmento es capaz de estimular la producción de anticuerpos que
se unen a IPNV.
16. Célula huésped de levadura que contiene o es transformada con el vector de la reivindicación 15.
17. Vacuna bivalente para utilizar contra el IPNV en peces, cuya vacuna comprende sobrenadante de una célula huésped de levadura que comprende dos polipéptidos diferentes de IPNV que son respectivamente:
(a) un polipéptido VP3 de IPNV o un fragmento del mismo que comprende una secuencia que tiene por lo menos un 90% de identidad en la secuencia con la secuencia del Anexo B o el Anexo D
(b) un polipéptido VP2 de IPNV o un fragmento del mismo que comprende una secuencia que tiene por lo menos un 90% de identidad en la secuencia con la secuencia del Anexo A o el Anexo C,
en la que en cada caso el polipéptido o fragmento es capaz de estimular la producción de anticuerpos que se unen a IPNV.
18. Vacuna según la reivindicación 17 caracterizada porque consiste esencialmente en los polipéptidos de IPNV VP3 que tiene la secuencia del Anexo B o el Anexo D y VP2 que tiene la secuencia del Anexo A o el Anexo C.
19. Vacuna según la reivindicación 17, caracterizada porque consiste esencialmente en los polipéptidos de IPNV VP3 que tiene la secuencia del Anexo B o el Anexo D y VP2 que tiene la secuencia del Anexo A o el Anexo C, en cada caso fusionado a una secuencial señal de secreción de levadura.
20. Vacuna según la reivindicación 18 o la reivindicación 19, en la que las secuencias de VP3 y VP2 se muestran en el Anexo B y el Anexo A.
21. Vacuna según la reivindicación 18 o la reivindicación 19, en la que las secuencias de VP3 y VP2 se muestran en el Anexo D y el Anexo C.
22. Vacuna según la reivindicación 18, en la que las secuencias de VP3 y VP2 se muestran en el Anexo E.
23. Vacuna según cualquiera de las reivindicaciones 17 a 22, que comprende un diluyente o adyuvante farmacológicamente aceptable o una combinación de éstos.
24. Vacuna según la reivindicación 23, que se selecciona entre: una suspensión acuosa para su uso como vacuna por inmersión; una vacuna oral que comprende aceite de pescado y un portador de lecitina.
25. Composición de vacuna que comprende una vacuna según cualquiera de las reivindicaciones 18 a 24 y otros antígenos bacterianos utilizados para controlar otras enfermedades.
26. Composición de vacuna según la reivindicación 25, en la que los antígenos para otras enfermedades de peces derivan de Aeromonas salmonicida y\o son uno o más antígenos de Vibrio derivados de cualquiera entre V.anguillarum, V. salmonicida y V. viscosus.
27. Vacuna o composición de vacuna según cualquiera de las reivindicaciones 18 a 26 para su uso en un método de tratamiento terapéutico, o profilaxis, de IPNV en un pez, cuyo método de tratamiento terapéutico o profilaxis de IPNV comprende administrar una dosis de la vacuna de IPNV a un pez.
28. Vacuna según la reivindicación 27 en la que el tratamiento o la profilaxis es contra una cepa del serotipo Sp de IPNV.
Patentes similares o relacionadas:
Partícula quimérica vírica del virus de la patata x y uso de la misma para el diagnóstico in vitro del síndrome de Sjögren, del 7 de Agosto de 2019, de ENEA - Agenzia Nazionale Per Le Nuove Tecnologie, L'Energia e Lo Sviluppo Economico Sostenibile: Una proteína de fusión que comprende o que consiste en: - una porción amino-terminal que consiste en una secuencia peptídica que comprende o que […]
Vacuna con protección cruzada para el virus del síndrome respiratorio y reproductivo porcino, del 5 de Junio de 2019, de UNIVERSITEIT GENT: Una vacuna contra PRRSV, comprendiendo dicha vacuna una cepa completa del PRRSV de tipo 1 inactivada o atenuada, en la que el genoma de dicha cepa del PRRSV de tipo 1 […]
Vectores de transferencia de gen lentivírico y sus aplicaciones medicinales, del 11 de Abril de 2019, de INSTITUT PASTEUR: Una combinación de compuestos para su uso en el tratamiento terapéutico o profiláctico de una infección por un Virus de la Inmunodeficiencia en donde los […]
Identificación de los dominios inmunosupresores en las proteínas de fusión de los virus de ARN con envoltura, del 30 de Enero de 2019, de iSD Immunotech ApS: Un método para identificar un dominio inmunosupresor en la proteína de fusión de un virus de ARN con envoltura que tiene una membrana lipídica, comprendiendo […]
PROTEÍNA QUIMÉRICA PARA LA PREVENCIÓN Y EL DIAGNÓSTICO DEL SÍNDROME RESPIRATORIO Y REPRODUCTIVO PORCINO (PRSS), del 3 de Enero de 2019, de CENTRO DE INVESTIGACIÓN Y ASISTENCIA EN TECNOLOGÍA Y DISEÑO DEL ESTADO DE JALISCO A.C: La presente invención se refiere a una proteína quimérica conformada por secuencias cortas de algunas de algunas de las proteínas estructurales del virus […]
Compuestos peptídicos para regular el sistema del complemento, del 5 de Septiembre de 2018, de EASTERN VIRGINIA MEDICAL SCHOOL: Una composición farmacéutica que comprende una cantidad terapéuticamente efectiva de un péptido sintético que comprende la secuencia de aminoácidos de la […]
Partículas similivíricas que comprenden secuencias de aminoácidos de la cápside compuestas para reactividad cruzada potenciada, del 28 de Febrero de 2018, de Takeda Vaccines, Inc: Partícula similivírica que comprende al menos un polipéptido que tiene una secuencia de aminoácidos compuesta, en la que la secuencia de aminoácidos compuesta […]
Proteínas de fusión quiméricas y partículas similares a virus de VP2 de Birnavirus, del 20 de Septiembre de 2017, de Chimera Pharma S.l.u: Una proteína de fusión, capaz de formar una partícula similar a virus, que consiste en la incorporación en localizaciones distintas del extremo N o […]