Aptámeros terapéuticos útiles en el tratamiento de trastornos relacionados con complemento.
Un conjugado de aptámero/PEG que tiene la estructura expuesta a continuación:
**Fórmula**
donde,
"'" indica un enlazador
Aptámero ≥
fCmGfCfCGfCmGmGfUfCfUfCmAmGmGfCGfCfUmGmAmGfUfCfUmGmAmGfUfUfUAfCfCfUmGfCmG-3T,en la que fC y fU ≥ nucleótidos 2'-flúor, y mG y mA ≥ nucleótidos 2'-OMe y todos los demás nucleótidos son 2'-OH.
Tipo: Patente Internacional (Tratado de Cooperación de Patentes). Resumen de patente/invención. Número de Solicitud: PCT/US2005/004606.
Solicitante: Archemix LLC.
Nacionalidad solicitante: Estados Unidos de América.
Dirección: 601 Montgomery Street, Suite 2020 San Francisco, CA 94111 ESTADOS UNIDOS DE AMERICA.
Inventor/es: WILSON, CHARLES, KURZ,MARKUS, DIENER,John, EPSTEIN,David, BENEDICT,CLAUDE, GRATE,DILARA, KEENE,SARA CHESWORTH, KURZ,JEFFREY, MCCAULEY,THOMAS GREEN, ROTTMAN,JAMES, THOMPSON,KRISTIN, ZOLTOSKI,ANNA J.
Fecha de Publicación: .
Clasificación Internacional de Patentes:
- C12N15/115 QUIMICA; METALURGIA. › C12 BIOQUIMICA; CERVEZA; BEBIDAS ALCOHOLICAS; VINO; VINAGRE; MICROBIOLOGIA; ENZIMOLOGIA; TECNICAS DE MUTACION O DE GENETICA. › C12N MICROORGANISMOS O ENZIMAS; COMPOSICIONES QUE LOS CONTIENEN; PROPAGACION, CULTIVO O CONSERVACION DE MICROORGANISMOS; TECNICAS DE MUTACION O DE INGENIERIA GENETICA; MEDIOS DE CULTIVO (medios para ensayos microbiológicos C12Q 1/00). › C12N 15/00 Técnicas de mutación o de ingeniería genética; ADN o ARN relacionado con la ingeniería genética, vectores, p. ej. plásmidos, o su aislamiento, su preparación o su purificación; Utilización de huéspedes para ello (mutantes o microorganismos modificados por ingeniería genética C12N 1/00, C12N 5/00, C12N 7/00; nuevas plantas en sí A01H; reproducción de plantas por técnicas de cultivo de tejidos A01H 4/00; nuevas razas animales en sí A01K 67/00; utilización de preparaciones medicinales que contienen material genético que es introducido en células del cuerpo humano para tratar enfermedades genéticas, terapia génica A61K 48/00; péptidos en general C07K). › Aptámeros, p.ej. ácidos nucleicos que unen una molécula diana específicamente y con alta afinidad sin hibridar entre ellos.
PDF original: ES-2429442_T3.pdf
Fragmento de la descripción:
Aptámeros terapéuticos útiles en el tratamiento de trastornos relacionados con complemento
CAMPO DE LA INVENCIÓN
La invención se refiere generalmente al campo de los ácidos nucleicos y más particularmente a aptámeros que pueden unirse a la proteína C5 del sistema de complemento, útiles como agentes terapéuticos y de diagnóstico en trastornos cardiacos, inflamatorios y autoinmunes relacionados con el complemento, lesión por reperfusión isquémica y/o otras enfermedades o trastornos en los que está implicada la activación del complemento mediada por C5. La invención se refiere además a materiales y a procedimientos para la administración de aptámeros que pueden unirse a la proteína del sistema del complemento C5.
ANTECEDENTES DE LA INVENCIÓN
Los aptámeros son moléculas de ácido nucleico que tienen afinidad de unión específica a moléculas a través de interacciones distintas del apareamiento de bases de Watson-Crick clásico.
Los aptámeros, al igual que los péptidos generados por expresión en fago o anticuerpos monoclonales ("mAbs") , pueden unirse específicamente a dianas seleccionadas y modular la actividad de la diana, por ejemplo, mediante la unión de aptámeros puede bloquearse el funcionamiento de la capacidad de su diana. Descubiertos por un procedimiento de selección in vitro de conjuntos de oligonucleótidos de secuencias al azar, se han generado aptámeros para más de 100 proteínas que incluyen factores de crecimiento, factores de transcripción, enzimas, inmunoglobulinas y receptores. Un aptámero típico tiene 10-15 kDa de tamaño (30-45 nucleótidos) , se une a su diana con afinidad subnanomolar y discrimina a dianas estrechamente relacionadas (por ejemplo, los aptámeros no se unirán normalmente a otras proteínas de la misma familia de genes) . Una serie de estudios estructurales ha mostrado que los aptámeros pueden usar los mismos tipos de interacciones de unión (por ejemplo, enlaces de hidrógeno, complementariedades electrostáticas, contactos hidrófobos, exclusión estérica) que accionan la afinidad y la especificidad en inmunocomplejos.
Los aptámeros tienen varias características deseables para su uso como agentes terapéuticos y de diagnóstico que incluyen alta especificidad y afinidad, eficacia biológica y excelentes propiedades farmacocinéticas. Además, ofrecen ventajas competitivas específicas con respecto a anticuerpos y otros agentes biológicos proteicos, por ejemplo:
1) Velocidad y control. Los aptámeros se producen por un procedimiento completamente in vitro que permite la rápida generación de cabezas de serie iniciales, que incluyen cabezas de serie terapéuticas. La selección in vitro permite que la especificidad y la afinidad del aptámero se controle exhaustivamente y permite la generación de cabezas de serie, incluyendo cabezas de serie contra dianas tanto tóxicas como no inmunogénicas.
2) Toxicidad e inmunogenicidad. Los aptámeros como clase han demostrado poca o ninguna toxicidad o inmunogenicidad. En una dosificación crónica de ratas o marmotas con altos niveles de aptámero (10 mg/kg al día durante 90 días) no se observó ninguna toxicidad por ninguna medida clínica, cellar o bioquímica. Mientras que la eficacia de muchos anticuerpos monoclonales puede estar gravemente limitada por la respuesta inmunitaria a los 45 propios anticuerpos, es extremadamente difícil provocar anticuerpos dirigidos contra aptámeros, lo más probablemente debido a que los aptámeros no pueden presentarse por linfocitos T mediante el MHC y la respuesta inmunitaria está generalmente entrenada para no reconocer fragmentos de ácido nucleico.
3) Administración. Mientras que la mayoría de los agentes terapéuticos de anticuerpos actualmente 50 aprobados se administran por infusión intravenosa (normalmente durante 2-4 horas) , los aptámeros pueden administrarse por inyección subcutánea (la biodisponibilidad del aptámero por administración subcutánea es >80% en estudios en mono (Tucker y col., J. Chromatography B. 732: 203-212, 1999) ) . Con buena solubilidad (>150 mg/ml) y peso molecular comparativamente bajo (aptámero: 10-50 kDa; anticuerpo: 150 kDa) , una dosis semanal de aptámero puede administrarse por inyección en un volumen inferior a 0, 5 ml. Además, el pequeño tamaño de los 55 aptámeros permite que penetren en el área de limitaciones conformacionales que no permite que penetren anticuerpos o fragmentos de anticuerpos, que presenta todavía otra ventaja de los agentes terapéuticos basados en aptámeros o profilaxis.
4) Escalabilidad y coste. Los aptámeros terapéuticos se sintetizan químicamente y por consiguiente pueden escalarse fácilmente según se necesite para cumplir la demanda de producción. Mientras que las dificultades en el escalado de la producción están limitando actualmente la disponibilidad de algunos agentes biológicos y el coste de capital de una planta de producción de proteínas a gran escala es enorme, un único sintetizador de oligonucleótidos a gran escala puede producir más de 100 kg/año y requiere una inversión inicial relativamente modesta. El coste actual de los artículos para la síntesis de aptámeros a la escala de kilogramo se estima en 500 $/g, comparable al de anticuerpos altamente optimizados. Se esperan mejoras continuas en el desarrollo de procedimientos para reducir el coste de los artículos a <100 $/g en cinco años.
5) Estabilidad. Los aptámeros terapéuticos son químicamente consistentes. Están intrínsecamente adaptados para recuperar la actividad tras la exposición a factores tales como calor y desnaturalizantes y pueden almacenarse durante periodos prolongados (>1 año) a temperatura ambiente como polvos liofilizados.
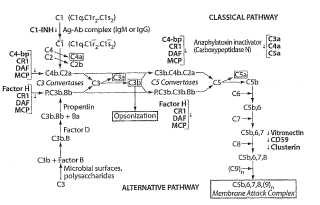
El Sistema del Complemento [0010] El sistema del complemento comprende un conjunto de al menos 20 proteínas del plasma y de membrana, que actúan juntas en un sistema de cascada regulado para atacar las formas extracelulares de los patógenos (por ejemplo, bacterias) . El sistema del complemento incluye dos cascadas de activación enzimática distintas, las vías clásica y alternativa (figura 1) , y una vía no enzimática conocida como la vía de ataque a membrana.
La primera cascada activada enzimáticamente, conocida como la vía clásica, comprende varios componentes, C1, C4, C2, C3 y C5 (enumerados por orden en la vía) . El inicio de la vía clásica del sistema del complemento ocurre después de la unión y la activación del primer componente del complemento (C1) tanto mediante los activadores inmunes como los no inmunes. C1 comprende un complejo dependiente del calcio de los componentes C1q, C1r y C1s, y se activa a través de la unión del componente C1q. C1q contiene seis subunidades idénticas, y cada subunidad comprende tres cadenas (las cadenas A, B y C) . Cada cadena tiene una región superior globular, que está conectada a una cola similar al colágeno. La unión y activación de C1q por los inmunocomplejos tiene lugar a través de la región del grupo superior de C1q. Numerosos activadores de C1q que no son de anticuerpo, incluyendo proteínas, lípidos y ácidos nucleicos, se unen a y activan C1q a través de un sitio distinto en la región del tallo similar al colágeno. Después, el complejo C1qrs cataliza la activación de los componentes del
complemento C4 y C2, formando el complejo C4bC2a, que funciona como una convertasa de C3.
La segunda cascada activada enzimáticamente, conocida como la vía alternativa, es una ruta rápida, independiente del anticuerpo para la activación y amplificación del sistema del complemento. La vía alternativa comprende varios componentes, C3, Factor B y Factor D (enumerado por orden en la vía) . La activación de la vía alternativa ocurre cuando C3b, una forma de escisión proteolítica de C3, se une a un agente superficial activador, tal como una bacteria. Entonces, el Factor B se une a C3b, y se escinde por el Factor D para producir la enzima activa, Ba. Después, la enzima Ba escinde más cantidad de C3 para generar más C3b, produciendo un extenso depósito de complejos C3b-Ba sobre la superficie activadora.
Así, tanto la vía clásica como la alternativa del complemento producen convertasas de C3 que dividen el factor C3 en C3a y C3b. En este punto, ambas convertasas de C3 se montan además en las convertasas de C5 (C4b2a3b y C3b3bBb) . Estos complejos escinden posteriormente el componente C5 del complemento C5 en dos componentes: el polipéptido C5a (9 kDa) y el polipéptido C5b (170 kDa) . El polipéptido C5a se une a un receptor acoplado a la proteína G 7 transmembrana, que se asoció originalmente con los leucocitos y ahora se sabe que se 45 expresa en una variedad de tejidos, incluyendo los hepatocitos y las neuronas. La... [Seguir leyendo]
Reivindicaciones:
1. Un conjugado de aptámero/PEG que tiene la estructura expuesta a continuación:
donde,
"'" indica un enlazador 10 Aptámero =
fCmGfCfCGfCmGmGfUfCfUfCmAmGmGfCGfCfUmGmAmGfUfCfUmGmAmGfUfUfUAfCfCfUmGfCmG-3T,
en la que fC y fU = nucleótido.
2. flúor, y mG y mA = nucleótido.
2. OMe y todos los demás nucleótidos so.
2. OH. 15
2. El conjugado de aptámero/PEG de la reivindicación 1, en el que el enlazador es un enlazador alquilo que comprende 6 grupos CH2 consecutivos, un enlazador alquilo que comprende entre 2 a 18 grupos CH2 consecutivos, un enlazador alquilo que comprende entre 2 a 12 grupos CH2 consecutivos, o un enlazador alquilo que comprende entre 3 a 6 grupos CH2 consecutivos.
3. El conjugado de aptámero/PEG de la reivindicación 2, en el que el conjugado de aptámero/PEG tiene la estructura que se expone a continuación:
donde Aptámero =
fCmGfCfCGfCmGmGfUfCaJfCmAmGmGfCGfCfUmGrnAmGfUfCfUmGmAmGfUfUfUAfCfCfUmGfCmG-3T,
donde fC y fU = nucleótido.
2. flúor, y mG y mA= nucleótido.
2. OMe y todos los demás nucleótidos so.
2. OH.
4. Una composición que comprende una cantidad terapéuticamente eficaz del conjugado de aptámero/PEG de una cualquiera de las reivindicaciones 1 a 3, o una sal del mismo, y un vehículo o diluyente farmacéuticamente aceptable.
5. Uso del conjugado de aptámero/PEG de uno cualquiera de las reivindicaciones 1 a 3 en la fabricación de un medicamento para el tratamiento, prevención o mejora de una enfermedad mediada por la proteína del complemento C5, C5a y/o C5b-9 en un mamífero.
6. El conjugado de aptámero/PEG de una cualquiera de las reivindicaciones 1 a 3 para su uso en un procedimiento para el tratamiento, prevención o mejora de una enfermedad mediada por la proteína del complemento C5, C5a y/o C5b-9 en un mamífero.
7. El uso de la reivindicación 5, o el conjugado de aptámero/PEG para su uso en un procedimiento para 45 el tratamiento, prevención o mejora de una enfermedad mediada por la proteína del complemento C5, C5a y/o C5b-9 en un mamífero de la reivindicación 6, en el que el mamífero es un ser humano.
8. El uso de la reivindicación 5, o el conjugado de aptámero/PEG para su uso en un procedimiento para
el tratamiento, prevención o mejora de una enfermedad mediada por la proteína del complemento C5, C5a y/o C5b-9 en un mamífero de la reivindicación 6, en el que la enfermedad es una enfermedad isquémica aguda, una enfermedad inflamatoria aguda, o una enfermedad inflamatoria crónica o mediada por el sistema inmune.
9. El uso de la reivindicación 5, o el conjugado de aptámero/PEG para su uso en un procedimiento para el tratamiento, prevención o mejora de una enfermedad mediada por la proteína del complemento C5, C5a y/o C5b-9 en un mamífero de la reivindicación 6, en el que la enfermedad es infarto de miocardio, ictus, lesión por isquemia/repercusión, enfermedad infecciosa, septicemia, choque, rechazo de trasplante agudo/hiperagudo, alergia, asma, artritis reumatoide u otra enfermedad reumatológica, esclerosis múltiple u otra enfermedad neurológica, soriasis u otra enfermedad dermatológica, miastenia gravis, lupus eritematoso sistémico (LES) , rechazo de trasplante subagudo/crónico, glomerulonefritis u otra enfermedad renal.
10. El uso de la reivindicación 5, o el conjugado de aptámero/PEG para su uso en un procedimiento para el tratamiento, prevención o mejora de una enfermedad mediada por la proteína del complemento C5, C5a y/o C5b-9 en un mamífero de la reivindicación 6, en el que la enfermedad es una lesión de miocardio relacionada con cirugía de revascularización coronaria (CABG) , lesión de miocardio relacionada con angioplastia de globo, o lesión de miocardio relacionada con restenosis.
11. El uso de la reivindicación 5, o el conjugado de aptámero/PEG para su uso en un procedimiento para el tratamiento, prevención o mejora de una enfermedad mediada por la proteína del complemento C5, C5a y/o C5b-9 en un mamífero de la reivindicación 6, en el que la enfermedad que se va a tratar es una complicación mediada por la proteína del complemento C5, C5a y/o C5b-9 relacionada con una cirugía CABG.
12. El uso de la reivindicación 5, o el conjugado de aptámero/PEG para su uso en un procedimiento para el tratamiento, prevención o mejora de una enfermedad mediada por la proteína del complemento C5, C5a y/o C5b-9 en un mamífero de la reivindicación 6, en el que el conjugado de aptámero/PEG se administra peri-operativamente.
13. El uso de la reivindicación 5, o el conjugado de aptámero/PEG para su uso en un procedimiento para el tratamiento, prevención o mejora de una enfermedad mediada por la proteína del complemento C5, C5a y/o C5b-9 en un mamífero de la reivindicación 6, en el que el conjugado de aptámero/PEG se administra por vía intravenosa.
14. Un procedimiento de diagnóstico que comprende poner en contacto el conjugado de aptámero/PEG de una cualquiera de las reivindicaciones 1 a 3 con una composición que se sospecha que comprende la proteína del complemento C5, o una variante de la misma, y que detecta la presencia o ausencia de la proteína del complemento C5, o una variante de la misma.
15. El procedimiento de diagnóstico de la reivindicación 14, en el que la proteína del complemento C5, o variante de la misma, es una proteína del complemento C5 humana, o una variante de la misma.
16. Un conjugado de aptámero/PEG de acuerdo con una cualquiera de las reivindicaciones 1 a 3, para su uso como un diagnóstico in vitro.
17. Un conjugado de aptámero/PEG de acuerdo con una cualquiera de las reivindicaciones 1 a 3, para su uso como un diagnóstico in vivo.
18. Un conjugado de aptámero/PEG de acuerdo con una cualquiera de las reivindicaciones 1 a 3, para su uso en el tratamiento, prevención o mejora de una enfermedad in vivo.
Patentes similares o relacionadas:
Métodos y composiciones farmacéuticas para el tratamiento de infecciones por filovirus, del 13 de Mayo de 2020, de INSERM (INSTITUT NATIONAL DE LA SANTE ET DE LA RECHERCHE MEDICALE): Al menos un oligonucleótido que comprende la secuencia tal como se recoge en SEQ ID NO: 1 a SEQ ID NO: 15, para su uso en el tratamiento de infección […]
Agentes terapéuticos de base aptámeros útiles en el tratamiento de trastornos relacionados con complemento, del 8 de Abril de 2020, de Archemix LLC: Aptámero o una sal del mismo para usar en el tratamiento, prevención o mejora de una enfermedad mediada por una proteína de complemento C5, […]
Aptámeros de EpCAM y conjugados de los mismos, del 25 de Marzo de 2020, de Deakin University: Un conjugado de aptámeros bifuncionales que comprende: (i) la secuencia 5' -GCG CGG TAC CGC GCT AAC GGA GGT TGC GTC CGT- 3' (SEQ ID NO: 3); o […]
Viriones de virus adenoasociados con cápside variante y métodos de uso de los mismos, del 19 de Febrero de 2020, de THE REGENTS OF THE UNIVERSITY OF CALIFORNIA: Un virión de virus adenoasociado recombinante (VAAr), o una composición farmacéutica que comprende dicho virión, para su uso en un método de tratamiento […]
Nuevos ácidos nucleicos de unión a C5a, del 19 de Febrero de 2020, de APTARION biotech AG: Una molécula de ácido L-nucleico capaz de unirse a C5a humana y C5a de ratón, en donde la molécula de ácido L-nucleico comprende un tramo central de […]
Aptámero para FGF2 y uso del mismo, del 6 de Noviembre de 2019, de RIBOMIC INC: Un aptámero que se une al FGF2, que comprende una secuencia de nucleótidos representada por la fórmula siguiente (en donde el uracilo […]
Ácidos nucleicos de unión a SDF-1 y el uso de los mismos, del 6 de Noviembre de 2019, de NOXXON PHARMA AG: Una molécula de ácido nucleico L- de unión a SDF-1 para uso en terapia, en donde la terapia comprende influir en la migración de las células, de este […]
Traducción intracelular de ARN circular, del 26 de Junio de 2019, de Kruse, Robert: Vector para preparar ARNm circular, comprendiendo dicho vector los siguientes elementos operativamente conectados entre sí y dispuestos en la siguiente secuencia: a) […]