Procedimiento de preparación de raltegravir potásico amorfo.
Procedimiento de preparación de raltegravir potásico en forma amorfa,
que comprende:
a. agitar raltegravir potásico en agua;
b. eliminar el agua de la disolución obtenida en la etapa (a) para obtener un sólido;
c. suspender el sólido obtenido en la etapa (b) en un disolvente orgánico; y
d. aislar raltegravir potásico en forma amorfa,
donde el disolvente orgánico utilizado en la etapa (c) es un disolvente o una mezcla de disolventes y se seleccionan del grupo que consiste en heptano, hexano, dietil éter, ciclohexano, n-hexanol, n-octanol, 3-etil-3-pentanol, polietilenglicol, acetato de isopropilo, acetato de n-butilo, triacetato de glicerol, acetona, metil isobutilcetona, 2,4- dimetilpentanona, alfa-tetralona, metil t-butil éter, 2,2,4,4-tetrametiltetrahidrfurano, tolueno, tetralina, nitrobenceno, pxileno, sulfolano y decalina.
Tipo: Patente Internacional (Tratado de Cooperación de Patentes). Resumen de patente/invención. Número de Solicitud: PCT/IN2009/000317.
Solicitante: Hetero Research Foundation.
Nacionalidad solicitante: India.
Dirección: Plot No. B-80&81 A.P.I.E., Balanagar Hyderabad 500 018, Andhrapradesh INDIA.
Inventor/es: PARTHASARADHI REDDY,BANDI, MURALIDHARA,REDDY,DASARI, RATHNAKAR REDDY,Kura, RAJI REDDY,Rapolu, SUBASH CHANDER REDDY,kesireddy.
Fecha de Publicación: .
Clasificación Internacional de Patentes:
- C07D413/12 QUIMICA; METALURGIA. › C07 QUIMICA ORGANICA. › C07D COMPUESTOS HETEROCICLICOS (Compuestos macromoleculares C08). › C07D 413/00 Compuestos heterocíclicos que contienen dos o más heterociclos, teniendo al menos un ciclo átomos de nitrógeno y oxígeno como únicos heteroátomos del ciclo. › unidos por una cadena que contiene heteroátomos como enlaces de cadena.
PDF original: ES-2549387_T3.pdf



Fragmento de la descripción:
Procedimiento de preparación de raltegravir potásico amorfo Campo de la invención
La presente invención proporciona un procedimiento de preparación de raltegravir potásico en forma amorfa.
5 Estado de la técnica
Los inhibidores de la proteasa del virus de la inmunodeficiencia humana (VIH) llevan varios años aprobados para su uso en el tratamiento de la infección por VIH. Un inhibidor particularmente eficaz de la integrasa VIH es el N-(4- fluorobencil)-5-hidroxi-1-metil-2-(1-metil-1-{[(5-metil-1,3,4-oxadiazol-2-il)carbonil]amino}etil)-6-oxo-1,6- dihidropirimidin-4-carboxamida, también conocido como raltegravir y sus sales farmacéuticamente aceptables tales 10 como raltegravir potásico. Raltegravir se representa mediante la siguiente estructura.
Polimorfismo se define como "la capacidad de una sustancia de existir como dos o más fases cristalinas que presentan diferentes disposiciones y/o conformaciones de las moléculas en la retícula cristalina. Así, en un sentido 15 estricto, los polimorfos son diferentes formas cristalinas de la misma sustancia pura en las cuales las moléculas presentan diferentes disposiciones y/o diferentes configuraciones". Distintos polimorfos pueden diferenciarse en sus propiedades físicas como en el punto de fusión, la solubilidad, los patrones de difracción de rayos X, etc. Aunque estas diferencias desaparecen cuando se disuelve el compuesto, pueden tener una influencia apreciable en propiedades farmacéuticas relevantes de la forma sólida, como manipulación, velocidad de disolución y estabilidad. 20 Estas propiedades pueden influir significativamente en el procesado, caducidad y acogida comercial de un polimorfo. Por lo tanto, es importante investigar todas las formas sólidas de un medicamento, incluyendo todas las formas polimórficas, y determinar la estabilidad, disolución y propiedades de flujo de cada forma polimórfica. Las formas polimórficas de un compuesto pueden diferenciarse en el laboratorio mediante métodos analíticos como la difracción de rayos X (XRD), calorimetría diferencial de barrido (DSC) y espectroscopia infrarroja (IR).
25 El medio disolvente y el modo de cristalización juegan un papel muy importante en la obtención de una forma cristalina frente a otra.
Raltegravir puede existir en diferentes formas polimórficas que se diferencian entre ellas por su estabilidad, propiedades físicas, datos espectrales y métodos de preparación.
La publicación de patente W003/035077 describe 5-hidroxi-6-oxo-1,6-dihidropirimidin-4-carboxamidas N-sustituidas 30 y sus sales farmacéuticamente aceptables. La patente W003/035077 también describe procedimientos de preparación de raltegravir y compuestos relacionados. Según la patente W003/035077, raltegravir se prepara haciendo reaccionar el ácido 5-metil-1,3,4-oxadiazol-2-carboxílico con 2-(1-amino-1-metiletil)-N-(4-fluorobencil)-5- hidroxi-1-metil-6-oxo-1,6-dihidropirimidin-4-carboxamida en acetonitrilo y en presencia de trietilamina y N,N- dimetilformamida.
35 La publicación de patente US2006/12205 describe dos formas cristalinas y una forma amorfa de raltegravir potásico y procedimientos para su preparación. La publicación describe la formación de dos formas cristalinas de raltegravir potásico, que se denominaron Forma 1 cristalina anhidra y Forma 2 cristalina hidratada de la sal potásica de raltegravir.
Según la publicación '205, la Forma 1 cristalina anhidra de la sal potásica de raltegravir (caracterizada por un 40 diagrama de difracción de rayos X en polvo con picos expresados como 20 aproximadamente en 5,9; 12,5; 20,0; 20,6 y 25,6 grados y caracterizada además por un diagrama de calorimetría diferencial de barrido que muestra una única endoterma con un pico de temperatura de aproximadamente 279°C) puede prepararse mediante la cristalización de raltegravir potásico a partir de la mezcla de una disolución acuosa de una base potásica con una mezcla que comprende raltegravir, agua y alcohol para formar una disolución básica de raltegravir y el filtrado de la 45 disolución. La disolución resultante se sembró para obtener la sal potásica cristalina de raltegravir.
Según la publicación '205, la Forma 2 cristalina hidratada de la sal potásica de raltegravir (caracterizada por un diagrama de difracción de rayos X en polvo con picos expresados como 20 aproximadamente en 7,9, 13,8, 15,7, 24,5 y 31,5 grados y caracterizada además por un diagrama de calorimetría diferencial de barrido que muestra dos
O
**(Ver fórmula)**ó H3c ch3 o
endotermas anchas con picos de temperatura de aproximadamente 146°C y 239°C y una tercera endoterma estrecha con un pico de temperatura de aproximadamente 276°C) pueden prepararse mediante la cristalización de raltegravir potásico a partir de hidróxido de potasio sólido y raltegravir que se añadieron en acetona, y se aplicaron ultrasonidos a la disolución resultante durante varios minutos hasta que se formó un precipitado. A continuación, la 5 disolución obtenida se filtró hasta sequedad.
Hemos descubierto que raltegravir puede prepararse en formas cristalina y amorfa bien definidas y reproducibles.
Uno de los objetivos de la presente invención es proporcionar una forma amorfa de raltegravir potásico y un procedimiento para su preparación y composiciones farmacéuticas que lo comprenden.
También se describen una nueva forma cristalina de raltegravir potásico y un procedimiento para su preparación y 10 composiciones farmacéuticas que lo comprenden.
Sumario de la invención
Se describe un procedimiento para la preparación de raltegravir potásico en forma amorfa, que comprende la liofilización de una disolución acuosa de raltegravir potásico de -170 a -180°C para obtener raltegravir potásico en forma amorfa.
15 De acuerdo con la presente invención, se proporciona un procedimiento para la preparación de raltegravir potásico en forma amorfa, que comprende:
a) agitar raltegravir potásico en agua;
b) eliminar el agua de la disolución obtenida en la etapa (a) para obtener un sólido;
c) suspender el sólido obtenido en la etapa (b) en un disolvente orgánico; y 20 d) aislar la forma amorfa de raltegravir potásico.
También se describe una nueva forma cristalina de raltegravir potásico designada Forma H1 caracterizada por picos en el espectro de difracción de rayos X en polvo en las posiciones angulares 29 aproximadamente en 5,2; 6,9; 9,0; 13,9; 21,5 y 23,0 ± 0,2 grados.
También se describe un procedimiento para la preparación de la forma cristalina H1 de raltegravir potásico que 25 comprende:
a) proporcionar una disolución de raltegravir potásico en dimetilformamida o dimetilacetamida o en una mezcla de ambas, opcionalmente mezclada con uno o más disolventes distintos de estos;
b) separar el sólido de la disolución obtenida en la etapa (a); y
c) aislar la forma cristalina H1 de raltegravir potásico.
30 También se describe una composición farmacéutica que comprende una forma polimórfica de raltegravir potásico seleccionada entre la Forma H1 y la forma amorfa o sus mezclas; y un excipiente aceptable farmacéuticamente.
Descripción detallada de la invención
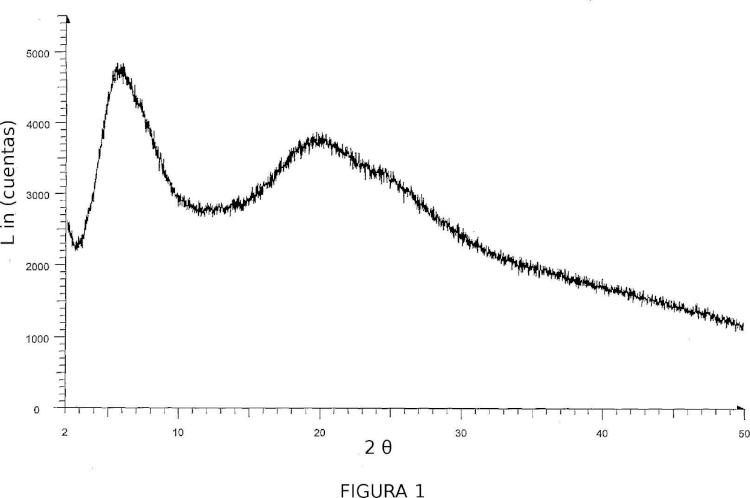
De acuerdo con uno de los aspectos de la presente invención, se proporciona una forma amorfa de raltegravir potásico. La Figura 1 muestra el diagrama de difracción de rayos X en polvo (PXRD) de la forma amorfa de 35 raltegravir potásico.
La forma amorfa de raltegravir potásico de la presente invención está caracterizada además por un termograma de calorimetría diferencial de barrido (DSC) tal como se muestra en la figura 2.
Liofilización es el término utilizado, se congela el material y a continuación se reduce la presión del medio y se añade calor suficiente para permitir que el agua congelada del material sublime directamente de la fase sólida a gas.
40 También se describe un procedimiento para la preparación de raltegravir potásico en forma amorfa, que comprende la liofilización de una disolución acuosa de raltegravir potásico a temperaturas de -170 a -180°C para obtener la forma amorfa de raltegravir potásico.
Según un aspecto de la presente invención, se proporciona un procedimiento para la preparación de la forma amorfa de raltegravir potásico, que comprende:
45 a) agitar raltegravir potásico en agua;
b) eliminar el agua de la disolución obtenida en la etapa (a) para obtener un sólido;
c) suspender el sólido obtenido en la etapa (b) en un disolvente orgánico; y
d) aislar la forma amorfa de raltegravlr potásico.
El disolvente orgánico utilizado en la etapa (c) es un disolvente o una mezcla de disolventes y se selecciona... [Seguir leyendo]
Reivindicaciones:
1. Procedimiento de preparación de raltegravir potásico en forma amorfa, que comprende: a. agitar raltegravir potásico en agua;
5 b. eliminar el agua de la disolución obtenida en la etapa (a) para obtener un sólido;
c. suspender el sólido obtenido en la etapa (b) en un disolvente orgánico; y
d. aislar raltegravir potásico en forma amorfa,
donde el disolvente orgánico utilizado en la etapa (c) es un disolvente o una mezcla de disolventes y se seleccionan del grupo que consiste en heptano, hexano, dietil éter, ciclohexano, n-hexanol, n-octanol, 3-etll-3-pentanol, 10 polietilenglicol, acetato de isopropilo, acetato de n-butilo, triacetato de glicerol, acetona, metil isobutilcetona, 2,4- dlmetilpentanona, alfa-tetralona, metil t-butil éter, 2,2,4,4-tetrametlltetrahidrfurano, tolueno, tetrallna, nitrobenceno, p- xileno, sulfolano y decalina.
2. Procedimiento según la reivindicación 1, donde el raltegravir potásico utilizado está en forma hidratada y anhidra.
Patentes similares o relacionadas:
Compuestos heterocíclicos que activan AMPK y métodos de uso de los mismos, del 29 de Julio de 2020, de RIGEL PHARMACEUTICALS, INC.: Un compuesto que es N-((cis)-1-(4-cianobencil)-3-fluoropiperidin-4-il)-6-(4-(4-metoxibenzoil)piperidin-1-carbonil)nicotinamida; N-((3S,4S)-1-(4-cianobencil)-3-fluoropiperidin-4-il)-6-(4-(4-metoxibenzoil)piperidin-1-carbonil)nicotinamida; […]
Ureas asimétricas p-sustituidas y usos médicos de las mismas, del 22 de Julio de 2020, de Helsinn Healthcare SA: Un compuesto de Fórmula I: **(Ver fórmula)** o una sal farmacéuticamente aceptable del mismo, en donde: una línea discontinua indica un enlace opcional; X es CH; […]
Terapias de combinación para el cáncer, del 22 de Julio de 2020, de MERCK SHARP & DOHME CORP: Una combinación que comprende un anticuerpo anti-PD-1 humano y un Compuesto A y un Compuesto B, en donde: el anticuerpo anti-PD-1 humano comprende […]
Derivado de 5-etiol-4-metil-pirazol-3-carboxamida que tiene actividad como agonista de TAAR, del 15 de Julio de 2020, de F. HOFFMANN-LA ROCHE AG: Un compuesto de fórmula I: **(Ver fórmula)** que es 5-etil-4-metil-N-[4-[(2S) morfolin-2-il]fenil]-1H-pirazol-3-carboxamida, o una sal de adición de ácido farmacéuticamente […]
Productos terapéuticos basados en la lantionina sintetasa 2 tipo C, del 15 de Julio de 2020, de LANDOS BIOPHARMA, INC: Un compuesto de la fórmula: **(Ver fórmula)** o una sal o éster farmacéuticamente aceptable de este, en donde: Q es piperazina-1,4-diilo; […]
Compuestos de 6-aril-4-(morfolin-4-il)-1H-piridin-2-ona útiles para el tratamiento del cáncer y la diabetes, del 1 de Julio de 2020, de Sprint Bioscience AB: Un compuesto de la fórmula (I) **(Ver fórmula)** en donde R1 es arilo o heteroarilo, dicho arilo y dicho heteroarilo son mono o bicíclicos […]
Moduladores de la indolamina 2,3-dioxigenasa, del 24 de Junio de 2020, de Glaxosmithkline Intellectual Property (No. 2) Limited: Un compuesto que tiene la estructura de Fórmula I: **(Ver fórmula)** o una sal farmacéuticamente aceptable del mismo, en la que: X es **(Ver fórmula)** […]
Compuestos de diaminopirimidilo sustituidos, composiciones de los mismos y procedimientos de tratamiento con ellos, del 17 de Junio de 2020, de SIGNAL PHARMACEUTICALS LLC: Un compuesto de fórmula (I): **(Ver fórmula)** o una sal, un tautómero, un isotopólogo o un estereoisómero farmacéuticamente aceptable […]