Método para producir células progenitoras retinianas polarizadas a partir de células madre pluripotentes y su diferenciación para dar células del epitelio pigmentario retiniano.
Método para diferenciar células madre pluripotentes para dar células progenitoras retinianas polarizadas,
que comprende las etapas:
a) cultivar colonias de células madre pluripotentes en cultivo celular tridimensional incluido en un gel proteico que comprende al menos tres proteínas seleccionadas del grupo que consiste en laminina, colágeno IV, entactina y perlecano y que comprende al menos dos, preferiblemente al menos tres, lo más preferiblemente al menos cuatro factores de crecimiento seleccionados de EGF, FGF2, NGF, PDGF, IGF-1 y TGF-beta hasta que se desarrollan quistes neurales polarizados, que contienen una única luz y consisten en células polarizadas, y
b) disociar los quistes neurales polarizados para dar células progenitoras retinianas polarizadas dispersadas.
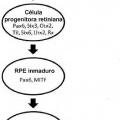
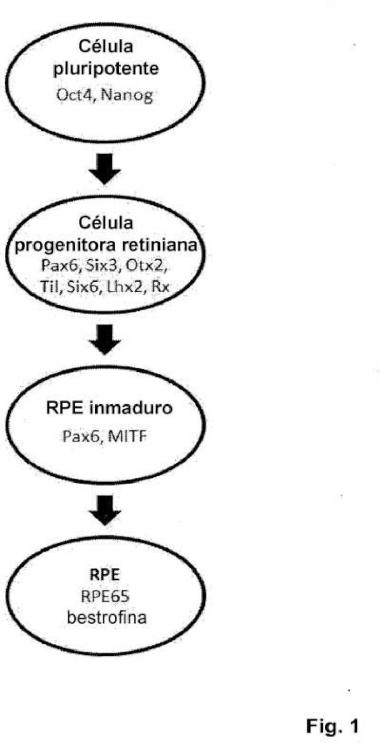
Tipo: Patente Europea. Resumen de patente/invención. Número de Solicitud: E10161354.
Solicitante: TECHNISCHE UNIVERSITAT DRESDEN.
Nacionalidad solicitante: Alemania.
Dirección: Mommsenstrasse 11 01069 Dresden ALEMANIA.
Inventor/es: TANAKA,ELLY, ZHU,YU.
Fecha de Publicación: .
Clasificación Internacional de Patentes:
- C12N5/079 QUIMICA; METALURGIA. › C12 BIOQUIMICA; CERVEZA; BEBIDAS ALCOHOLICAS; VINO; VINAGRE; MICROBIOLOGIA; ENZIMOLOGIA; TECNICAS DE MUTACION O DE GENETICA. › C12N MICROORGANISMOS O ENZIMAS; COMPOSICIONES QUE LOS CONTIENEN; PROPAGACION, CULTIVO O CONSERVACION DE MICROORGANISMOS; TECNICAS DE MUTACION O DE INGENIERIA GENETICA; MEDIOS DE CULTIVO (medios para ensayos microbiológicos C12Q 1/00). › C12N 5/00 Células no diferenciadas humanas, animales o vegetales, p. ej. líneas celulares; Tejidos; Su cultivo o conservación; Medios de cultivo para este fin (reproducción de plantas por técnicas de cultivo de tejidos A01H 4/00). › Células neurales.
PDF original: ES-2542226_T3.pdf
Fragmento de la descripción:
Método para producir células progenitoras retinianas polarizadas a partir de células madre pluripotentes y su diferenciación para dar células del epitelio pigmentario retiniano [0001] La presente invención se refiere a un método y a componentes para producir células progenitoras retinianas polarizadas (RPC) a partir de células madre pluripotentes con un rendimiento y una pureza altos. Preferiblemente, las células progenitoras retinianas polarizadas se diferencian adicionalmente con alta eficacia y velocidad para dar células del epitelio pigmentario retiniano (células del RPE) . Las células obtenidas son particularmente adecuadas para su uso en trasplante de células o en la generación de tejido para trasplante y son particularmente aplicables para sistemas de selección de sustancias que modulan la función de células del RPE y/o células progenitoras retinianas polarizadas. [0002] La retina es una capa de tejido neural sensible a la luz especializado ubicada en la superficie interior del ojo de los vertebrados. La luz que llega a la retina tras pasar por la córnea, el cristalino y el humor vítreo se transforma en una cascada de acontecimientos químicos y eléctricos que desencadenan en última instancia impulsos nerviosos. Las células que son responsables de captar la luz y convertirla en el comienzo de una cadena de procesos biológicos, un proceso que se denomina fototransducción, son neuronas especializadas que se denominan células fotorreceptoras. [0003] El epitelio pigmentario retiniano (RPE) es una monocapa polarizada de células hexagonales densamente empaquetadas en el ojo de los mamíferos que separa la retina neural del coroides. Las células en el RPE contienen gránulos pigmentarios y desempeñan un papel crucial en la fisiología de la retina formando una barrera hematorretiniana e interaccionando estrechamente con fotorreceptores en el mantenimiento de la función visual absorbiendo la energía luminosa enfocada por el cristalino sobre la retina, transportando iones, agua y productos finales metabólicos desde el espacio subretiniano hasta la sangre y captando nutrientes tales como glucosa, retinol y ácidos grasos desde la sangre y suministrando esos nutrientes a fotorreceptores. Las células del RPE también son parte del ciclo visual del retinal: dado que los fotorreceptores no pueden volver a isomerizar todo-trans-retinal, que se forma tras la absorción de fotones, para dar de nuevo 11-cis-retinal, el retinal se transporta al RPE en el que vuelve a isomerizarse para dar 11-cis-retinal y se transporta de vuelta a los fotorreceptores. [0004] Dado que muchas enfermedades oftálmicas, tales como degeneración macular (asociada a la edad) , distrofias maculares tales como enfermedad de Stargardt y similar a Stargardt, enfermedad de Best (distrofia macular viteliforme) , distrofia viteliforme del adulto o subtipos de retinitis pigmentosa, están asociadas o bien con una degeneración o bien con un deterioro de la propia retina o del RPE, hay un alto interés en encontrar maneras de producir células del RPE a partir de células madre pluripotentes humanas como fuente para el trasplante de células para el tratamiento de enfermedades degenerativas de la retina. Se ha demostrado en modelos animales que pueden lograrse el rescate de fotorreceptores y la conservación de la función visual mediante trasplante de células del RPE subretinianas (Coffey, PJ et al. Nat. Neurosci. 2002:5, 53-56; Lin, N et al. Curr. Eye Res. 1996:15, 10691077; Little CW et al. Invest. Ophthalmol. Vis. Sci. 1996:37, 204-211; Sauve, Y et al. Neuroscience 2002:114, 389401) . [0005] Durante el desarrollo embrionario temprano, los primordios retinianos se forman en la región diencefálica más rostral tal como se indica por la expresión del factor de transcripción OTX2. El neuroepitelio anterior se evagina para dar lugar a la vesícula óptica, seguido por invaginación que crea una cúpula óptica de dos capas. El campo ocular puede definirse de manera molecular debido a la expresión de una combinación de factores de transcripción tales como Pax6, Rx y Six3 (figura 1) . La capa exterior de la cúpula óptica se diferencia para dar el RPE, tal como puede discernirse en fases tempranas mediante la expresión de MiTF (factor de transcripción asociado a la microftalmía) , mientras que la capa interior se diferencia para dar la retina neural tal como puede discernirse mediante la expresión continuada de Rx y de Chx10. El desarrollo de la retina neural en capas de los vertebrados es un proceso conservado de génesis celular con el siguiente orden de nacimiento celular: células ganglionares, células horizontales, fotorreceptores de cono, células amacrinas, células bipolares, fotorreceptores de bastón y glía de Müller. [0006] Debido a la secuencia definida de etapas y los marcadores de diagnóstico disponibles para el desarrollo de RPE, se han producido células progenitoras retinianas y sus descendientes diferenciados en cultivo celular a partir de células madre pluripotentes embrionarias de ser humano, de mono y de ratón e inducidas, exponiéndolas a diferentes condiciones de cultivo. Tales métodos proporcionan un posible medio para producir células trasplantables para enfermedades degenerativas de la retina tal como se describió anteriormente y para la selección in vitro de moléculas farmacéuticas con células madre pluripotentes inducidas específicas del paciente como estrategia curativa. Las células madre pluripotentes son un tipo de célula particularmente bueno para la producción de células progenitoras retinianas debido a su capacidad de expansión ilimitada con cariotipo estable, y la capacidad de producir células madre pluripotentes a partir de muestras de pacientes humanos. Sin embargo, los métodos actuales para diferenciar células madre pluripotentes humanas para dar progenitores retinianos, y adicionalmente para dar RPE incluyendo tipos de células diferenciadas tales como fotorreceptores, son ineficaces y requieren mucho tiempo, limitando su uso eficaz para el trasplante y la selección de fármacos. [0007] Las células madre embrionarias (células ES) son células pluripotentes que pueden propagarse en cultivo celular y mantienen de manera estable la capacidad para diferenciarse para dar las tres capas germinales embrionarias. También conservan de manera estable un cariotipo normal, proporcionando por tanto una potente fuente para formar diferentes tipos de células in vitro.
En protocolos clásicos, se aislaron células ES a partir de la masa celular interior de blastocisto de ratón (Martin 1981, Proc. Natl. Acad. Sci. USA 78: 7634-7638; Evans & Kaufman 1981, Nature 292: 154-156) y actualmente pueden obtenerse a partir de un gran número de especies. Sin embargo, en protocolos más recientes pueden obtenerse células ES sin destrucción de un blastocisto. Por ejemplo, en un protocolo esto se logra basándose en el crecimiento de blastómeros individuales derivados de blastocistos usando una técnica similar al diagnóstico genético preimplantacional (PGD) , tal como se describe por Chung Y et al. (Cell Stem Cell 2008 (2) : 113 -117 + material suplementario) . Otros estudios han mostrado que pueden obtenerse células ES mediante partenogénesis, por ejemplo a partir de un ovocito con un único pronúcleo (Lin et al. 2007. Cell Res 2007; 17:9991007) , o activación partenogenética de ovocitos humanos (Mai et al. 2007. Cell Res 17:1008-1019) . [0009] Recientemente ha sido posible producir células pluripotentes a partir de células adultas de ser humano y de ratón proporcionando un número definido de factores de transcripción a las células (Takahashi K. et al. Cell 2007:131, 861-872; Yu J et al. Science 2007:318, 1917-1920) . Estas células madre pluripotentes inducidas (células iPS) son notablemente similares a las células madre embrionarias, expresan marcadores moleculares similares y presentan pluripotencia. Además de células pluripotentes inducidas por factores de transcripción, se han derivado las denominadas células madre embrionarias de línea germinal (gESC) a partir de células madre de línea germinal de ratón y posiblemente de ser humano sin el uso de embriones. Tanto las células iPS como las gESC son funcionalmente equivalentes o muy similares a las células ES y pueden usarse para formar diversos tipos de células diferenciadas in vitro. [0010] Se han implementado células ES de ratón, de mono y de ser humano para la diferenciación retiniana así como células iPS humanas. Para la diferenciación de células para dar RPE, se han desarrollado dos clases diferentes de protocolos. Una se basa en la diferenciación aleatoria de células madre embrionarias humanas o células madre pluripotentes inducidas en medios que contienen suero o un sustituto del suero (Vugler A et al. Exp Neurol. dic. de 2008; 214 (2) :347-61; Klimanskaya I et al. Cloning... [Seguir leyendo]
Reivindicaciones:
1. Método para diferenciar células madre pluripotentes para dar células progenitoras retinianas polarizadas, que comprende las etapas:
a) cultivar colonias de células madre pluripotentes en cultivo celular tridimensional incluido en un gel proteico que comprende al menos tres proteínas seleccionadas del grupo que consiste en laminina, colágeno IV, entactina y perlecano y que comprende al menos dos, preferiblemente al menos tres, lo más preferiblemente al menos cuatro factores de crecimiento seleccionados de EGF, FGF2, NGF, PDGF, IGF-1 y TGF-beta hasta que se desarrollan quistes neurales polarizados, que contienen una única luz y consisten en células polarizadas, y
b) disociar los quistes neurales polarizados para dar células progenitoras retinianas polarizadas dispersadas.
2. Método según la reivindicación 1, en el que las colonias de células madre pluripotentes se cultivan en medio libre de suero incluido en un gel proteico durante de 4 a 7, preferiblemente de 5 a 6 días.
3. Método según la reivindicación 1 ó 2, caracterizado por el hecho de que las células pluripotentes se seleccionan de células madre pluripotentes inducidas.
4. Método según una de las reivindicaciones 1 a 3, que incluye la diferenciación posterior de las células progenitoras retinianas polarizadas obtenidas en la etapa b) para dar células diferenciadas adicionalmente del linaje retiniano. 20
5. Método según la reivindicación 4, que incluye la diferenciación posterior de las células progenitoras retinianas polarizadas obtenidas en la etapa b) para dar células del epitelio pigmentario retiniano (RPE) cultivando las células progenitoras retinianas polarizadas dispersadas en cultivo celular bidimensional en un medio de cultivo celular suplementado con activina A.
6. Método según la reivindicación 5, caracterizado porque las células progenitoras retinianas polarizadas dispersadas se cultivan sobre una membrana microporosa permeable colocada en una placa o un pocillo que contiene medio de cultivo celular.
7. Uso de los quistes neurales polarizados que contienen una única luz y consisten en células polarizadas obtenidas mediante el método según una etapa de una las reivindicaciones 1 a 3 para fines de selección.
8. Uso de un gel proteico que comprende al menos dos, preferiblemente al menos tres, componentes seleccionados del grupo que consiste en laminina, colágeno IV, entactina y perlecano y que comprende al menos dos,
preferiblemente al menos tres, lo más preferiblemente al menos cuatro, factores de crecimiento seleccionados de EGF, FGF2, NGF, PDGF, IGF-1 y TGF-beta, para diferenciar células pluripotentes para dar quistes neurales polarizados que comprenden células progenitoras retinianas polarizadas en un método según una de las reivindicaciones 1 a 6.
9. Uso de un kit que comprende
• un gel proteico o una mezcla de proteínas para preparar un gel proteico
• medio de diferenciación neural (NDM) , para diferenciar células madre pluripotentes para dar células progenitoras retinianas polarizadas en un método según una de las reivindicaciones 1 a 6.
10. Uso según la reivindicación 9, comprendiendo el kit además medio de RPE (RPEM) suplementado con activina A
o una disolución madre de la misma.
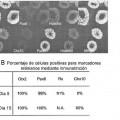
11. Cultivo celular in vitro producido mediante el método según la etapa a) de una de las reivindicaciones 1 a 3 y que comprende al menos el 80 % de células progenitoras retinianas polarizadas y que forma quistes neurales 50 polarizados, que contienen una única luz y consisten en células polarizadas, mientras que la expresión de prominina 1 y ZO-1 se restringe al lado apical de los quistes.
REFERENCIAS CITADAS EN LA DESCRIPCIÓN
La lista de referencias citada por el solicitante lo es solamente para utilidad del lector, no formando parte de los documentos de patente europeos. Aún cuando las referencias han sido cuidadosamente recopiladas, no pueden excluirse errores u omisiones y la OEP rechaza toda responsabilidad a este respecto.
Documentos de patente citado en la descripción • US 20070196919 A1 [0012] • WO 2011055855 A1 [0018]
• EP 2128244 A1 [0014] [0019] • US 20070196919 A, Lamba [0019] 10 Bibliografía de patentes citada en la descripción
• COFFEY, PJ et al. Nat. Neurosci., 2002, vol. 5.
5. 56 [0004]
• LIN, N et al. Curr. Eye Res., 1996, vol. 15, 1069-1077 [0004]
• LITTLE CW et al. Invest. Ophthalmol. Vis. Sci., 1996, vol. 37.
20. 211 [0004]
• SAUVE, Y et al. Neuroscience, 2002, vol. 114.
38. 401 [0004]
• MARTIN. Proc. Natl. Acad. Sci. USA, 1981, vol. 78, 7634-7638 [0008]
• EVANS ; KAUFMAN. Nature, 1981, vol. 292.
15. 156 [0008]
• CHUNG Y et al. Cell Stem Cell, 2008.
11. 117 [0008]
• LIN et al. Cell Res, 2007, vol. 17.
99. 1007 [0008]
• MAI et al. Cell Res, 2007, vol. 17.
100. 1019 [0008]
• TAKAHASHI K et al. Cell, 2007, vol. 131, 861872 [0009] [0036]
• YU J et al. Science, 2007, vol. 318, 1917-1920 [0009] [0036]
• VUGLER A et al. Exp Neurol., December 2008, vol. 214 (2) .
34. 61 [0010]
• KLIMANSKAYA I et al. Cloning Stem Cells, 2004, vol. 6 (3) .
21. 45 [0010]
• BUCHHOLZ DE et al. Stem Cells, October 2009, vol. 27 (10) , 2427-34 [0010]
• IDELSON et al. Cell Stem Cell, 2009, vol. 5.
39. 408 [0010]
• MEYER JS et al. PNAS, 2009, vol. 106, 16698703 [0011] [0013]
• OSAKADA F et al. Nature Protocols, 2009, vol. 4.
81. 824 [0013]
• LAMBA DA et al. PNAS, 2006, vol. 34, 1276974 [0013]
• LAMBA DA et al. Plos One, 2010, vol. 5, e8763 [0013]
• OSAKADA F et al. Nat. Biotechnol., 2008, vol. 26 (2) .
21. 224 [0015]
• LAMBA et al. PNAS, 2008, vol. 34, 12769-74 [0016]
• HIRANO M et al. Dev. Dyn., 2003, vol. 228 (4) .
66. 671 [0017]
• AOKI H et al. Dev Dyn., September 2009, vol. 238 (9) , 2266-79 [0017]
• KANATSU-SHINOHARA M et al. Ann N Y Acad Sci., December 2007, vol. 1120.
5. 71
• CONRAD S et al. Nature, 20 November 2008, vol. 456 (7220) .
34. 9 [0033]
• GUAN K et al. Nature Protocols, 2009, vol. 4 (2) .
14. 54 [0033]
• KUCIA M et al. Leukemia, May 2006, vol. 20 (5) .
85. 69 [0033]
• FENG, B et al. Cell Stem Cell, 2009, vol. 4.
30. 312 [0036]
• ZHOU H. et al. Cell Stem Cell, 2009, vol. 4 (5) .
38. 384 [0039]
• HU BY et al. Proc Natl Acad Sci U S A., 02 March 2010, vol. 107 (9) , 4335-40 [0043]
• YU J et al. Induced pluripotent stem cell lines derived from human somatic cells. Science, 2007, vol. 318, 1917-1920 [0043]
• CHOI KD et al. Hematopoietic and endothelial differentiation of human induced pluripotent stem cells. Stem Cells, 2009, vol. 27.
55. 567
• YU J et al. Human induced pluripotent stem cells free of vector and transgene sequences. Science, 2009, vol. 324.
79. 801 [0043]
• COWAN, C.A. New England Journal of Medicine, 2004, vol. 350, 13ff [0046]
• LOESER P et al. Stem Cells, 2010, vol. 28.
24. 246 [0047]
Patentes similares o relacionadas:
Métodos para generar células madre mesenquimales que secretan factores neurotróficos, del 3 de Junio de 2020, de Brainstorm Cell Therapeutics Ltd: Un método para generar células que secretan el factor neurotrófico derivado del cerebro (FNDC), factor neurotrófico derivado de la glía (FNDG), factor de crecimiento […]
Diferenciación dirigida de astrocitos a partir de células madre pluripotentes humanas para uso en el cribado de medicamentos y el tratamiento de la esclerosis lateral amiotrófica (ELA), del 18 de Marzo de 2020, de Kadimastem Ltd: Un método de detección de un agente para prevenir o tratar la esclerosis lateral amiotrófica (ELA), el método comprende: (a) contactar a una […]
Método para producir tejido retiniano y células relacionadas con la retina, del 11 de Diciembre de 2019, de SUMITOMO CHEMICAL COMPANY, LIMITED: Un método para producir una célula progenitora retiniana, que comprende: una primera etapa de someter células madre pluripotenciales a un cultivo […]
Métodos mejorados para producir células RPE y composiciones de células RPE, del 4 de Diciembre de 2019, de Astellas Institute for Regenerative Medicine: Un método de producción de células epiteliales pigmentarias retinianas (RPE) a partir de células pluripotentes humanas, caracterizado por que el método […]
Aplicación de laminina a cultivos de células endoteliales de la córnea, del 6 de Noviembre de 2019, de Kyoto Prefectural Public University Corporation: Uso de un agente seleccionado entre el grupo que consiste en laminina 511, laminina 521 o un fragmento de laminina 511-E8, que se expresa en células endoteliales de la […]
Poblaciones de células del RPE y métodos de generación de las mismas, del 6 de Noviembre de 2019, de Cell Cure Neurosciences Ltd: Población de células del epitelio pigmentario retiniano (RPE) poligonales humanas, en la que al menos el 95% de las células de la misma expresan […]
 Nuevos métodos y medios de cultivo para cultivar células madre pluripotentes, del 31 de Julio de 2019, de TECHNION RESEARCH & DEVELOPMENT FOUNDATION LIMITED: Una población aislada de células madre pluripotentes humanas que comprende al menos 50 % de células madre pluripotentes humanas caracterizadas por […]
Nuevos métodos y medios de cultivo para cultivar células madre pluripotentes, del 31 de Julio de 2019, de TECHNION RESEARCH & DEVELOPMENT FOUNDATION LIMITED: Una población aislada de células madre pluripotentes humanas que comprende al menos 50 % de células madre pluripotentes humanas caracterizadas por […]
Procedimientos de reprogramación de células y usos de los mismos, del 19 de Junio de 2019, de Genesis Technologies Limited: Un procedimiento de obtención de una célula madre de tipo neural (NSLC), que comprende: 1) poner en contacto el ADN y/o la cromatina de una célula proporcionada […]