Acetato de eslicarbazepina y métodos de uso.
El uso de acetato de eslicarbazepina en la fabricación de una composición farmacéutica para el tratamiento de neuralgia postherpética.
Tipo: Patente Europea. Resumen de patente/invención. Número de Solicitud: E11174403.
Solicitante: BIAL - PORTELA & CA., S.A.
Nacionalidad solicitante: Portugal.
Dirección: Avenida da Siderurgia Nacional 4745-457 S. Mamede do Coronado PORTUGAL.
Inventor/es: VIEIRA ARAUJO SOARES DA SILVA, PATRICIO MANUEL, DE ALMEIDA,JOSÉ LUÍS.
Fecha de Publicación: .
Clasificación Internacional de Patentes:
- A61K31/55 NECESIDADES CORRIENTES DE LA VIDA. › A61 CIENCIAS MEDICAS O VETERINARIAS; HIGIENE. › A61K PREPARACIONES DE USO MEDICO, DENTAL O PARA EL ASEO (dispositivos o métodos especialmente concebidos para conferir a los productos farmacéuticos una forma física o de administración particular A61J 3/00; aspectos químicos o utilización de substancias químicas para, la desodorización del aire, la desinfección o la esterilización, vendas, apósitos, almohadillas absorbentes o de los artículos para su realización A61L; composiciones a base de jabón C11D). › A61K 31/00 Preparaciones medicinales que contienen ingredientes orgánicos activos. › que tienen ciclos con siete eslabones, p. ej. azelastina, pentilentetrazol.
- A61P29/00 A61 […] › A61P ACTIVIDAD TERAPEUTICA ESPECIFICA DE COMPUESTOS QUIMICOS O DE PREPARACIONES MEDICINALES. › Agentes analgésicos, antipiréticos o antiinflamatorios que no actúan sobre el sistema nervioso central, p. ej. agentes antirreumáticos; Antiinflamatorios no esteroideos (AINEs).
PDF original: ES-2534514_T3.pdf
Fragmento de la descripción:
Acetato de eslicarbazepina y métodos de uso Antecedentes La presente divulgación se refiere a una composición farmacéutica y a un método de tratamiento que usa acetato de eslicarbazepina y en particular al uso del acetato de eslicarbazepina en la fabricación de una composición farmacéutica para tratar neuralgia postherpética.
La epilepsia, las afecciones del dolor tales como la neuralgia del trigémino, y los trastornos cerebrales afectivos tales como el trastorno bipolar se tratan habitualmente con carbamazepina. Sin embargo, el tratamiento con carbamazepina puede conducir a graves efectos secundarios debidos a la producción de metabolitos tóxicos. Se ha desarrollado la oxcarbazepina para reducir la gravedad de estos efectos secundarios, pero la oxcarbazepina tiene una potencia enormemente reducida. Véase, por ejemplo, Almeida, L. & Soares-da-Silva, P., "Safety, Tolerability, and Pharmacokinetic Profile of BIA 2-093, a Novel Putative Antiepileptic, in a Rising Multiple-Dose Study in Young Healthy Humans", J. Clin. Pharmacol., 44, 906-918 (2004) (denominado en lo sucesivo el presente documento "Almeida I") .
De ese modo, existe la necesidad de una composición farmacéutica y un método para tratar diversas afecciones o enfermedades tales como, por ejemplo, epilepsia, neuralgia del trigémino, y trastornos cerebrales afectivos, que tengan una alta potencia y una escasa aparición de efectos secundarios.
Sumario El acetato de eslicarbazepina, (S) - (-) -10-acetoxi-10, 11-dihidro-5H-dibenz/b, f/azepina-5-carboxamida ("BIA 2-093") , es un nuevo fármaco que se está desarrollando en la actualidad que es útil para el tratamiento de diversas afecciones, tales como, por ejemplo, epilepsia y trastornos cerebrales afectivos, así como afecciones del dolor y alteraciones de la función nerviosa en enfermedades degenerativas y postisquémicas. Aunque químicamente relacionado con la carbamazepina y la oxcarbazepina, se cree que el acetato de eslicarbazepina evita la producción de ciertos metabolitos tóxicos (tales como, por ejemplo, epóxidos) y evita la producción innecesaria de enantiómeros o diastereoisómeros de metabolitos y conjugados, sin perder actividad farmacológica. Véase Benes et al., "Anticonvulsant and Sodium Channel-Blocking Properties of Novel 10, 11-Dihydro-5H-dibenz[b, f]azepine-5carboxamide Derivatives", J. Med. Chem., 42, 2582-2587 (1999) .
Al igual que la carbamazepina y la oxcarbazepina, se cree que el acetato de eslicarbazepina es un bloqueante de los canales de sodio abiertos por tensión (VGSC) que interactúa competitivamente con el sitio 2 del estado inactivado del canal de sodio. La afinidad por este estado del canal es similar a la de la carbamazepina, mientras que la afinidad por el estado de reposo del canal es aproximadamente 3 veces inferior que la de la carbamazepina. Este perfil puede suponer un aumento de la selectividad inhibitoria del acetato de eslicarbazepina por las neuronas de activación rápida sobre las que presentan una actividad normal. Véase Bonifacio et al., "Interaction of the Novel Anticonvulsant, BIA 2-093, with Voltage-Gated Sodium Channels: Comparison with Carbamazepine", Epilepsia, 42, 600-608 (2001) .
La evaluación del perfil metabólico del acetato de eslicarbazepina, siguiendo análisis quiral, en microsomas hepáticos de ratas, perros, monos y seres humanos descubrió que se obtiene el enantiómero S (+) de licarbazepina, (S) - (+) -10, 11-dihidro-10-hidroxi-5H dibenz/b, f/azepina-5-carboxamida (también conocida como "eslicarbazepina") , y no la forma R (-) de licarbazepina, (R) - (-) -10, 11-dihidro-10-hidroxi-5H dibenz/b, f/azepina-5-carboxamida (también conocida como "R-licarbazepina") .
Los estudios en seres humanos han mostrado que, después de la administración oral, el acetato de eslicarbazepina parece metabolizarse rápida y considerablemente en el metabolito activo eslicarbazepina y, en menor grado, en Rlicarbazepina. Véase Silveira et al., "BIA 2-093 Pharmacokinetics in Healthy Elderly Subjects", Epilepsia, 45 (supl. 3) , 157 (2004) . Por ejemplo, se ha descubierto que las concentraciones en plasma del fármaco precursor (acetato de 55 eslicarbazepina) están sistemáticamente por debajo del límite de cuantificación (LOQ) del ensayo (10 ng/ml) . Véase Almeida I; Almeida, L. & Soares-da-Silva, P., "Safety, Tolerability and Pharmacokinetic Profile of BIA 2-093, a Novel Putative Antiepileptic Agent, during First Administration to Humans", Drugs R&D, 4, 269-284 (2003) (denominado en lo sucesivo en el presente documento "Almeida II") . Cuando se usa un método no quiral, el ensayo no distingue entre la eslicarbazepina y el enantiómero R y se informa una mezcla como "BIA 2-005" o "licarbazepina racémica".
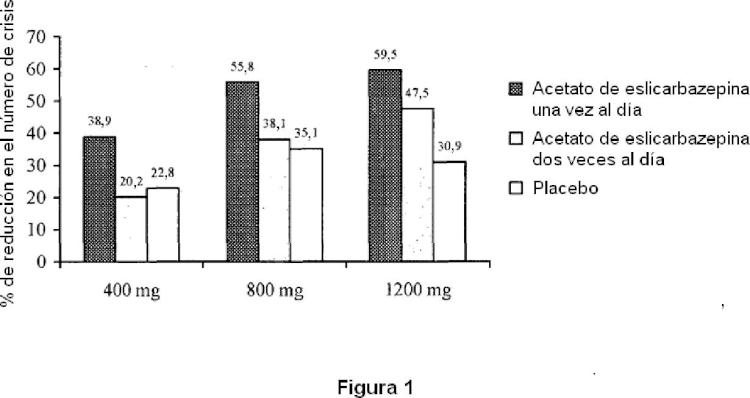
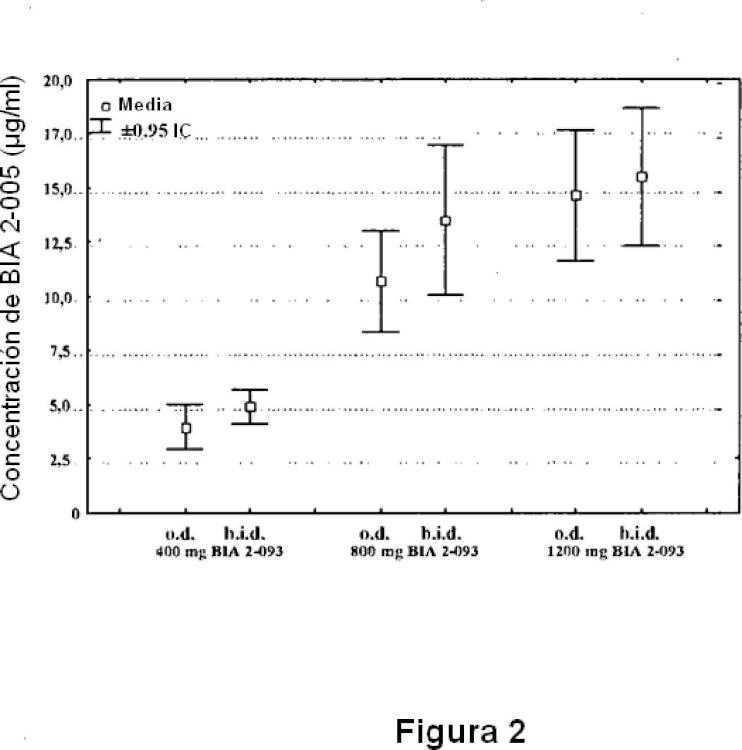
Los presentes inventores llevaron a cabo estudios de entrada-en-hombre en sujetos sanos, los resultados de los cuales se describen en los artículos Almeida I y Almeida II. En estos estudios, los sujetos sanos recibieron una dosis oral individual de acetato de eslicarbazepina en los que la dosis varió de 20 mg a 1200 mg (véase Almeida II) , y dosis diarias múltiples de acetato de eslicarbazepina que variaron de 200 mg dos veces al día a 1200 mg una vez al 65 día (véase Almeida I) . En estudios adicionales (aún no publicados) los presentes inventores han investigado dosis mayores de acetato de eslicarbazepina incluyendo, por ejemplo, dosis que varían hasta 2400 mg una vez al día. Los
estudios mostraron que la concentración máxima observada en plasma (Cmax) de BIA 2-005 se alcanzó de aproximadamente 1 hora a aproximadamente 4 horas postdosis (tmax) , el grado de exposición sistémica a BIA 2-005 fue aproximadamente proporcional a la dosis, y el estado estacionario de las concentraciones en plasma de BIA 2005 se alcanzó en aproximadamente 4 a 5 días. El aclaramiento renal medio de BIA 2-005 a partir del plasma fue aproximadamente 20-30 ml/min, y la cantidad total de BIA 2-005 recuperada en la orina fue aproximadamente un 20 % y un 40 % en 12 horas y 24 horas postdosis, respectivamente.
Los estudios también mostraron que la semivida terminal aparente de BIA 2-005 variaron de aproximadamente 8 horas a aproximadamente 17 horas. Véase, por ejemplo, Almeida II.
El documento de Patente de Estados Unidos Nº 6.296.873 desvela un sistema de suministro de liberación sostenida para carbamazepina, que tiene una semivida que varía de 25 horas a 85 horas. Para evitar los efectos adversos, el documento de Patente de Estados Unidos Nº 6.296.873 enseña que la carbamazepina se debería administrar en forma de comprimido hasta dos o más veces al día para liberar lentamente el compuesto para mantener los niveles de concentración entre 4-12 μg/ml. Tal sistema de suministro requiere una forma que sea capaz de suministrar el compuesto durante un período de tiempo prolongado, tal como una forma de comprimido.
El documento de Patente WO 03/042182 se refiere al uso de licarbazepina para el tratamiento de trastornos afectivos y de atención, dolor neuropático y trastornos relacionados con dolor neuropático.
D. Hainzl et al. Epilepsy Research, 2001, Vol. 44, Nº 2/03, 197-206 desvela un estudio para evaluar el metabolismo del acetato de eslicarbazepina y otro agente antiepiléptico, BIA-2 059.
E. Carrazana et al., Journal of Pain and Symptom Management, 2003, Vol. 25, Nº 5, S31-S35 se refiere a los 25 fundamentos y las evidencias para el uso de oxcarbazepina en el tratamiento de dolor neuropático.
El documento de Patente EP 1477480A desvela un método para la racemización de (S) - (+) -y (R) - (-) -10, 11-dihidro10-hidroxi-5H dibenz/b, f/azepina-5-carboxamida y mezclas ópticamente enriquecidas de los mismos.
El documento de Patente US 2004/038874 se refiere a un método para el tratamiento de dolor persistente mediante la inhibición de la inflamación usando, por ejemplo, un inhibidor de TNF-alfa.
El documento de Patente WO 2004/071513 se refiere al uso de una mezcla de enantiómeros de licarbazepina para el tratamiento de dolor neuropático En un aspecto de la presente divulgación, los presentes inventores han descubierto de forma inesperada un aumento de eficacia del acetato de eslicarbazepina en el tratamiento de diversas afecciones usando una administración una vez al día en comparación con la administración dos veces al día. Este descubrimiento es particularmente sorprendente debido a que la semivida aparente del acetato de eslicarbazepina (t1/2 = de aproximadamente 8 horas a aproximadamente 17 horas) es considerablemente más corta que la semivida de la carbamazepina (t1/2 = de 25 horas a 85 horas) , un compuesto que se administra por lo general 3-4 veces al día.
En otro aspecto de la presente divulgación, los presentes inventores también han descubierto... [Seguir leyendo]
Reivindicaciones:
1. El uso de acetato de eslicarbazepina en la fabricación de una composición farmacéutica para el tratamiento de neuralgia postherpética. 5
2. El uso de acuerdo con la reivindicación 1, en el que la composición farmacéutica es para administración una vez al día.
3. El uso de acuerdo con la reivindicación 2, en el que la dosis una vez al día se administra en una cantidad que da
como resultado una concentración máxima observada en plasma, Cmax, de eslicarbazepina mayor de aproximadamente 7.400 ng/ml.
4. El uso de acuerdo con la reivindicación 3, en el que la dosis una vez al día se administra en una cantidad que da como resultado una Cmax de eslicarbazepina mayor de aproximadamente 12.000 ng/ml. 15
5. El uso de acuerdo con la reivindicación 2, en el que la dosis una vez al día se administra en una cantidad que da como resultado un área bajo la curva de concentración, AUC0-Ï, de eslicarbazepina mayor de aproximadamente
111.000 ng·h/ml, en la que Ï es el intervalo de dosificación.
6. El uso de acuerdo con la reivindicación 5, en el que la dosis una vez al día se administra en una cantidad que da como resultado una AUC0-Ï de eslicarbazepina mayor de aproximadamente 240.000 ng·h/ml.
7. El uso de acuerdo con una cualquiera de las reivindicaciones 2 a 5, en el que la dosis una vez al día se administra en una dosificación que comprende al menos aproximadamente 400 mg de acetato de eslicarbazepina. 25
8. El uso de acuerdo con la reivindicación 6, en el que la dosis una vez al día se administra en una dosificación que comprende al menos 800 mg de acetato de eslicarbazepina.
9. El uso de acuerdo con cualquier reivindicación anterior, en el que el principio activo de la composición 30 farmacéutica consiste básicamente en acetato de eslicarbazepina.
10. El uso de acuerdo con cualquier reivindicación anterior, en el que la composición farmacéutica se formula para la administración oral.
11. El uso de acuerdo con cualquier reivindicación anterior, en el que la composición farmacéutica está en forma de comprimido.
12. El uso de acuerdo con una cualquiera de las reivindicaciones 1 a 10, en el que la composición farmacéutica está
en forma de suspensión oral. 40
13. El uso de acuerdo con la reivindicación 12, en el que la composición farmacéutica comprende al menos un excipiente, una sustancia auxiliar y/o un material vehículo.
14. El uso de acuerdo con la reivindicación 13, en el que el al menos un excipiente, una sustancia auxiliar y/o un
material vehículo se seleccionan entre goma de xantano, estearato de macrogol, metilparabeno, propilparabeno, sacarina sódica, sorbitol, tampones, aromatizantes y las combinaciones de los mismos.
Patentes similares o relacionadas:
Tratamientos de combinación que comprenden imidazopirazinonas para el tratamiento de trastornos psiquiátricos y/o cognitivos, del 29 de Julio de 2020, de H. LUNDBECK A/S: Un compuesto de Fórmula (I) **(Ver fórmula)** en donde n es 0 o 1; q es 0 o 1; R1 se selecciona del grupo que consiste en bencilo, indanilo, indolina y heteroarilos […]
Combinación de agonistas inversos del receptor de histamina-3 con inhibidores de acetilcolinesterasa, del 24 de Junio de 2020, de SUVEN LIFE SCIENCES LIMITED: Una combinación que comprende un agonista inverso del receptor de histamina-3 y un inhibidor de acetilcolinesterasa; en donde el agonista inverso del receptor de histamina-3 […]
Amidas heterocíclicas como inhibidores de quinasa, del 3 de Junio de 2020, de GlaxoSmithKline Intellectual Property Development Limited: Un compuesto que es **(Ver fórmula)** o un tautómero del mismo o una sal del mismo.
INHIBIDORES DE TGF-ß1 Y PRODUCTORES DE ENDOGLINA PARA SU USO EN EL TRATAMIENTO DE EPIDERMÓLISIS BULLOSA, del 14 de Mayo de 2020, de CONSEJO SUPERIOR DE INVESTIGACIONES CIENTIFICAS (CSIC): La presente invención se refiere a un fármaco inhibidor de la ruta de TGF-ß1 y estimulador de endoglina o una composición farmacéutica del mismo, […]
Inhibidores de EZH2 (potenciador del homólogo Zeste 2), del 13 de Mayo de 2020, de Glaxosmithkline Intellectual Property (No. 2) Limited: Un compuesto según la Fórmula (I) o una sal farmacéuticamente aceptable del mismo: **(Ver fórmula)** en la que: representa un enlace sencillo […]
INHIBIDORES DE TGF-ß1 Y PRODUCTORES DE ENDOGLINA PARA SU USO EN EL TRATAMIENTO DE EPIDERMÓLISIS BULLOSA, del 8 de Mayo de 2020, de CONSEJO SUPERIOR DE INVESTIGACIONES CIENTIFICAS (CSIC): Inhibidores de TGF-{beta}1 y productores de endoglina para su uso en el tratamiento de epidermólisis bullosa. La presente invención se refiere a un fármaco inhibidor […]
Benzazepinas fusionadas para el tratamiento de la tartamudez, del 29 de Abril de 2020, de Emalex Biosciences, Inc: Un antagonista selectivo para el receptor D1 y/o selectivo para D5 para su uso en el tratamiento de la tartamudez en un sujeto.
Compuestos de oxima como agonistas del receptor muscarínico M1 y/o M4, del 15 de Abril de 2020, de HEPTARES THERAPEUTICS LIMITED: Un compuesto de la fórmula : **(Ver fórmula)** o una sal del mismo, en donde: p es 0, 1 o 2; q es 0, 1 o 2; Y es N, O, S o C; X1 y X2 son grupos […]