Método para la producción de vectores adenovíricos.
Un método para la producción de un adenovirus recombinante del serotipo 35 (rAd35) en un biorreactor,
comprendiendo el método:
a) el cultivo de células PER.C6 en suspensión en un biorreactor con un sistema de perfusión;
b) la infección de dichas células en un biorreactor a una densidad de entre 10 x 106 células viables/ml y 16 x 106 células viables/ml con rAd35;
c) el cultivo posterior de las células infectadas en un biorreactor con un sistema de perfusión para la propagación de dicho rAd35; y
d) la recogida de dicho rAd35.
Tipo: Patente Internacional (Tratado de Cooperación de Patentes). Resumen de patente/invención. Número de Solicitud: PCT/EP2009/064265.
Solicitante: CRUCELL HOLLAND B.V..
Nacionalidad solicitante: Países Bajos.
Dirección: ARCHIMEDESWEG 4 2333 CN LEIDEN PAISES BAJOS.
Inventor/es: LEWIS,JOHN ALFRED, LUITJENS,ALFRED.
Fecha de Publicación: .
Clasificación Internacional de Patentes:
- C12M3/06 QUIMICA; METALURGIA. › C12 BIOQUIMICA; CERVEZA; BEBIDAS ALCOHOLICAS; VINO; VINAGRE; MICROBIOLOGIA; ENZIMOLOGIA; TECNICAS DE MUTACION O DE GENETICA. › C12M EQUIPOS PARA ENZIMOLOGIA O MICROBIOLOGIA (instalaciones para la fermentación de estiércoles A01C 3/02; conservación de partes vivas de cuerpos humanos o animales A01N 1/02; aparatos de cervecería C12C; equipos para la fermentación del vino C12G; aparatos para preparar el vinagre C12J 1/10). › C12M 3/00 Equipos para el cultivo de tejidos, de células humanas, animales o vegetales, o de virus. › con medios de filtración, de ultrafiltración, de ósmosis inversa o de diálisis.
- C12N15/861 C12 […] › C12N MICROORGANISMOS O ENZIMAS; COMPOSICIONES QUE LOS CONTIENEN; PROPAGACION, CULTIVO O CONSERVACION DE MICROORGANISMOS; TECNICAS DE MUTACION O DE INGENIERIA GENETICA; MEDIOS DE CULTIVO (medios para ensayos microbiológicos C12Q 1/00). › C12N 15/00 Técnicas de mutación o de ingeniería genética; ADN o ARN relacionado con la ingeniería genética, vectores, p. ej. plásmidos, o su aislamiento, su preparación o su purificación; Utilización de huéspedes para ello (mutantes o microorganismos modificados por ingeniería genética C12N 1/00, C12N 5/00, C12N 7/00; nuevas plantas en sí A01H; reproducción de plantas por técnicas de cultivo de tejidos A01H 4/00; nuevas razas animales en sí A01K 67/00; utilización de preparaciones medicinales que contienen material genético que es introducido en células del cuerpo humano para tratar enfermedades genéticas, terapia génica A61K 48/00; péptidos en general C07K). › Vectores adenovirales.
- C12N7/00 C12N […] › Virus, p. ej. bacteriófagos; Composiciones que los contienen; Su preparación o purificación (preparaciones de uso médico que contienen virus A61K 35/76; preparación de composiciones de uso médico que contienen antígenos o anticuerpos virales, p. ej. vacunas virales, A61K 39/00).
PDF original: ES-2532015_T3.pdf
Fragmento de la descripción:
Método para la producción de vectores adenovíricos
La invención se refiere al campo del cultivo celular y la producción de vectores adenovíricos. Más concretamente, se refiere a métodos mejorados para el cultivo de células de mamíferos, la infección de estas células con adenovirus y la producción de partículas adenovíricas a partir de las mismas.
Antecedentes de la invención
Los desarrollos recientes en el campo de la vacunación con ADN mediante el uso de vectores víricos recombinantes ha creado la necesidad de la preparación a gran escala de material para uso clínico. Se necesitan procesos que sean capaces de apoyar al mundo menos desarrollado y de menor desarrollo con cantidades suficientes de vacunas recombinantes basadas en adenovirus para luchar, por ejemplo, contra el problema de la tuberculosis y la malaria en el mundo. Una evaluación de las cohortes de nacimientos muestra que se esperan más de 15.. nacimientos en el mundo menos desarrollado y de menor desarrollo en el periodo 21-215. Sobre la base de esta cohorte de nacimientos, la demanda anual proyectada para una vacuna podría alcanzar aproximadamente 1,5 x 119 partículas víricas (PV) cada año ( http://esa.un.org/unpp/index . asp?panel=2).
Se han descrito varios procesos para la producción de adenovirus. Estos procesos usan cultivos celulares adherentes en botellas rotatorias, fábricas celulares (Nunclon de Nunc o CellStack de Corning) o cubos celulares (Corning). Los procesos de producción en cultivos celulares adherentes no pueden satisfacer la demanda mundial de vacunas basadas en adenovirus. Por consiguiente, las células usadas en los procesos adherentes se adaptan a cultivos en suspensión (por ejemplo, las líneas celulares HEK293 y PER.C6®). Con el uso de cultivos en suspensión es posible aumentar la escala de los procesos de producción para biorreactores a gran escala. Los cultivos celulares en suspensión para la producción de adenovirus se realizan normalmente a una escala de entre 3 y 2 I y se ha descrito un aumento satisfactorio de la escala hasta 1 I (Kamen y col., 24) y 25 I (Xie y col., 23). Se han descrito experimentos en los que se anticipa un aumento de la escala hasta 1. I (Xie y col., 23).
Sin embargo, una desventaja importante del aumento de la escala hasta 1. I es la gran inversión de capital (CAPEX) necesaria para diseñar y construir una instalación de biorreactores de 1. I. Además, el compromiso de inversión de capital para la construcción de una instalación de 1. I, en las condiciones de bioseguridad BSL 2, debe realizarse antes de saber incluso si el producto tendrá éxito (fase IV y posteriores). Se calcula que el gasto de inversión total para una planta de biorreactores de 1. I está entre 225.. ? y 32.. ? (Estape y col., 26). Por consiguiente, sería deseable la preparación a menor escala, por ejemplo, en biorreactores de 1. I o más pequeños.
Con el uso de los procesos existentes en la actualidad deben producirse más de 15 lotes de 1. I al año para alcanzar el objetivo de 1,5 x 119 PV/año. Por consiguiente, existe la necesidad de mejorar los sistemas de producción de adenovirus para mejorar los rendimientos de partículas adenovíricas con el fin de satisfacer la demanda mundial de vacunas de adenovirus, preferentemente con costes no prohibitivos.
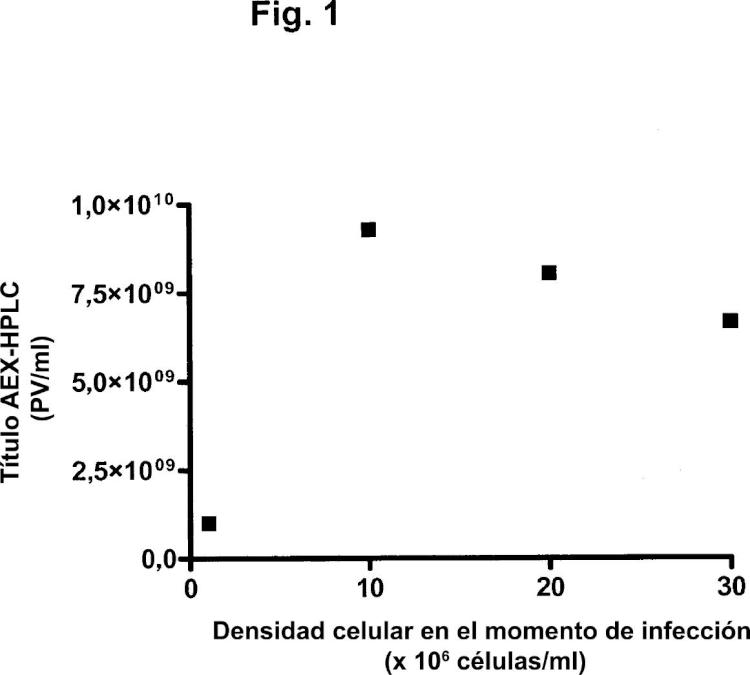
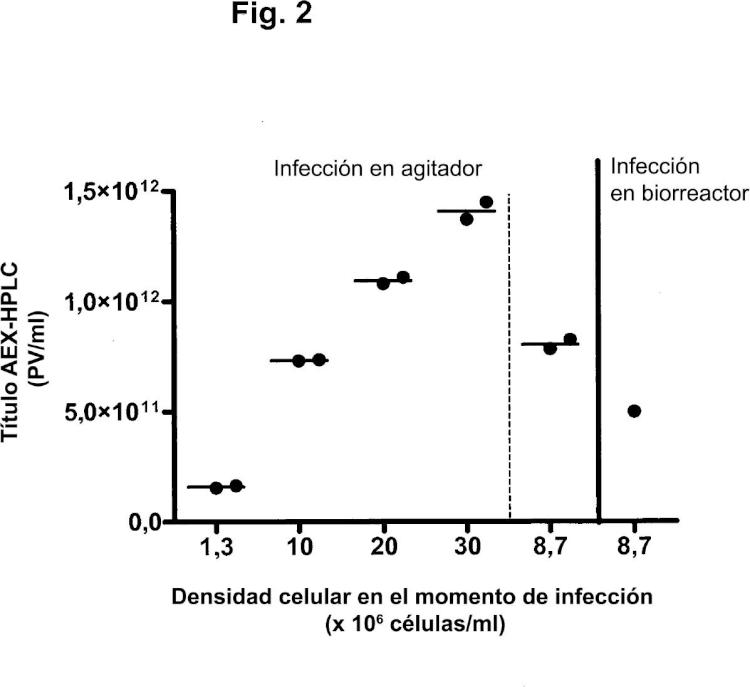
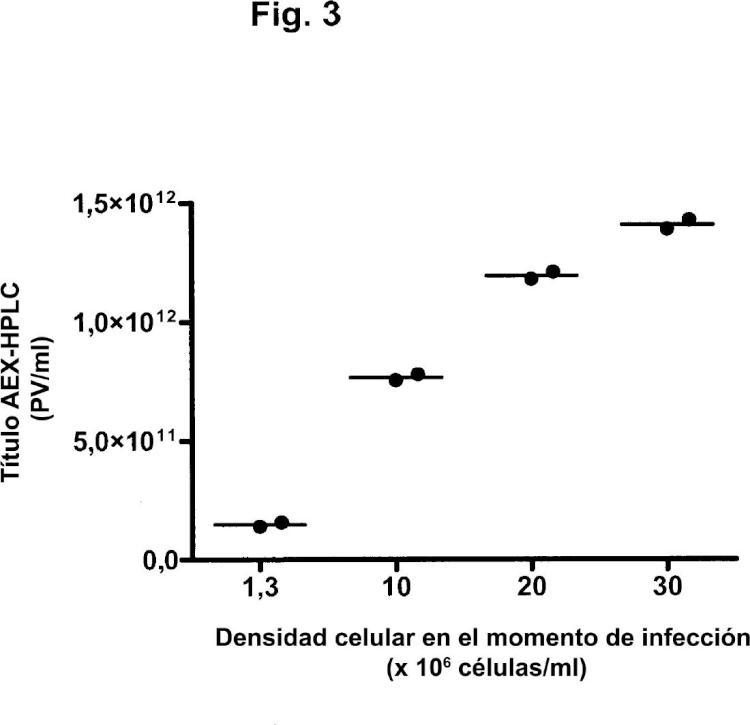
Uno de los problemas que se presentan en la optimización de la producción de adenovirus es el denominado "efecto de la densidad celular". En el modo de operación por lotes, varias referencias sugieren la existencia de una densidad celular óptima en el momento de infección para la producción de adenovirus. El óptimo se encuentra entre ,5 y 1 x 16 células/ml (Maranga y col., 25; Kamen y col., 24). Se ha demostrado que, para la producción de adenovirus (Ad5) en un biorreactor del tipo de tanque agitado por lotes, la productividad de virus por célula permanece constante hasta aproximadamente ,9 x 16 células/ml, pero disminuye abruptamente a aproximadamente 1 x 16 células/ml (Altaras y col., 25). Por encima de 2 x 16 células/ml, no se detectan partículas víricas. El valor crítico relacionado con la caída de la producción específica con las densidades celulares en el momento de infección depende del medio. Ningún medio comercial disponible hasta el momento ha mostrado potencial para alcanzar grandes rendimientos de partículas víricas, manteniendo a la vez la producción específica óptima a densidades celulares por encima de 1 x 16 células/ml (Kamen y col., 24). La razón de esta caída no se conoce todavía, pero podría ser debida a la limitada disponibilidad de nutrientes para la producción de virus o a altas concentraciones de metabolitos que inhiben la producción de virus.
Las operaciones por lotes alimentados, tales como por adición de glucosa, glutamina y aminoácidos, permitieron infecciones a densidades celulares de hasta 2 x 16 células/ml. Sin embargo, las productividades alcanzadas a altas densidades celulares fueron inferiores a las obtenidas con una infección a densidades celulares de 1 x 18 células/ml (Kamen y col., 24).
En los procesos de perfusión, las células se retienen en el biorreactor por medio de fibras huecas, filtros de centrifugación o separadores acústicos, mientras el medio de cultivo se perfunde a través del biorreactor. En estos procesos, pueden alcanzarse a veces densidades celulares superiores a 1 x 16 células/ml (por ejemplo, Yallop y col., 25).
Las células infectadas perfundidas mostraron una pérdida prematura de células durante la perfusión con un sistema de fibras huecas. Esto podría estar relacionado con su mayor sensibilidad al cizallamiento debido a la infección vírica (Cortin y col., 24). Lo más probable es que la causa de este fenómeno fuera el estrés hidrodinámico inducido en el entubado, las fibras huecas o la bomba peristáltica sobre las células infectadas, que son más frágiles. Dado que las células infectadas son más frágiles, se ha sugerido que el separador acústico sería especialmente deseable si la perfusión ha de mantenerse a lo largo de la fase de infección. Sin embargo, las infecciones llevadas a cabo en el modo de perfusión solo pudieron mantenerse para densidades celulares de 3 x 16 células/ml con una tasa de perfusión de dos volúmenes/día. La infección a una densidad celular de 6 x 16 células/ml condujo a una reducción de la productividad específica de cinco veces (Henry y col., 24).
A pesar del efecto de la densidad celular descrito por otros autores, una publicación (Yuk y col., 24) describe cultivos perfundidos satisfactorios de células tumorales humanas como plataforma para la producción de vectores adenovíricos oncolíticos. Esta publicación describe un proceso de perfusión para altas densidades celulares mediante el uso de la tecnología del flujo tangencial alterno (ATF). Para una densidad media de células viables en el momento de infección de 9 x 16 células HeLaS3/ml, se observó un título vírico medio de aproximadamente 4 x 111 PV/ml. Las células tumorales usadas en esta publicación no son preferidas como células productoras, dado que el uso de células tumorales puede plantear riesgos de seguridad cuando las partículas de adenovirus producidas van a administrarse a humanos. El adenovirus recombinante en esta publicación estaba basado en Ad5. Tales adenovirus tienen posibilidades limitadas de uso como vacunas, ya que la mayoría de la población humana contiene anticuerpos preexistentes neutralizantes contra Ad5 y, por lo tanto, los adenovirus recombinantes de otros serotipos son más adecuados para su uso como vacunas (véase, por ejemplo, el documento WO /771). En particular, los adenovirus recombinantes del subgrupo B, tales como Ad35, son especialmente ventajosos para su uso como vacunas (documento WO /771). El documento WO 25/8556 desvela la producción de Ad35 mediante la infección de células PER.C6 a una densidad de aproximadamente 1 x 16 células/ml.
Se dispone, si acaso, de una limitada información para la producción a gran escala de adenovirus recombinantes de otros serotipos distintos de Ad5, especialmente del ventajoso serotipo 35. Se han descrito algunas diferencias entre Ad35 y Ad5 con respecto a purificación de los mismos mediante intercambio aniónico (por ejemplo, el documento WO 25/8556). Las propiedades físicas en cierta medida diferentes de los adenovirus recombinantes de distintos serotipos pueden dar lugar a diferencias en los procesos de producción o en determinadas condiciones. Tales diferencias potenciales pueden ser especialmente importantes a escala industrial, en que incluso diferencias aparentemente pequeñas a pequeña escala pueden tener consecuencias económicas considerables a la escala prevista para la producción de la demanda mundial anual. Por ejemplo, hasta ahora se desconoce... [Seguir leyendo]
Reivindicaciones:
1. Un método para la producción de un adenovirus recombinante del serotipo 35 (rAd35) en un biorreactor, comprendiendo el método:
a) el cultivo de células PER.C6 en suspensión en un biorreactor con un sistema de perfusión;
b) la infección de dichas células en un biorreactor a una densidad de entre 1 x 16 células viables/ml y 16 x 16 células viables/ml con rAd35;
c) el cultivo posterior de las células infectadas en un biorreactor con un sistema de perfusión para la propagación de
dicho rAd35; y
d) la recogida de dicho rAd35.
2. Un método de acuerdo con la reivindicación 1, en que dichas células en la etapa b) se infectan con rAd35 a una densidad de entre aproximadamente 1 x 16 y 14 x 16 células viables/ml.
3. Un método de acuerdo con una cualquiera de las reivindicaciones anteriores, en que dicho sistema de perfusión en la etapa c) es un sistema de perfusión de flujo tangencial alterno (ATF).
4. Un método de acuerdo con una cualquiera de las reivindicaciones anteriores, que además comprende:
e) la purificación del rAd35 y, opcionalmente,
f) la preparación de una composición farmacéutica que contiene el rAd35 purificado.
5. Un método de acuerdo con una cualquiera de las reivindicaciones anteriores, en que dicho adenovirus recombinante carece de al menos una porción de la región E1 y comprende un ácido nucleico heterólogo.
6. Un método de acuerdo con una cualquiera de las reivindicaciones anteriores, en que dicho sistema de perfusión en la etapa a) es un sistema de perfusión de flujo tangencial alterno (ATF).
7. Un método de acuerdo con una cualquiera de las reivindicaciones anteriores, en que la etapa a) se realiza en un primer biorreactor y las etapas b) y c) se realizan en un segundo biorreactor.
Patentes similares o relacionadas:
Métodos mejorados para la preparación de escualeno, del 15 de Julio de 2020, de NOVARTIS AG: Un procedimiento para la preparación de escualeno a partir de una composición que comprende escualeno a partir de una fuente animal, dicho procedimiento comprendiendo […]
Señal para el empaquetamiento de vectores del virus de la gripe, del 24 de Junio de 2020, de WISCONSIN ALUMNI RESEARCH FOUNDATION: Un vector del virus de la gripe para la expresión y empaquetamiento de ARNv recombinante, en el que el vector comprende: secuencias correspondientes […]
Nueva especie de tobamovirus, del 17 de Junio de 2020, de Nunhems B.V: Un tobamovirus cuyo genoma comprende al menos 83% de identidad de secuencia con la SEQ ID NÚM.: 1 y en el que el virus causa síntomas sistémicos en plantas homocigotas […]
Vectores de AAV dirigidos a oligodendrocitos, del 10 de Junio de 2020, de THE UNIVERSITY OF NORTH CAROLINA AT CHAPEL HILL: Un ácido nucleico que codifica una cápside de AAV, comprendiendo el ácido nucleico una secuencia codificante de la cápside de AAV que es al menos el 96 % idéntica […]
Métodos para la transducción y el procesamiento de células, del 27 de Mayo de 2020, de Juno Therapeutics, Inc: Un método de transducción, que comprende incubar, en una cavidad interna de una cámara de centrífuga, una composición de entrada que comprende células y partículas […]
Composiciones para tratar MPSI, del 22 de Abril de 2020, de THE TRUSTEES OF THE UNIVERSITY OF PENNSYLVANIA: Un vector que lleva un casete de expresión que comprende un gen de la alfa-L-iduronidasa humana (hIDUA) que tiene la secuencia de nucleótidos de SEQ ID NO: […]
Métodos mejorados para producir terapias celulares adoptivas, del 22 de Abril de 2020, de Bluebird Bio, Inc: Un método in vitro para producir un producto terapéutico de células T que comprende: a) proporcionar una población de células mononucleares […]
Nuevo bacteriófago y composición que comprende el mismo, del 25 de Marzo de 2020, de CJ CHEILJEDANG CORPORATION: Un bacteriófago ΦCJ25 (KCCM11463P) que tiene una capacidad específica para matar Escherichia coli patógena aviar.