Implante que contiene amino-bisfosfonatos y procedimiento para su producción.
Implante, excluyendo un implante dental, que presenta al menos por zonas un revestimiento en zonas de superficie que se encuentran al menos en contacto indirecto en estado implantado con tejido duro y/o blando,
que contiene tanto un
amino-bisfosfonato de fórmula general
(H2O3P)-C(X)(Y)-(PO3H2) (I)
en la que
X se selecciona de H, OH, Cl, F o de un grupo metilo
Y es un grupo alquilo C1 - C7 lineal sustituido con NH2, N(CH3)2, NH(CH3), N(CH3)3, piridinilo o imidazolilo, o sales farmacéuticamente compatibles o ésteres del mismo,
como también al menos
un componente anfífilo en forma de un sulfato de alquilo o carboxilato de alquilo C10-C20 lineal, no sustituido, o una mezcla de los mismos
y/o un componente polimérico iónico soluble en agua con grupos aniónicos libres en forma de un derivado carboxilado, carboximetilado, sulfatado o fosforilado de polisacáridos naturales, encontrándose en el revestimiento el amino-bisfosfonato y el componente anfífilo o el amino-bisfosfonato y el componente polimérico iónico soluble en agua como sal mixta con baja solubilidad en agua.
Tipo: Patente Internacional (Tratado de Cooperación de Patentes). Resumen de patente/invención. Número de Solicitud: PCT/CH2006/000576.
Solicitante: NEXILIS AG.
Nacionalidad solicitante: Suiza.
Dirección: Dammstrasse 14 2540 Grenchen SUIZA.
Inventor/es: SCHNABELRAUCH, MATTHIAS, DR., SCHLOTTIG, FALKO, KAUTZ,Armin Rex.
Fecha de Publicación: .
Clasificación Internacional de Patentes:
- A61L27/32 NECESIDADES CORRIENTES DE LA VIDA. › A61 CIENCIAS MEDICAS O VETERINARIAS; HIGIENE. › A61L PROCEDIMIENTOS O APARATOS PARA ESTERILIZAR MATERIALES U OBJECTOS EN GENERAL; DESINFECCION, ESTERILIZACION O DESODORIZACION DEL AIRE; ASPECTOS QUIMICOS DE VENDAS, APOSITOS, COMPRESAS ABSORBENTES O ARTICULOS QUIRURGICOS; MATERIALES PARA VENDAS, APOSITOS, COMPRESAS ABSORBENTES O ARTICULOS QUIRURGICOS (conservación de cuerpos o desinfección caracterizada por los agentes empleados A01N; conservación, p. ej. esterilización de alimentos o productos alimenticios A23; preparaciones de uso medico, dental o para el aseo A61K). › A61L 27/00 Materiales para prótesis o para revestimiento de prótesis (prótesis dentales A61C 13/00; forma o estructura de las prótesis A61F 2/00; empleo de preparaciones para la fabricación de dientes artificiales A61K 6/80; riñones artificiales A61M 1/14). › Materiales que contienen fósforo, p. ej. apatito.
- A61L27/54 A61L 27/00 […] › Materiales biológicamente activos, p. ej. sustancias terapéuticas.
PDF original: ES-2507552_T3.pdf
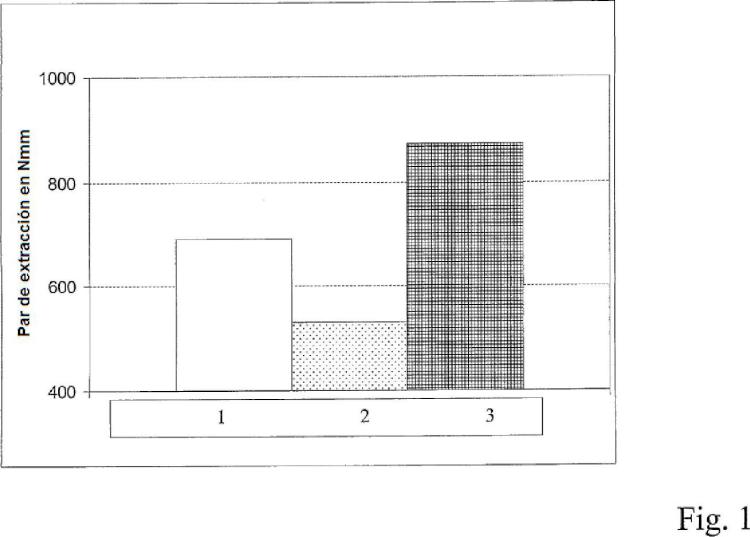
Fragmento de la descripción:
Implante que contiene amino-bisfosfonatos y procedimiento para su producción Campo técnico La presente invención se refiere a un implante, que presenta en estado implantado al menos por zonas un revestimiento en zonas de superficie que se encuentran en contacto con tejido duro y/o blando.
Estado de la técnica Las partes heridas o dañadas del tejido duro y/o blando del cuerpo humano se regeneran de la mejor manera o se refuerzan mecánicamente, usándose tejido duro y/o blando del propio organismo. Esto no es siempre posible por distintos motivos, y por lo tanto se utiliza en muchos casos material sintético como material de sustitución temporal (biodegradable o retirable después de la operación) o permanente.
Los implantes, que se anclan en el tejido duro y/o blando, sirven para la sustitución temporal o permanente o para el soporte de partes dañadas por accidente, desgaste, síndrome de deficiencia o por enfermedad o degeneradas de otro modo del cuerpo humano. Como implante se denomina normalmente un material artificial, químicamente estable, que se introduce en el cuerpo como sustitución plástica o para el refuerzo mecánico (véase por ejemplo Roche Lexikon Medizin, Urban & Fischer, (ed.) ; 5ª edición de 2003) . La función auxiliar y de sustitución en el cuerpo se adopta basándose en las propiedades mecánicas y en el diseño del implante. De este modo, desde hace muchos años, se utilizan clínicamente con éxito por ejemplo prótesis de cadera y de rodilla, implantes de columna vertebral y prótesis vasculares. Para el anclaje de implantes y la compatibilidad de implante en la superficie de contacto superficie de implante / tejido adyacente tiene una gran importancia la superficie de implante. Mediante una modificación de la superficie de implante puede acelerarse el proceso de curación.
Para el tratamiento de superficie y la estructuración de superficie se usan los más diversos métodos, véase por ejemplo Titanium in Medicine, Material Science, Surface Science, Engineering, Biological Responses and Medical Applications Series: Engineering Materials, (Brunette, D.M.; Tengvall, P.; Textor, M.; Thomsen, P. (Eds.) ) ; y las referencias allí mencionadas.
Está bien establecido por ejemplo el aumento de la rugosidad (para muchos véase Titanium in Medicine, Material Science, Surface Science, Engineering, Biological Responses and Medical Applications Series: Engineering Materials, (Brunette, D.M.; Tengvall, P.; Textor, M.; Thomsen, P. (Eds.) ) .
Además existen trabajos que describen la modificación química de superficies de implante para conseguir una mejor unión del hueso a la superficie de implante (Xue W, Liu X, Zheng X, Ding C, Biomaterials. 26 de junio de 2005 (16) : 3029-37) .
Planteamientos más recientes son modificaciones farmacéuticas de la superficie para acelerar la osteointegración de los implantes y/o promover o estimular la regeneración del tejido duro y/o blando circundante, por ejemplo con factores de crecimiento (Raschke MJ, Schmidmaier G. Unfallchirurg. Agosto de 2004; 107 (8) : 653-63) .
A diferencia de esto, pueden servir capas cargadas con sustancias activas para impedir reacciones indeseadas en implantes, por ejemplo prótesis vasculares (Hausleiter J, y col., Eur. Heart J. Agosto de 2005; 26 (15) : 1475-81. Epub 23 de junio de 2005) .
Otros grupos de medicamentos interesantes para la modificación de superficie farmacéutica son productos farmacéuticos, que se desarrollaron para el tratamiento sistémico de la osteoporosis, tales como por ejemplo calcitonina, ranelato de estroncio y distintos bisfosfonatos.
Los bisfosfonatos puede interpretarse como análogos estructurales del pirofosfato, en los que la agrupación PO-P está sustituida por una agrupación P-CP enzimáticamente estable. Mediante la sustitución de los átomos de hidrógeno en el átomo de C de la agrupación P-C-P se encuentran accesibles bisfosfonatos con diferentes elementos estructurales y propiedades. Bisfosfonatos conocidos, permitidos para la aplicación química son por ejemplo ácido pamidrónico, ácido alendrónico, ácido ibandrónico, ácido clodrónico o ácido etidrónico. En la medicina se han establecido bisfosfonatos para el tratamiento de enfermedades óseas metabólicas, en particular hipercalcemias asociadas con tumor, metástasis óseas osteolíticas así como osteoporosis postmenopáusica e inducida por glucocorticoides. Además algunos ensayos muestran que los bisfosfonatos pueden usarse para la prevención o para el tratamiento de reestenosis vascular (documento WO00/003677) .
En función de su estructura, los bisfosfonatos conocidos se diferencian en parte claramente en su eficacia terapéutica. Tienen un alto efecto terapéutico en particular aquellos bisfosfonatos que tienen en la unidad estructural entre los dos átomos de fósforo una función amino. A continuación estos compuestos se denominan aminobisfosfonatos.
El efecto farmacológico de los bisfosfonatos se basa en una alta afinidad hacia estructuras de fosfato de calcio de la superficie ósea, a consecuencia de lo cual se inhiben las células osteoclásticas (osteoclastos) , lo que lleva a una
reducción de la reabsorción ósea y al mismo tiempo a una reactivación de células osteoclásticas (osteoblastos) . Debido a la especial farmacocinética de los bisfosfonatos se prefiere una terapia local de dosis sistémica.
Basándose en este grado de conocimiento se han llevado a cabo en los últimos años numerosos ensayos, en los que se sometió a ensayo la inmovilización de bisfosfonatos seleccionados sobre implantes de tejido duro así como su acción sobre el comportamiento de encarnación del implantes respectivo.
De este modo, por ejemplo en el documento US 5.733.564, se describe el revestimiento de materiales (endoprótesis, tornillos, barras, etc.) con disoluciones acuosas de bisfosfonato con el objetivo de acelerar la reconstitución ósea alrededor del implante. La escasa adherencia de los bisfosfonatos sobre superficies de metal y su solubilidad en agua representan sin embargo una desventaja de este modo de proceder.
Yoshinari y col. (Biomaterials 23 (2002) , 2879-2885) muestran, por medio de estudios in vivo, que implantes de titanio puro, recubiertos con fosfato de calcio, que se impregnaron con una disolución acuosa de pamidronato, presentan una osteogénesis mejorada en la superficie de implante, que los implantes no impregnados con pamidronato. Debido a la alta afinidad de los bisfosfonatos hacia sustratos que contienen iones calcio, las superficies de fosfato de calcio representan un posible sustrato para la inmovilización de bisfosfonatos, dado que sobre estas superficies está dada la biodisponibilidad de los bisfosfonatos y con ello su eficacia terapéutica mediante interacción con iones calcio en mayor medida que sobre superficies en gran parte libres de iones calcio.
El documento WO-A-02/04038 describe una variante adicional de la inmovilización de bisfosfonatos en revestimientos que contienen hidroxiapatita de implantes óseos. Dado que los implantes metálicos desempeñan un papel dominante en la zona del tejido duro y, por otro lado, un revestimiento de fosfato de calcio de superficies de metal conlleva costes de fabricación elevados, se efectuaron en los últimos tiempos numerosos ensayos para modificar los materiales de implante metálicos, de modo que sobre ellos sea posible una inmovilización eficaz de bisfosfonato.
De este modo se conocieron trabajos en los que se introducen iones calcio por medio del implante de haz de electrones en la superficie de implantes de titanio (documento JP 2000070288, H. Kajiwara y col. Biomaterials 26 (2005) , 581-587) , para conseguir una adherencia mejorada de los bisfosfonatos. Este procedimiento tiene no obstante la desventaja de un coste de aparatos elevado.
Otros trabajos están dedicados a la deposición electrolítica de etidronato de calcio sobre titanio puro (K. Duan y col.
J. Biomed. Mater. Res.: Appl. Biomater. 72B (2005) , 43-51) , en la que si bien podían depositarse películas delgadas de bisfosfonato, sin embargo presentan heterogeneidades y con el secado mostraban fenómenos de contracción.
En el documento WO-A-2005/018699 se describen implantes metálicos recubiertos con bisfosfonato, que se produjeron de manera que en primer lugar se inmoviliza una capa de proteína, por ejemplo de fibrinógeno, sobre la superficie de metal. A esta capa de proteína se unen a continuación uno o varios bisfosfonatos covalentemente a través de grupos funcionales reactivos. Una desventaja esencial de este método se basa en el uso de reactivos tóxicos en la inmovilización o la reticulación de la capa de proteína y la unión covalente del bisfosfonato.
El... [Seguir leyendo]
Reivindicaciones:
1. Implante, excluyendo un implante dental, que presenta al menos por zonas un revestimiento en zonas de superficie que se encuentran al menos en contacto indirecto en estado implantado con tejido duro y/o blando, que contiene tanto un amino-bisfosfonato de fórmula general (H2O3P) -C (X) (Y) - (PO3H2) (I)
en la que X se selecciona de H, OH, Cl, F o de un grupo metilo Y es un grupo alquilo C1 -C7 lineal sustituido con NH2, N (CH3) 2, NH (CH3) , N (CH3) 3, piridinilo o imidazolilo, o sales farmacéuticamente compatibles o ésteres del mismo, como también al menos un componente anfífilo en forma de un sulfato de alquilo o carboxilato de alquilo C10-C20 lineal, no sustituido, o una mezcla de los mismos y/o un componente polimérico iónico soluble en agua con grupos aniónicos libres en forma de un derivado carboxilado, carboximetilado, sulfatado o fosforilado de polisacáridos naturales, encontrándose en el revestimiento el amino-bisfosfonato y el componente anfífilo o el amino-bisfosfonato y el componente polimérico iónico soluble en agua como sal mixta con baja solubilidad en agua.
2. Implante de acuerdo con la reivindicación 1, caracterizado por que la sal mixta presenta una solubilidad en agua pura de menos de 1 mg/ml a temperatura ambiente, en particular preferentemente de en el intervalo de menos de 0, 05 -0, 9 mg/ml a temperatura ambiente.
3. Implante de acuerdo con una de las reivindicaciones anteriores, caracterizado por que se trata de una estructura de soporte lisa o rugosa, porosa o no porosa, reforzada o no reforzada, en particular seleccionada del grupo: prótesis vascular, material de sustitución ósea, material de soporte óseo, matriz, lámina, barra, punzón, estructura, clavo, alambre, tornillo, placa, tubo, tubo flexible, componente de espuma polimérica con estructura de poro abierta, fibra, tejido, prótesis, en particular prótesis articulares, redes, jaulas, (cages) , espumas metálicas, revestimientos metálicos y cerámicos porosos, implantes alogénicos y xenogénicos, implantes cardiovasculares, ligamentos artificiales, discos intervertebrales artificiales, implantes intracorneales e intraoculares, prótesis cocleares, implantes activos, electrodos y/o combinaciones de los mismos.
4. Implante de acuerdo con una de las reivindicaciones anteriores, caracterizado por que en el caso del aminobisfosfonato se trata de ácido pamidrónico, ácido alendrónico, ácido neridrónico, ácido risedrónico, ácido zolendrónico, ácido olpadrónico, ácido ibandrónico, ácido minodrónico o ácido cimadrónico o una mezcla y/o sales de metales alcalinos o alcalinotérreos de los mismos, prefiriéndose en particular ácido pamidrónico y/o ácido alendrónico opcionalmente en forma de la sal de metal alcalino o alcalinotérreo.
5. Implante de acuerdo con una de las reivindicaciones anteriores, caracterizado por que el amino-bisfosfonato se encuentra en la forma de ácido fosfónico libre, la forma de sal de sodio, potasio, amonio, calcio, magnesio y/o estroncio.
6. Implante de acuerdo con una de las reivindicaciones anteriores, caracterizado por que en el caso del componente anfífilo se trata de laurato, estearato, palmitato, miristato, oleato, behenato, dodecilsulfato preferentemente como sales de metales alcalinos o alcalinotérreos o mezclas de los mismos.
7. Implante de acuerdo con una de las reivindicaciones anteriores, caracterizado por que en el caso del polisacárido natural del componente polimérico iónico soluble en agua se trata de un polisacárido seleccionado de dextrano, pululano, quitosano, almidón o celulosa o mezclas de los mismos.
8. Implante de acuerdo con una de las reivindicaciones anteriores, caracterizado por que el amino-bisfosfonato y el componente anfífilo en el revestimiento se encuentran en una relación en moles entre 10 : 1 y 1 : 5, en particular preferentemente en una relación en moles de 2:1 a 1:2.
9. Implante de acuerdo con una de las reivindicaciones anteriores, caracterizado por que el amino-bisfosfonato y el componente polimérico iónico soluble en agua en el revestimiento se encuentran en una relación en moles entre 10 : 1 y 1 : 5, en particular preferentemente en una relación en moles de 2:1 a 1:2, en cada caso con respecto a los grupos amino del bisfosfonato que contiene grupos amino utilizado y los grupos aniónicos presentes del componente polimérico.
10. Implante de acuerdo con una de las reivindicaciones anteriores, caracterizado por que el revestimiento está aplicado sobre una superficie lisa, porosa y/o rugosa sin soporte o portador.
11. Implante de acuerdo con una de las reivindicaciones anteriores, caracterizado por que se trata de un implante de base metálica y/o cerámica y/o polimérica y/o nativa, estando aplicado en particular preferentemente el
revestimiento directamente y sin capa intermedia sobre un implante de este tipo, y en el que preferentemente en el caso del implante se trata de cerámicas de fosfato de calcio, biovidrio, cerámicas de vidrio, carbonato de calcio, sulfato de calcio, polímeros orgánicos o materiales compuestos de los materiales mencionados, o se trata de superficies de implante de titanio puro, aleaciones de titanio, aleaciones de cobalto-cromo o acero fino, o se trata de superficies de implante nativas, que se componen preferentemente de colágeno, gelatina o materiales de origen alogénico.
12. Implante de acuerdo con una de las reivindicaciones anteriores, caracterizado por que el revestimiento después de la introducción en el tejido humano o animal o en el hueso humano o animal desprende el bisfosfonato de manera retardada al entorno.
13. Implante de acuerdo con una de las reivindicaciones anteriores, caracterizado por que el revestimiento presenta un grosor en el intervalo de 0, 1 -10, preferentemente de 0, 5 -5 μm.
14. Implante de acuerdo con una de las reivindicaciones anteriores, caracterizado por que se trata de un revestimiento seco, esencialmente libre de disolvente y esencialmente libre de agua.
15. Implante de acuerdo con una de las reivindicaciones anteriores, caracterizado por que el componente anfífilo presenta carácter aniónico, presentando en particular preferentemente una carga negativa monovalente o divalente.
16. Implante de acuerdo con una de las reivindicaciones anteriores, caracterizado por que el revestimiento se aplica como pasta o suspensión en un disolvente orgánico preferentemente en un proceso de pulverización o de inmersión y a continuación se seca por completo.
17. Procedimiento para la producción de un implante de acuerdo con una de las reivindicaciones anteriores, caracterizado por que se produce una suspensión o disolución o una mezcla de suspensión o disolvente, que contiene tanto un amino-bisfosfonato de fórmula general
(H2O3P) -C (X) (Y) - (PO3H2) (I)
en la que X se selecciona de H, OH, Cl, F o de un grupo metilo Y es un grupo alquilo C1 -C7 lineal sustituido con NH2, N (CH3) 2, NH (CH3) , N (CH3) 3, piridinilo o imidazolilo,
18. Procedimiento de acuerdo con la reivindicación 17, caracterizado por que en una primera etapa de revestimiento se aplica una disolución de un amino-bisfosfonato en un disolvente adecuado mediante inmersión, pulverización o goteo sobre la superficie que va a recubrirse y después de la evaporación o volatilización del disolvente en una segunda etapa de revestimiento se aplica un componente anfífilo y/o polimérico en un disolvente adecuado mediante inmersión, pulverización o goteo sobre la superficie que va a recubrirse previamente y después de la evaporación o volatilización del segundo disolvente mediante formación de sal in situ se forma un revestimiento que contiene bisfosfonato poco soluble en agua. 19. Procedimiento de acuerdo con una de las reivindicaciones 17 o 18, caracterizado por que las concentraciones de las disoluciones de revestimiento que contienen el amino-bisfosfosfonato y el componente anfífilo y/o el componente polimérico, se seleccionan de modo que en el revestimiento que se genera mediante formación de sal in situ el amino-bisfosfonato y el componente anfífilo se encuentran en una relación en moles entre 10 : 1 y 1 : 5, preferentemente entre 2:1 y 1:2. 20. Procedimiento de acuerdo con una de las reivindicaciones 17-19, caracterizado por que el bisfosfonato y el componente anfífilo y/o el componente polimérico iónico soluble en agua se producen mezclándose bisfosfonato disuelto en agua con componente anfífilo disuelto en agua o componente polimérico iónico soluble en agua y, opcionalmente después de la adición de sales adicionales, tales como por ejemplo cloruro de calcio, el producto de precipitación se aísla como sal mixta, y a continuación esta sal mixta se disuelve en una suspensión o un disolvente o mezcla de suspensión o disolvente o se suspende en la misma. 21. Procedimiento de acuerdo con una de las reivindicaciones 17-20, caracterizado por que como suspensión o disolvente o mezcla de suspensión o disolvente, se usan agua o uno o varios agentes de suspensión y/o disolventes orgánicos, así por ejemplo cloroformo como agente de suspensión o una mezcla de cloroformo y trietilenglicol preferentemente en la relación de 97, 5 : 2, 5 como disolvente. 22. Procedimiento de acuerdo con una de las reivindicaciones 17-21, caracterizado por que el revestimiento se aplica como pasta o suspensión en un disolvente orgánico preferentemente en un proceso de pulverización o de inmersión y a continuación se seca por completo. o sales farmacéuticamente compatibles o ésteres del mismo, como también al menos un componente anfífilo en forma de un sulfato de alquilo o carboxilato de alquilo C10-C20 lineal, no sustituido, o una mezcla de los mismos, y/o un componente polimérico iónico soluble en agua con grupos aniónicos libres en forma de un derivado carboxilado, carboximetilado, sulfatado o fosforilado de polisacáridos naturales, y el revestimiento se aplica mediante inmersión, pulverización o goteo de esta suspensión o disolución o de la mezcla de suspensión o disolvente sobre la superficie que va a recubrirse del implante y después de la evaporación
o volatilización de la suspensión o del disolvente o de la mezcla de suspensión o disolvente se forma un revestimiento que contiene amino-bisfosfonato poco soluble en agua.
Patentes similares o relacionadas:
Películas de proteína de múltiples capas, métodos de preparación y dispositivos de suministro de fármacos e implantes biomédicos que emplean las películas, del 15 de Julio de 2020, de AddBIO AB: Un implante biomédico que comprende un sustrato de implante y una película de proteína de múltiples capas en al menos una porción de la superficie del sustrato de implante, […]
Dispositivo médico que tiene un revestimiento que comprende ACCS, del 15 de Julio de 2020, de Noveome Biotherapeutics, Inc: Un dispositivo médico implantable que tiene un revestimiento en su superficie, útil para la implantación quirúrgica en el cuerpo de un sujeto, […]
Composición de fármaco y revestimiento asociado, del 1 de Julio de 2020, de W.L. GORE & ASSOCIATES, INC.: Un producto sanitario para administrar un agente terapéutico a un tejido, y el producto tiene una capa de revestimiento aplicada en una superficie del producto, y la capa […]
Matriz de soporte de injerto para reparación de cartílago y procedimiento de obtención de la misma, del 1 de Julio de 2020, de ETH ZURICH: Un procedimiento de proporción de una matriz de soporte de injerto para reparación de cartílagos, particularmente en un paciente humano, que comprende las etapas de: […]
Métodos y dispositivos para trasplante celular, del 10 de Junio de 2020, de Sernova Corporation: Un dispositivo para implantar células en un cuerpo huésped, que comprende: un andamio poroso que comprende al menos una cámara que tiene un extremo proximal y un extremo […]
Composiciones y métodos para el tratamiento de huecos óseos y fracturas abiertas, del 22 de Abril de 2020, de Polypid Ltd: Una composición farmacéutica que comprende partículas de relleno óseo recubiertas y no recubiertas en una proporción entre aproximadamente 1:3 […]
Procedimientos de preparación de un hidrogel esterilizado de modo terminal que proviene de matriz extracelular, del 22 de Abril de 2020, de UNIVERSITY OF PITTSBURGH OF THE COMMONWEALTH SYSTEM OF HIGHER EDUCATION: Un procedimiento de preparación de un material digerido de matriz extracelular esterilizado de modo terminal capaz de gelificar, que comprende: (i) solubilizar la matriz […]
Formulación de FGF-18 en hidrogeles de alginato/colágeno, del 15 de Abril de 2020, de Ares Trading SA: Un sistema de gelificación de dos componentes, en donde dicho sistema de gelificación se forma a partir de: a. un primer componente (solución 1) […]