Anticuerpos contra GDF8 y usos de los mismos.
Un anticuerpo anti-GDF8 o proteína de unión a antígeno que se une específicamente a GDF8 y que no se une específicamente a BMP11 que comprende:
una región variable pesada (VH) de anticuerpo que comprende la primera, segunda y tercera región determinante de la complementariedad (CDR) de la región VH definida por la secuencia de aminoácidos de SEC ID Nº: 14 o SEC ID Nº: 17; y una región variable ligera (VL) de anticuerpo que comprende la primera, segunda y tercera CDR de la región VL definida por la secuencia de aminoácidos de SEC ID Nº: 16 o SEC ID Nº: 18 en el que las CDR se definen usando el esquema de numeración de Kabat o el esquema de numeración de AcM.
Tipo: Patente Internacional (Tratado de Cooperación de Patentes). Resumen de patente/invención. Número de Solicitud: PCT/US2008/012338.
Solicitante: WYETH LLC.
Nacionalidad solicitante: Estados Unidos de América.
Dirección: 235 EAST 42ND STREET NEW YORK, NY 10017-5755 ESTADOS UNIDOS DE AMERICA.
Inventor/es: TAN,Xiang-Yang , CORCORAN,CHRISTOPHER JOHN, LAVALLIE,EDWARD ROLAND, COLLINS-RACIE,LISA ANNE, TCHISTIAKOVA,LIOUDMILA GENNADIEVNA, NOWAK,JOHN ADAM, KARIM,RIYEZ, MARQUETTE,KIMBERLY ANN, VELDMAN,GEERTRUIDA MACHTELD.
Fecha de Publicación: .
Clasificación Internacional de Patentes:
- C07K16/22 QUIMICA; METALURGIA. › C07 QUIMICA ORGANICA. › C07K PEPTIDOS (péptidos que contienen β -anillos lactamas C07D; ipéptidos cíclicos que no tienen en su molécula ningún otro enlace peptídico más que los que forman su ciclo, p. ej. piperazina diones-2,5, C07D; alcaloides del cornezuelo del centeno de tipo péptido cíclico C07D 519/02; proteínas monocelulares, enzimas C12N; procedimientos de obtención de péptidos por ingeniería genética C12N 15/00). › C07K 16/00 Inmunoglobulinas, p. ej. anticuerpos mono o policlonales. › contra factores de crecimiento.
PDF original: ES-2514518_T3.pdf




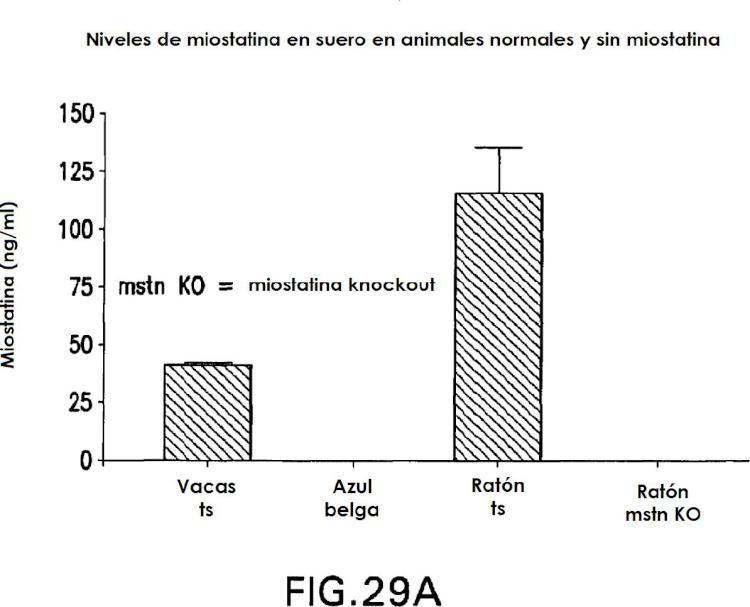
Fragmento de la descripción:
Anticuerpos contra GDF8 y usos de los mismos Campo de la invención El campo técnico de la invención se refiere al epítopo, o a epítopos, específicos contra el factor 8 de crecimiento y diferenciación (GDF8) y a antagonistas del mismo (por ejemplo, peptidométicos, anticuerpos anti-GDF8 (por ejemplo, anticuerpos de ratón, humanos y humanizados, fragmentos de los mismos, etc.) , polinucleótidos recombinantes, polinucleótidos inhibidores, etc.) que pueden usarse para inhibir la actividad de GDF8 in vitro y/o in vivo. Adicionalmente, el campo se refiere a procedimientos de inmunoensayo para la detección de GDF8 en muestras biológicas, así como a procedimientos de tratamiento, mejora, prevención, diagnóstico, pronóstico y/o monitorización de trastornos asociados con GDF8 (por ejemplo, trastornos musculares, trastornos neuromusculares, trastornos óseos degenerativos, trastornos óseos inducidos o metabólicos, trastornos del tejido adiposo, trastornos del metabolismo de la glucosa o trastornos relacionados con la insulina) , particularmente en mujeres potencialmente fértiles.
Antecedentes de la invención El factor 8 de crecimiento y diferenciación (GDF8) conocido también como miostatina, es una proteína segregada y un miembro de la superfamilia de factores de crecimiento estructuralmente relacionados del factor beta de crecimiento transformante (TGF-β) . Los miembros de esta superfamilia poseen propiedades reguladoras del crecimiento y morfogenéticas (Kingsley y col. (1994) Genes Dev. 8: 133-46; Hoodless y col. (1998) Curr. Topics Microbiol. Immunol. 228: 235-72) . El GDF8 humano se sintetiza como una proteína precursora de 375 aminoácidos que forma un complejo homodimérico. Durante el procesamiento, el propéptido amino-terminal, conocido como "péptico asociado con latencia" (PAL) , se escinde y puede permanecer unido al homodímero de manera no covalente, formando un complejo inactivo denominado "complejo latente pequeño" (Miyazono y col. (1988) J. Biol. Chem. 263: 6407-15; Wakefield y col. (1988) J. Biol. Chem. 263: 7646-54; Brown y col. (1999) Growth Factors 3: 3543; Thies y col. (2001) Growth Factors 18: 251-59; Gentr y y col. (1990) Biochemistr y 29: 6851-57; Der y nck y col. (1995) Nature 316: 701-05; Massague (1990) Ann. Rev. Cell Biol. 12: 597-641) . Proteínas, tales como folistatina y proteínas relacionadas con folistatina, incluyen GASP-1 (Gamer y col. (1999) Dev Biol. 208: 222-232, publicación de patente en Estados Unidos nº 2003-0180306-A1; publicación de patente en Estados Unidos Nº 2003-0162714-A1) y se unen a homodímeros de GDF8 maduros e inhiben la actividad biológica de GDF8.
Un alineamiento de la secuencia de aminoácidos deducida de GDF8 de diversas especias demuestra que GDF8 está muy conservado (McPherron y col. (1997) Proc. Natf. Acad. Sci. U.S.A. 94: 12457-61) . Las secuencias de GDF8 de ser humano, ratón, rata, cerdo y pollo son 100 % idénticas en la región C-terminal, mientras que el GDF8 de babuino, de ganado bovino y ovino difiere en un oligómero de 3 aminoácidos en el extremo C. El alto grado de conservación de GDF8 entre especies sugiere que GDF8 tiene una función fisiológica esencial.
GDF8 ha mostrado que desempeña una función principal en la regulación del desarrollo y homeostasis muscular inhibiendo tanto la proliferación como la diferenciación de mioblastos y células satélite (Lee y McPherron (1999) Curr. Opin. Genet. Dev. 9: 604-7; McCrosker y y col. (2003) J. Cell. Biol. 162: 1135-47) . Se expresa precozmente en músculo esquelético en desarrollo y continúa expresándose en músculo esquelético en adultos, preferentemente en tipos de contracción rápida. GDF8 también se ha implicado en la producción de enzimas específicas de músculo (por ejemplo, creatina quinasa) y en la proliferación de mioblastos (documento WO 00/43781) .
La sobreexpresión de GDFB en ratones adultos produce una pérdida muscular significativa (Zimmers y col. (2002) Science 296: 1486-88) . De manera similar, diversos estudios realizados indican que la expresión aumentada de GDF8 está asociada con desgaste muscular inducido por el VIH (Gonzalez-Cadavid y col. (1998) Proc. Natl. Acad. Sci. U.S.A. 95: 14938-43) . En cambio, ratones transgénicos GDF8 genosuprimidos (knockout) se caracterizan por una notable hipertrofia e hiperplasia del músculo esquelético y por una estructura ósea cortical alterada (McPherron y col. (1997) Nature 387: 83-90; Hamrick y col. (2000) Bone 27: 343-49) . Además, las mutaciones naturales han mostrado que inactivan el gen de GDF8 producen hipertrofia e hiperplasia tanto en animales como en seres humanos (Lee y McPherron (1997) , citado anteriormente) . Por ejemplo, en ganado, aumentos en la masa del músculo esquelético son obvios en mutaciones de GDF8 naturales (Ashmore y col. (1974) Growth 38: 501-07; Swatland y col. (1994) J. Anim. Sci. 38: 752-57; McPherron y col., citado anteriormente; Kambadur y col. (1997) Genome Res. 7: 910-15) .
Diversos trastornos musculares y óseos en seres humanos y animales están asociados con tejido muscular funcionalmente deteriorado, y por tanto, también pueden asociarse con GDF8. Por ejemplo, GDF8 puede estar implicado en la patogénesis de esclerosis lateral amiotrófica ("ELA") , distrofia muscular ("DM"; incluyendo distrofia muscular de Duchenne, distrofia muscular facioescapular y distrofia muscular facioescapulohumeral) , atrofia muscular, síndrome del túnel carpiano, atrofia orgánica, fragilidad, enfermedad pulmonar obstructiva congestiva (EPOC) , sarcopenia, caquexia, y síndromes de desgaste muscular producidos por otras enfermedades y afecciones.
También se cree que GDF8 participa en otros numerosos procesos fisiológicos y trastornos relacionados, incluyendo homeostasis de la glucosa durante el desarrollo de la diabetes de tipo 2, tolerancia alterada a glucosa, síndromes metabólicos (es decir, síndromes (por ejemplo, síndrome X) que implican la aparición simultánea de un grupo de afecciones de la salud (que pueden incluir insulinorresistencia, obesidad abdominal, dislipidemia, hipertensión, inflamación crónica, y estado protrombótico, etc.) que pone a una persona en alto riesgo para la diabetes de tipo 2 y/o enfermedad cardíaca) , insulinorresistencia (por ejemplo, resistencia inducida por traumatismos, tales como quemaduras o desequilibrio de nitrógeno) , y trastornos del tejido adiposo (por ejemplo, obesidad, dislipidemia, enfermedad hepática grasa no alcohólica, etc.) (Kim y col. (2000) Biochem. Biophys. Res. Comm. 281: 902-06) . Actualmente, para tratar estos trastornos existen terapias poco fiables o eficaces. La patología de estos procesos apunta al GDF8 como una posible diana en el tratamiento de estos trastornos relacionados.
Además de trastornos neuromusculares en seres humanos, también hay afecciones relacionadas con el factor de crecimiento asociadas con una pérdida de hueso, tales como osteoporosis y artrosis, que afectan predominantemente a mujeres mayores y/o postmenopáusicas. Dichas enfermedades y trastornos óseos metabólicos incluyen reducción de masa ósea debido a terapia crónica con glucocorticoides, disfunción gonadal prematura, supresión de andrógenos, déficit de vitamina D, hiperparatiroidismo secundario, deficiencias nutricionales y anorexia nerviosa. Aunque muchas terapias actuales para estas afecciones actúan inhibiendo la reabsorción ósea, un tratamiento alternativo útil sería una terapia que promoviese la formación de hueso. Dado que GDF8 desarrolla una función en el desarrollo óseo, así como en el desarrollo muscular, GDF8 es también una excelente diana farmacológica para el tratamiento de trastornos óseo degenerativos.
Al igual que otros miembros de la familia del factor-β de crecimiento transformante (TGF-β) , GDF8 se sintetiza como una proteína precursora de 376 aminoácidos que contiene una secuencia señal, un dominio propeptídico N-terminal y un dominio C-terminal considerado como la molécula activa. GDF8 se segrega en una forma latente uniéndose a su propéptido (péptido asociado con latencia, PAL) ; el procesamiento proteolítico entre el dominio propeptídico y el dominio C-terminal produce un propéptido N-terminal y la forma madura de GDF8. La forma tanto no procesada como madura de GDF8 forma dímeros unidos por enlaces disulfuro, y el dímero de GDF8 procesado representa la única forma activa de la proteína. En suero, así como en músculo esquelético, GDF8 puede encontrarse unido a diversas proteínas que pueden modular su activación, secreción o unión a receptores.
GDF8 ejerce sus efectos a través de una familia de receptores heterotetrámericos de serina/treonina quinasa transmembrana, cuya activación potencia la transfosforilacion de los receptores, lo que conduce a la estimulación de la actividad... [Seguir leyendo]
Reivindicaciones:
1. Un anticuerpo anti-GDF8 o proteína de unión a antígeno que se une específicamente a GDF8 y que no se une específicamente a BMP11 que comprende:
una región variable pesada (VH) de anticuerpo que comprende la primera, segunda y tercera región determinante de la complementariedad (CDR) de la región VH definida por la secuencia de aminoácidos de SEC ID Nº : 14 o SEC ID Nº : 17; y una región variable ligera (VL) de anticuerpo que comprende la primera, segunda y tercera CDR de la región VL definida por la secuencia de aminoácidos de SEC ID Nº : 16 o SEC ID Nº : 18 en el que las CDR se definen usando el esquema de numeración de Kabat o el esquema de numeración de AcM.
2. Un anticuerpo anti-GDF8 o proteína de unión a antígeno que se une específicamente a GDF8 y que no se une específicamente a BMP11 que comprende:
- una cadena pesada que comprende una primera, segunda y tercera región determinante de la complementariedad (CDR) , en la que la primera CDR comprende la secuencia de aminoácidos SEC ID Nº : 19 o SEC ID Nº : 25; en la que la segunda CDR comprende la secuencia de aminoácidos SEC ID Nº : 20 o SEC ID Nº : 26, y en la que la tercera CDR comprende la secuencia de aminoácidos seleccionada de SEC ID Nº : 21 o SEC ID Nº : 27, y -una cadena ligera que comprende una primera, segunda y tercera CDR, en la que la primera CDR comprende la secuencia de aminoácidos SEC ID Nº : 22 o SEC ID Nº : 28; en la que la segunda CDR comprende la secuencia de aminoácidos SEC ID Nº : 23 o SEC ID Nº : 29, y en la que la tercera CDR comprende la secuencia de aminoácidos SEC ID Nº : 24 o SEC ID Nº : 30.
3. El anticuerpo anti-GDF8 o proteína de unión a antígeno de la reivindicación 1 o 2, en el que dicha cadena pesada comprende una secuencia de aminoácidos seleccionada del grupo que consiste en: la secuencia de aminoácidos de la SEC ID Nº : 14; y la secuencia de aminoácidos de la SEC ID Nº : 17.
4. El anticuerpo anti-GDF8 o proteína de unión a antígeno de la reivindicación 1 o 2, en el que dicha cadena ligera comprende una secuencia de aminoácidos seleccionada del grupo que consiste en: la secuencia de aminoácidos de la SEC ID Nº : 16; y la secuencia de aminoácidos de la SEC ID Nº : 18.
5. El anticuerpo anti-GDF8 o proteína de unión a antígeno de la reivindicación 1 o 2, en el que dicha cadena ligera comprende una secuencia de aminoácidos de SEC ID Nº : 16; y dicha cadena pesada comprende la secuencia de aminoácidos de SEC ID Nº : 14.
6. El anticuerpo anti-GDF8 o proteína de unión a antígeno de la reivindicación 1 o 2, en el que dicha cadena ligera comprende la secuencia de aminoácidos de SEC ID Nº : 18; y en el que el anticuerpo comprende además una cadena pesada que comprende la secuencia de aminoácidos de SEC ID Nº : 17.
7. Un anticuerpo anti-GDF8 o proteína de unión a antígeno que se une específicamente a GDF8 y que no se une específicamente a BMP11, en el que dicho anticuerpo o proteína de unión a antígeno se une a un epítopo seleccionado de SEC ID Nº : 4, SEC ID Nº : 6, SEC ID Nº : 8, SEC ID Nº : 10 y SEC ID Nº : 12.
8. El anticuerpo anti-GDF8 o proteína de unión a antígeno de una cualquiera de las reivindicaciones 1 a 7, en el que dicha cadena ligera comprende un dominio constante de cadena ligera kappa o lambda.
9. El anticuerpo anti-GDF8 o proteína de unión a antígeno de una cualquiera de las reivindicaciones 1 a 8, en el que dicha cadena pesada comprende un dominio constante pesado seleccionado del grupo que consiste en dominios constantes pesados de IgA, IgE, IgD, IgG e IgM.
10. El anticuerpo anti-GDF8 o proteína de unión a antígeno de una cualquiera de las reivindicaciones 1 a 9, en el que dicha cadena pesada está mutada para alterar una función efectora de dominio constante pesado.
11. El anticuerpo anti-GDF8 o proteína de unión a antígeno de una cualquiera de las reivindicaciones 1 a 10, en el que dicho anticuerpo anti-GDF8 o proteína de unión a antígeno está parcial o totalmente humanizada.
12. El anticuerpo anti-GDF8 o proteína de unión a antígeno de una cualquiera de las reivindicaciones 1 a 11, en el que dicho anticuerpo anti-GDF8 o proteína de unión a antígeno inhibe específicamente la señalización por GDF8 pero no por BMP11.
13. Un polinucleótido que codifica el anticuerpo anti-GDF8 o proteína de unión a antígeno de una cualquiera de las reivindicaciones 1 a 12.
14. El polinucleótido de acuerdo con la reivindicación 13, en el que dicho polinucleótido comprende la secuencia de ácido nucleico de SEC ID Nº : 13 o SEC ID Nº : 15.
15. Un polinucleótido que se hibrida en condiciones rigurosas con el polinucleótido de la reivindicación 14 o con su complementario.
16. Un vector que comprende el polinucleótido de una cualquiera de las reivindicaciones 13 a 15, en el que el polinucleótido se une operativamente a una secuencia reguladora.
17. Una célula hospedadora que comprende el vector de la reivindicación 16.
18. Un procedimiento de producción de un anticuerpo anti-GDF8 o proteína de unión a antígeno que comprende el cultivo de la célula hospedadora de la reivindicación 17, y el aislamiento del anticuerpo anti-GDF8 o proteína de unión a antígeno que expresa dicha célula hospedadora.
19. El anticuerpo anti-GDF8 o proteína de unión a antígeno aislados producidos por el procedimiento de la reivindicación 18.
20. Un anticuerpo anti-GDF8 o proteína de unión a antígeno de acuerdo con una cualquiera de las reivindicaciones 1 a 12 para su uso en el tratamiento de distrofia muscular, esclerosis lateral amiotrófica (ELA) , sarcopenia, caquexia, desgaste muscular, atrofia muscular, fragilidad, distrofia muscular seudohipertrófica, distrofia muscular facioescapulohumeral, distrofia muscular de la cintura, distrofia muscular de Duchenne, distrofia muscular de Becker, distrofia muscular de Emer y Dreifuss, síndrome de espina rígida, síndrome de Ullrich, distrofia muscular de Fukuyama, síndrome de Walker Warberg, enfermedad muscular óculocerebral, distrofia muscular congénita, distrofia miotónica (Enfermedad de Steinart) , enfermedad de Gower, trastorno de tejido adiposo, obesidad, un trastorno metabólico, diabetes, prediabetes, tolerancia alterada a glucosa, dislipidemia, síndrome metabólico, insulinorresistencia inducida por traumatismo, trastorno de pérdida ósea, osteoporosis, osteoporosis inducida por glucocorticoides, osteopenia, artritis, fracturas relacionadas con osteoporosis, pérdida de hueso producida por terapia crónica con glucocorticoides, pérdida ósea producida por disfunción gonadal prematura, pérdida ósea producida por supresión de andrógenos, pérdida ósea producida por déficit de vitamina D, pérdida ósea producida por hiperparatiroidismo secundario, pérdida ósea producida por déficits nutricionales y pérdida ósea producida por anorexia nerviosa.
21. El anticuerpo anti-GDF8 o proteína de unión a antígeno de la reivindicación 20 para su uso en el tratamiento de distrofia muscular de Duchenne.
Patentes similares o relacionadas:
 Métodos para producir proteínas bicatenarias en bacterias, del 29 de Julio de 2020, de GENENTECH, INC.: Un método para producir un receptor de linfocitos T monoclonal de movilización inmunitaria contra el cáncer (ImmTAC) que comprende una cadena alfa del receptor de linfocitos […]
Métodos para producir proteínas bicatenarias en bacterias, del 29 de Julio de 2020, de GENENTECH, INC.: Un método para producir un receptor de linfocitos T monoclonal de movilización inmunitaria contra el cáncer (ImmTAC) que comprende una cadena alfa del receptor de linfocitos […]
Método para el tratamiento de la osteoporosis, del 22 de Julio de 2020, de AMGEN INC.: Un anticuerpo antiesclerostina que comprende una CDR-H1 de la SEQ ID NO: 245, una CDR-H2 de la SEQ ID NO: 246, una CDR-H3 de la SEQ ID NO: 247, […]
Anticuerpo anti-FGF23 y composición farmacéutica que comprende el mismo, del 15 de Julio de 2020, de Kyowa Kirin Co., Ltd: Anticuerpo o fragmento funcional del mismo que se une a la totalidad o a una parte del epítopo de FGF23 humano, al que se une un anticuerpo producido […]
Anticuerpos scFv que pasan las capas epitelial y/o endotelial, del 1 de Julio de 2020, de ESBATech, an Alcon Biomedical Research Unit LLC: Un anticuerpo monocatenario (scFv) que comprende: (a) un dominio variable de la cadena ligera (VL) que tiene tres regiones CDR de VL no […]
 Tratamiento del cáncer usando inhibidores de TGF-beta y PD-1, del 24 de Junio de 2020, de XOMA TECHNOLOGY LTD.: Un inhibidor del factor de crecimiento transformante beta (TGFβ) y un inhibidor de la proteina de muerte celular programada 1 (PD-1) para usar en un metodo […]
Tratamiento del cáncer usando inhibidores de TGF-beta y PD-1, del 24 de Junio de 2020, de XOMA TECHNOLOGY LTD.: Un inhibidor del factor de crecimiento transformante beta (TGFβ) y un inhibidor de la proteina de muerte celular programada 1 (PD-1) para usar en un metodo […]
Métodos para el tratamiento de la enfermedad ocular en sujetos humanos, del 10 de Junio de 2020, de Clearside Biomedical, Inc: Una formulación farmacéutica que comprende un fármaco para su uso en un método de tratamiento de un trastorno ocular posterior en un sujeto humano que […]
Método para tratar la pérdida de hueso alveolar mediante el uso de anticuerpos antiesclerostina, del 3 de Junio de 2020, de AMGEN INC.: Un anticuerpo antiesclerostina para su uso en un método para aumentar la altura del hueso alveolar en un sujeto que padece pérdida de hueso alveolar, donde […]
Proteínas de captura de la superficie celular recombinantes, del 13 de Mayo de 2020, de REGENERON PHARMACEUTICALS, INC.: Un método para detectar y aislar células que producen altos niveles de una proteína heterodimérica que tiene una primera subunidad y una segunda subunidad, […]