Anticuerpo monoclonal humano que neutraliza el receptor del factor de crecimiento endotelial vascular y uso del mismo.
Una molécula de fragmento variable de cadena sencilla (ScFv) que contiene una región variable de cadena ligerarepresentada por una secuencia de aminoácidos de una cualquiera de las SEQ ID NOs:
1 a 19 y actúa neutralizandoel receptor del factor de crecimiento endotelial vascular, y donde la molécula de ScFv tiene una región variable decadena pesada representada por una secuencia de aminoácidos de la SEQ ID NO: 20.
Tipo: Patente Internacional (Tratado de Cooperación de Patentes). Resumen de patente/invención. Número de Solicitud: PCT/KR2007/003077.
Solicitante: PharmAbcine Inc.
Nacionalidad solicitante: República de Corea.
Dirección: 412 Daejeon bioventure town 461-8, Jeonming-dong, Yuseong-gu Daejeon 305-390 REPUBLICA DE COREA.
Inventor/es: KIM, KWI, HWA, PARK, YOUNG WOO, JANG,HYUN-SOOK, KIM,Sung-Woo, KOH,Sang-seok, KWON,YOUNG GUEN, YUN,CHAE OK, YOO,JIN SAN, LEE,WEON SUP, SHIM,SANG RYEOL, PARK,MI HEE, KANG,JEONG EUN, KIM,DO YUN, LEE,JOON CHUL, LEE,DONG HEON, CHO,TOO HYON, SUL,SAM SOOK, PYUN,BO JEONG, KIM,NAHM JU, JEON,JAE WON, LEE,DONG SUP, RHA,GEUN BAE, YOO,HYEON MI, KIM,SEMI.
Fecha de Publicación: .
Clasificación Internacional de Patentes:
- C07K16/00 QUIMICA; METALURGIA. › C07 QUIMICA ORGANICA. › C07K PEPTIDOS (péptidos que contienen β -anillos lactamas C07D; ipéptidos cíclicos que no tienen en su molécula ningún otro enlace peptídico más que los que forman su ciclo, p. ej. piperazina diones-2,5, C07D; alcaloides del cornezuelo del centeno de tipo péptido cíclico C07D 519/02; proteínas monocelulares, enzimas C12N; procedimientos de obtención de péptidos por ingeniería genética C12N 15/00). › Inmunoglobulinas, p. ej. anticuerpos mono o policlonales.
PDF original: ES-2450933_T3.pdf
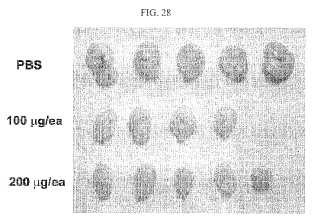
Fragmento de la descripción:
Anticuerpo monoclonal humano que neutraliza el receptor del factor de crecimiento endotelial vascular y uso del mismo.
Campo técnico La presente invención se refiere a anticuerpos monoclonales humanos que neutralizan el receptor del factor de crecimiento endotelial vascular y al uso de los mismos y, más particularmente, a moléculas de ScFv humanas que neutralizan el receptor del factor de crecimiento endotelial vascular, a una composición para inhibir la angiogénesis y a una composición para el tratamiento del cáncer, que contienen las moléculas de ScFv humanas.
Antecedentes de la técnica La angiogénesis significa la formación de nuevos vasos sanguíneos a partir de vasos preexistentes por el crecimiento, diferenciación y migración de células endoteliales y no se produce en adultos sanos, excepto en algunas ocasiones especiales que incluyen la curación de heridas, menstruación, etc. Sin embargo, se ha indicado una formación excesiva de nuevos vasos sanguíneos en enfermedades tales como el crecimiento tumoral y la metástasis, la degeneración macular asociada a la edad, la artritis reumatoide, la retinopatía diabética, la psoriasis y la inflamación crónica (Cameliet y Jain, Nature, 407: 249, 2000) . Por esta razón, se han realizado muchos intentos de tratar enfermedades, particularmente tumores, usando inhibidores de la angiogénesis.
Los factores implicados en la angiogénesis incluyen el factor del crecimiento endotelial vascular (VEGF) , el factor de crecimiento epitelial (EGF) , el factor de crecimiento derivado de plaquetas (PDGF) , el factor de crecimiento transformante b (TGFb) , el factor de crecimiento de fibroblastos (FGF) , etc. Entre ellos, el factor de crecimiento endotelial vascular es un factor específico de células endoteliales que está implicado directamente en el crecimiento, diferenciación y migración de células endoteliales, y existen cuatro isoformas diferentes (VEGF165, VEGF121, VEGF189 y VEGF206) . Entre las cuatro isoformas, el VEGF 165 es la isoforma más abundante en todos los tejidos humanos excepto en el de la placenta (Tisher et al., J. Biol. Chem., 266: 11947, 1991) .
El factor de crecimiento endotelial vascular (VEGF) regula la formación de nuevos vasos sanguíneos debida a la diferenciación de precursores endoteliales (angioblastos) in situ, se expresa en tejidos embrionarios (Breier et al., Development (Camb) , 114: 521, 1992) , macrófagos y queratinocitos epiteliales en proliferación durante la curación de heridas (Brown et al., J. Exp. Med., 176: 1375, 1992) y puede ser responsable del edema tisular asociado con la inflamación (Ferrara et al., Endocr. Rev., 13: 18, 1992) . Ciertos estudios de hibridación in situ han demostrado una alta expresión de VEGF en varias líneas tumorales humanas incluyendo las del glioblastoma multiforme, hemangioblastoma, neoplasias del sistema nervioso central y sarcoma de Kaposi asociado con el SIDA (Plate et al., Nature, 359: 845, 1992; Plate et al., Cancer Res., 53: 5822, 1993; Berkman et al., J. Clin. Invest., 91: 153, 1993; Nakamura et al., AIDS Weekly, 13 (1) , 1992) . También se han observado altos niveles de VEGF en la angiogénesis inducida por hipoxia (Shweiki et al., Nature, 359: 843, 1992) .
La función biológica del VEGF está mediada por los receptores de VEGF de alta afinidad que se expresan selectivamente en las células endoteliales durante la embriogénesis (Millauer et al., Cell, 72: 835, 1993) y durante la formación de tumores. Los receptores de VEGF (VEGFR) típicamente son tirosina quinasas de tipo receptor de clase III caracterizadas por tener varios bucles, típicamente 5 o 7, de tipo inmunoglobulina en el dominio de unión al ligando extracelular amino-terminal del receptor (Kaipainen et al., J. Exp. Med., 178: 2027, 1993) . Las otras dos regiones incluyen una región transmembrana y un dominio catalítico intracelular carboxilo-terminal interrumpido por una inserción de secuencias interquinasa hidrófilas de longitudes variables, denominada dominio de inserto de quinasa (Terman et al., Oncogene, 6: 1677, 1991) . Los receptores de VEGF incluyen receptores con función tirosina quinasa de tipo fms (Flt-1) , o VEGFR-1 (Shibuya et al., Oncogene, 5: 519, 1990; documento WO 92/14248; Terman et al., Oncogene, 6: 1677, 1991) , y receptores que contienen dominio de inserto de quinasa/quinasa de hígado fetal (KDR/Flk-1) , o VEGFR-2 (Matthews et al., PNAS, 88: 9026, 1991) , aunque también pueden unirse a VEGF otros receptores tales como la neuropilina-1 y la neuropilina-2. Otro receptor de tirosina quinasa, VEGFR-3 (Flt-4) , se une a los homólogos de VEGF VEGF-C y VEGF-D y es importante en el desarrollo de vasos linfáticos.
Lu D. et al.; International Journal of Cancer, Vol. 97, Nº 3, 20 de enero de 2002 () , páginas 393-399, divulga la selección de anticuerpos neutralizantes humanos de alta afinidad para VEGFR2 a partir de una gran biblioteca de presentación de fagos de anticuerpos para una terapia antiangiogénica.
Zhu Z. et al.; Cancer Research, Vol. 58, Nº 15, 1 de agosto de 1998 () , páginas 3209-3214, divulga la inhibición de la activación del receptor inducido por el factor de crecimiento endotelial vascular con anticuerpos monocatenarios anti-receptor que contiene dominio de inserto de quinasa obtenidos de una biblioteca de presentación de fagos.
Lu D. et al.; Journal of Biological Chemistr y , Vol. 278, Nº 44, 12 de agosto de 2003 () , páginas 4349643507 divulga la adaptación de la selección in vitro de anticuerpos humanos de afinidad en el intervalo picomolar dirigidos contra el receptor del factor de crecimiento endotelial vascular 2 para aumentar la actividad neutralizante.
Zhang Haifan et al., Leukemia and Lymphoma, Vol. 45, Nº 9, 1 de septiembre de 2004 () , páginas 18871897 divulga la inhibición del crecimiento tanto autocrino como paracrino de la leucemia humana con un anticuerpo completamente humano dirigido contra el receptor del factor de crecimiento endotelial vascular 2.
Miao H Q et al., Biochemical and Biophysical Research Communications, Vol. 345, Nº 1, 23 de junio de 2006 (23-062006) , páginas 438-445, divulga la potente neutralización de las actividades biológicas de VEGF con un fragmento Fab de anticuerpo completamente humano dirigido contra el receptor de VEGF 2.
El documento US-5.874.542 divulga anticuerpos monoclonales que se unen específicamente a un dominio extracelular de un receptor de VEGF y neutralizan la activación del receptor.
El documento US-6.524.583 B1 divulga anticuerpos que inhiben específicamente la unión de VEGF a solamente uno (VEGFR2) de los dos receptores de VEGF.
El documento WO 03/075840 A2 divulga un anticuerpo que se une a KDR con una afinidad comparable a o mayor que la del VEGF humano, y que neutraliza la activación de KDR.
Las células endoteliales que se infiltran en los gliomas expresan altos niveles de Flk-1 (Plate et al., Nature, 359: 845, 1992) . Los niveles de Flk-1 están regulados positivamente de forma específica por el VEGF producido por los glioblastomas humanos (Plate et al., Cancer Res., 53: 5822, 1993) .
El descubrimiento de altos niveles de expresión de Flk-1 en células endoteliales asociadas a glioblastomas (GAEC) indica que la actividad del receptor probablemente se induce durante la formación del tumor, ya que apenas se pueden detectar transcritos de Flk-1 en las células endoteliales cerebrales normales. Esta regulación positiva se limita a las células endoteliales vasculares muy próximas al tumor. El bloqueo de la actividad de VEGF con anticuerpos monoclonales (mAb) anti-VEGF neutralizantes dio como resultado la inhibición del crecimiento de xenoinjertos tumorales humanos en ratones desnudos (Kim, K. et al., Nature, 362: 841-844, 1993) , lo que indica un papel directo de VEGF en la angiogénesis relacionada con tumores.
Aunque los ligandos de VEGF están regulados positivamente en las células tumorales y sus receptores están regulados positivamente en las células endoteliales vasculares infiltradas en los tumores, los niveles de expresión de los ligandos de VEGF y sus receptores son bajos en las células normales que no están asociadas con la angiogénesis. Por lo tanto, dichas células normales bloquearían la interacción entre VEGF y sus receptores para inhibir la angiogénesis, inhibiendo de este modo el crecimiento tumoral.
Las células endoteliales que se infiltran en gliomas expresan altos niveles de VEGFR-2, y están regulados positivamente de forma específica por el VEGF producido por los glioblastomas humanos (Plate et al., Nature, 359: 845, 1992; Plate et al., Cancer Res., 53: 5822, 1993) . El descubrimiento de altos niveles de expresión de VEGR-2 en células endoteliales asociadas a glioblastomas (GAEC) sugiere que la actividad... [Seguir leyendo]
Reivindicaciones:
1. Una molécula de fragmento variable de cadena sencilla (ScFv) que contiene una región variable de cadena ligera representada por una secuencia de aminoácidos de una cualquiera de las SEQ ID NOs: 1 a 19 y actúa neutralizando el receptor del factor de crecimiento endotelial vascular, y donde la molécula de ScFv tiene una región variable de cadena pesada representada por una secuencia de aminoácidos de la SEQ ID NO: 20.
2. Un ADN que codifica la molécula de ScFv (fragmento variable de cadena sencilla) de la reivindicación 1.
3. Un vector que contiene el ADN de la reivindicación 2.
4. Células recombinantes transformadas con el vector de la reivindicación 3.
5. Las células recombinantes de acuerdo con la reivindicación 4, donde las células son células bacterianas o animales.
6. Una composición para uso en un método de tratamiento que comprende inhibir la angiogénesis, que contiene la molécula de ScFv de la reivindicación 1.
7. Una composición para uso en un método para el tratamiento del cáncer, que contiene la molécula de ScFv de la reivindicación 1.
8. Un IgG que contiene una región variable de cadena ligera representada por una secuencia de aminoácidos de una cualquiera de las SEQ ID NOs: 1 a 19 y que actúa neutralizando el receptor del factor de crecimiento endotelial vascular, y donde la IgG tiene una región variable de cadena pesada representada por una secuencia de aminoácidos de la SEQ ID NO: 20.
9. Una composición para uso en un método de tratamiento que comprende inhibir la angiogénesis, que contiene la IgG de la reivindicación 8.
10. Una composición para uso en un método para el tratamiento del cáncer, que contiene la IgG de la reivindicación
8.
Patentes similares o relacionadas:
 Métodos para producir proteínas bicatenarias en bacterias, del 29 de Julio de 2020, de GENENTECH, INC.: Un método para producir un receptor de linfocitos T monoclonal de movilización inmunitaria contra el cáncer (ImmTAC) que comprende una cadena alfa del receptor de linfocitos […]
Métodos para producir proteínas bicatenarias en bacterias, del 29 de Julio de 2020, de GENENTECH, INC.: Un método para producir un receptor de linfocitos T monoclonal de movilización inmunitaria contra el cáncer (ImmTAC) que comprende una cadena alfa del receptor de linfocitos […]
 Animales no humanos que tienen un locus de cadena ligera lambda de inmunoglobulina modificado por ingeniería, del 29 de Julio de 2020, de REGENERON PHARMACEUTICALS, INC.: Un roedor cuyo genoma de la línea germinal comprende un locus de cadena ligera λ de inmunoglobulina endógeno que comprende:
(a) uno o más segmentos […]
Animales no humanos que tienen un locus de cadena ligera lambda de inmunoglobulina modificado por ingeniería, del 29 de Julio de 2020, de REGENERON PHARMACEUTICALS, INC.: Un roedor cuyo genoma de la línea germinal comprende un locus de cadena ligera λ de inmunoglobulina endógeno que comprende:
(a) uno o más segmentos […]
Composiciones farmacéuticas que contienen una leucocidina E mutada, del 22 de Julio de 2020, de NEW YORK UNIVERSITY: Una composición que comprende: una proteína Leucocidina E (LukE) aislada que comprende la secuencia de aminoácidos de la SEQ ID NO: 4, o un polipéptido […]
Formulación anti-IFNAR1 estable, del 24 de Junio de 2020, de ASTRAZENECA AB: Una formulacion de anticuerpo que comprende: a. De 100 mg/ml a 200 mg/ml de anifrolumab; b. Lisina HCl 40 mM a 60 mM; c. Trehalosa […]
Proteínas y péptidos modificados, del 24 de Junio de 2020, de GLAXO GROUP LIMITED: Un dominio variable de inmunoglobulina único, que se une a TNFR1 y que se selecciona de cualquiera de las siguientes secuencias de aminoácidos: (a) DOM1h-131-206 caracterizada […]
Métodos para purificar una proteína objetivo de una o más impurezas en una muestra, del 17 de Junio de 2020, de EMD Millipore Corporation: Un metodo para purificar una proteina objetivo que contiene una region Fc de una o mas impurezas en una muestra, el metodo comprende las etapas de: a) poner en contacto […]
Dominios variables de inmunoglobulina, del 10 de Junio de 2020, de Ablynx NV: Dominio variable individual de inmunoglobulina de cadena pesada (ISVD), en que el residuo aminoacídico en la posición 89 es L y el residuo […]
Criterio de valoración terapéutico equivalente para inmunoterapia de enfermedades basada en antiCTLA-4, del 10 de Junio de 2020, de E. R. Squibb & Sons, L.L.C: Un anticuerpo antiCTLA-4 para su uso en el tratamiento de cáncer en un sujeto, tratamiento que comprende inducir un acontecimiento liminar […]