Uso de precursor Z para la fabricación de un agente para el tratamiento de deficiencia del cofactor de molibdeno humano.
Uso de precursor Z para la preparación de un agente para el tratamiento de deficiencia del cofactor de molibdenohumano que se atribuye directa o indirectamente a una síntesis del cofactor de molibdeno alterada,
caracterizadoporque como componente esencial de este agente se usa precursor Z.
Tipo: Patente Internacional (Tratado de Cooperación de Patentes). Resumen de patente/invención. Número de Solicitud: PCT/DE2005/000142.
Solicitante: Alexion Pharma International SARL.
Nacionalidad solicitante: Alemania.
Dirección: Avenue du Tribunal Fédéral 34 1005 Lausanne SUIZA.
Inventor/es: SCHWARZ,GUENTER, MENDEL,RALF, SANTAMARIA,JOSÉ, REISS,JOCHEN.
Fecha de Publicación: .
Clasificación Internacional de Patentes:
- A61K31/675 NECESIDADES CORRIENTES DE LA VIDA. › A61 CIENCIAS MEDICAS O VETERINARIAS; HIGIENE. › A61K PREPARACIONES DE USO MEDICO, DENTAL O PARA EL ASEO (dispositivos o métodos especialmente concebidos para conferir a los productos farmacéuticos una forma física o de administración particular A61J 3/00; aspectos químicos o utilización de substancias químicas para, la desodorización del aire, la desinfección o la esterilización, vendas, apósitos, almohadillas absorbentes o de los artículos para su realización A61L; composiciones a base de jabón C11D). › A61K 31/00 Preparaciones medicinales que contienen ingredientes orgánicos activos. › que tienen el nitrógeno como heteroátomo de un ciclo, p. ej. fosfato de piridoxal.
- A61P25/00 A61 […] › A61P ACTIVIDAD TERAPEUTICA ESPECIFICA DE COMPUESTOS QUIMICOS O DE PREPARACIONES MEDICINALES. › Medicamentos para el tratamiento de trastornos del sistema nervioso.
PDF original: ES-2406733_T3.pdf
Fragmento de la descripción:
Uso de precursor Z para la fabricación de un agente para el tratamiento de deficiencia del cofactor de molibdeno humano La invención se refiere al uso de precursor Z para la fabricación de un agente para el tratamiento de deficiencia del cofactor de molibdeno humano que se atribuye directa o indirectamente a una síntesis del cofactor de molibdeno alterada.
El cofactor de molibdeno (Moco) , un compuesto de pterina coordinado con molibdeno (Mo) altamente conservado, es necesario para la actividad de todas las enzimas de molibdeno con excepción de nitrogenasa. El Moco se prepara mediante una ruta de síntesis de varias etapas, única y evolutivamente antigua, de la que hasta la fecha se han identificado dos intermedios: el derivado de pterina exento de azufre y metal precursor Z y la molibdopterina (MPT) , una pterina con una función eno-ditiol que es esencial para la unión a Mo. Este último componente de pterina forma, presumiblemente, una pironapterina similar al Moco, que se ha encontrado en estructuras cristalinas de enzimas de Mo. La MPT también se coordina con wolframio (W) en enzimas dependientes de W.
A partir de HAENZELMANN PETRA Y COL.: “Functionality of alternative splice forms of the first enzymes involved in human molybdenum cofactor biosynthesis” JOURNAL OF BIOLOGICAL CHEMISTRY, volumen 277, Nº 21, 24 de mayo de 2002 () , páginas 18303-18312, ISSN: 0021-9258, se sabe que la expresión recombinante de ambas “proteínas que sintetizan el precursor Z” MOCS1A y MOCS1B (homólogas de las proteínas bacterianas MoaA y MoaC) tiene como consecuencia la acumulación de precursor Z.
Se sabe, además, que el precursor Z solo puede verificarse en las cepas de E. coli que presentan un defecto en la transformación de precursor Z a molibdopterina precursor Z, en este caso específicamente: una MPT-sintasa inactiva, que cataliza la etapa de transformación indicada.
Además, se conoce por WUEBBENS MARGOT M Y COL.: “Structural characterization of a molybdopterin precursor” JOURNAL OF BIOLOGICAL CHEMISTRY, volumen 268, Nº 18, 1993, páginas 13493-13498, ISSN: 0021-9258, la purificación de precursor Z a partir de células chIN de E. coli deficientes en molibdopterina mediante extracción ácida, una columna de intercambio aniónico de HPLC y una columna de fase inversa/ intercambio aniónico, habiéndose cultivado las células E. coli a 37 ºC y sin inductor.
Los tratamientos sustitutivos para enfermedades hereditarias, incluidos procedimientos para reemplazar enzimas, están limitados a menudo por la disponibilidad limitada del principio activo terapéutico necesario.
La deficiencia del cofactor de molibdeno (Moco) es una disfunción genética pleiotrópica que se caracteriza por la disminución de enzimas dependientes de molibdeno sulfito-oxidasa, xantina-oxidorreductasa y aldehído-oxidasa debida a mutaciones en genes de biosíntesis de Moco. Un intermedio de esta ruta de biosíntesis, el "precursor Z", es más estable que el mismo cofactor y posee una estructura conservada en todos los reinos de organismos. Por este motivo, la sustancia se produjo en la bacteria E. coli, se purificó y se usó para el tratamiento de ratones con genes inactivados (“knock-out”) deficientes en precursor Z que se corresponden en su cuadro clínico con la deficiencia del cofactor humano. Los ratones tratados con precursor Z alcanzan el estado adulto y son capaces de reproducirse. Análisis bioquímicos y morfológicos, así como investigaciones sobre el comportamiento, sugieren que el tratamiento descrito es adecuado para atenuar la mayor parte de los síntomas de la deficiencia de Moco humano.
Todas las enzimas que contienen molibdeno (Mo) de seres humanos, animales, vegetales, arqueas y bacterias, con la única excepción de nitrogenasa procariótica, necesitan un cofactor que está compuesto por un esqueleto orgánico, la denominada molibdopterina (MPT) y molibdenoB1. Este cofactor de molibdeno (Moco) único y “universal” posee en todos los grupos filogenéticos la misma estructura básica y en forma libre es muy inestable, en particular en condiciones aerobias, a no ser que esté unido a una apoproteínaB2. La ruta de biosíntesis de varias etapas, mediante la que un derivado de guanosina se transforma en Moco activo, está conservada evolutivamenteB1 y las proteínas correspondientes de diversos organismos implicadas en la síntesis de Moco son extremadamente homólogasB3-B7. Un defecto debido a una mutación en la biosíntesis de Moco provoca una reducción simultánea de la actividad de todas las enzimas de Mo, incluida la sulfito-oxidasaB8, B9. La deficiencia de Moco humana es un trastorno grave, genético, autosómico recesivo que clínicamente no puede diferenciarse de la deficiencia de sulfitooxidasa, menos frecuenteB10-B12. Aunque se conocen pocos casos gravesB13, la mayor parte de los pacientes afectados presentan anormalidades neuronales tales como ataques no tratables y desarrollo deficiente del cerebro, lo que es atribuible a la toxicidad del sulfito, una falta de sulfato o a ambas. Hasta la fecha, no hay ningún tratamiento eficaz disponible, por lo que los pacientes afectados mueren generalmente en la primera infanciaB14.
Los primeros genes eucarióticos de la biosíntesis de Moco que se pudieron aislar, procedían de la planta Arabidopsis thalianaB15. Una búsqueda de secuencias homólogas condujo a la identificación del primer gen humano de la biosíntesis de Moco, MOCS1B3. Los productos génicos MOCS1A y MOCS1B, cuya expresión implica un patrón complicado de ayustes alternativosB16-B18, transforman un derivado de guanosina en el precursor Z exento de azufre, que ya dispone de la única cadena lateral de MPT compuesta por cuatro átomos de carbonoB19. Las mutaciones en el gen MOCS1 se detectaron en dos tercios de los pacientes deficientes en Moco, que representan el grupo de complementación A o el tipo A deficiencia en MocoB10, B20. En una etapa posterior, el precursor Z se transforma en MPT; esto tiene lugar por medio de un enzima que está codificada por el gen MOCS2 y es activada por el producto génico MOCS3B4. La mayor parte de los pacientes de tipo B presentan mutaciones MOCS2B12, B13, B21. Finalmente, se transfiere Mo por medio de la proteína multifuncional gefirina a MPTB5. Hasta la fecha se ha descrito solo una familia con mutaciones en el gen de gefirina (GEPH) que provoca una deficiencia de Moco (tipo C) B22.
Como consecuencia de mutaciones en diversas etapas de la biosíntesis de Moco se ha descubierto que los fibroblastos de pacientes de tipo B presentan una concentración superior a la normal de precursor Z y lo suministran al medio de cultivo; este puede ser absorbido por células de tipo A en el transcurso de un cocultivo, lo que conduce al restablecimiento de la actividad de enzimas de Mo in vivoB20. Además, pudo demostrarse que el precursor Z procedente de fibroblastos humanos es idéntico al precursor bacterianoB23, B24 debido a que su biosíntesis se realiza de forma conservada en todos los organismosB15-B17 .
Un objetivo de la invención es proporcionar un agente para el tratamiento de la deficiencia de cofactor de molibdeno humano que puede deberse directa o indirectamente a una síntesis del cofactor de molibdeno alterada.
Este objetivo se logra con respecto al concepto general de la reivindicación 1 usando como componente esencial de este agente el precursor Z.
Con ello es posible, en primer lugar, preparar un agente para el tratamiento de la deficiencia de cofactor de molibdeno humano que puede deberse directa o indirectamente a una síntesis del cofactor de molibdeno alterada.
Se describe la obtención de un intermedio de pterina a partir de bacterias que se ha usado exitosamente en el tratamiento de una enfermedad mortal e incurable hasta la fecha.
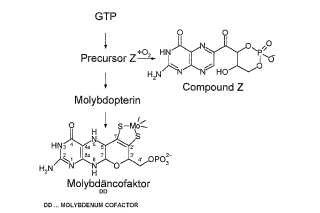
El precursor Z presenta la formula molecular C10H14N5O8P y representa una piranopterina y posee un diol geminal en la cadena lateral.
El precursor Z con la fórmula molecular C10H14N5O8P que representa una piranopterina tiene el diol geminal en la posición C1’.
Otros detalles de la invención se obtienen a partir de la descripción presentada a continuación y de las figuras adjuntas, en las que se ilustran las formas de realización preferentes de la invención.
En las figuras se muestra:
Figura 1: Esquema general de la biosíntesis de Moco. Se muestran las estructuras de Moco (tal como se encontraron en la estructura cristalina de enzimas de Mo) y del producto de oxidación del precursor Z, el compuesto Z (14, 15) . La numeración se representa y se usa tal como en los esquemas de numeración de pterina estándar; para discusión, véase (12) .
Figura 2: ESI-EM del precursor Z. A, espectro EM del precursor... [Seguir leyendo]
Reivindicaciones:
1. Uso de precursor Z para la preparación de un agente para el tratamiento de deficiencia del cofactor de molibdeno humano que se atribuye directa o indirectamente a una síntesis del cofactor de molibdeno alterada, caracterizado porque como componente esencial de este agente se usa precursor Z.
2. Uso según la reivindicación 1, caracterizado porque el precursor Z presenta como fórmula molecular C10H14N5O8P, representa una piranopterina y posee un diol geminal en la cadena lateral.
3. Uso según la reivindicación 1, caracterizado porque el precursor Z presenta como fórmula molecular C10H14N5O8P, representa una piranopterina y posee un diol geminal en la posición C1’.
4. Uso según la reivindicación 1, caracterizado porque el precursor Z presenta como fórmula estructural
representa una piranopterina y posee un diol geminal en la posición C1’.
9, 5 9, 4 9, 3 6, 4 6, 3 6, 2 5, 5 5, 4 5, 3 4, 7 4, 6 4, 5 4, 4 4, 3 4, 2 4, 1 4, 0 3, 6
9, 5 9, 4 9, 3 6, 4 6, 3 6, 2 5, 5 5, 4 5, 3 4, 7 4, 6 4, 5 4, 4 4, 3 4, 2 4, 1 4, 0 3, 6
9, 5 9, 4 9, 3 6, 4 6, 3 6, 2 5, 5 5, 4 5, 3 5, 0 4, 9 4, 7 4, 6 4, 5 4, 4 4, 3 4, 2 4, 1 4, 0 3, 6
Patentes similares o relacionadas:
Método para producir inmunoconjugados de anticuerpo-SN-38 con un enlazador CL2A, del 22 de Julio de 2020, de IMMUNOMEDICS, INC.: Un método para producir un compuesto, CL2A-SN-38, que presenta la estructura, **(Ver fórmula)** que comprende realizar un esquema de reacción como el que se muestra: **(Ver […]
Agente terapéutico para cáncer sólido, del 17 de Junio de 2020, de IDAC Theranostics, Inc: Un agente para uso en el tratamiento de cáncer sólido que comprende como principio activo un anticuerpo anti-CD4 que es un anticuerpo quimérico de tipo humano, un anticuerpo […]
Una terapia de combinación para un injerto estable y a largo plazo usando protocolos específicos para el agotamiento de los linfocitos T/B, del 20 de Mayo de 2020, de YEDA RESEARCH AND DEVELOPMENT CO. LTD.: Una dosis de células hematopoyéticas inmaduras de linfocitos T agotados, en donde dichas células hematopoyéticas inmaduras de linfocitos T agotados comprenden menos de 5 x 105 […]
Profármaco tenofovir éster monobencílico fosfamida, método de preparación y uso del mismo, del 6 de Mayo de 2020, de Jiangsu Tasly Diyi Pharmaceutical Co., Ltd: Un compuesto tenofovir éster monobencílico fosfamida de la fórmula general X, y el hidrato, solvato, sal farmacéuticamente aceptable del mismo o el isómero […]
Agente terapéutico para la disfunción meibomiana, del 6 de Mayo de 2020, de SANTEN PHARMACEUTICAL CO., LTD.: Una composición farmacéutica que comprende sirolimus a una concentración de 0,01 a 0,5% (p/v) como único ingrediente activo para uso en la supresión de la obstrucción de […]
Formulación de doxilamina y piridoxina y/o metabolitos o sales de estas, del 6 de Mayo de 2020, de DUCHESNAY INC.: Una forma de dosificación oral de liberación dual que comprende de 5 mg a 40 mg de doxilamina y/o una sal farmacéuticamente aceptable de esta y de 5 […]
Composición farmacéutica inyectable estable de antagonista del receptor de neuroquinina-1 y procedimiento para su preparación, del 29 de Abril de 2020, de PHARMATHEN S.A.: Una composición farmacéutica de liberación controlada para administración intramuscular o subcutánea que comprende Aprepitant o Fosaprepitant […]
Bisfosfonatos conjugados para el diagnóstico y la terapia de enfermedades óseas, del 22 de Abril de 2020, de SCV GmbH: Compuesto V para la complejación de isótopos metálicos, que comprende un quelante X y uno o varios vectores diana conjugados con el quelante X con la estructura -L1-R1-L2-R2-L3-R3, […]