Procedimiento de reducción de daño a células neuronales.
Uso de una metanfetamina en la fabricación de un medicamento para reducir la aparición de daño o muertecelular cerebral causada por una afección hipóxica y/o isquémica cerebral transitoria en un sujeto,
por unprocedimiento que comprende las etapas de: identificar un sujeto que tiene una afección hipóxica y/o isquémicacerebral transitoria, y en las 16 horas posteriores a la aparición de la afección, la administración al sujeto de unacantidad terapéuticamente eficaz de un metanfetamina.
Tipo: Patente Internacional (Tratado de Cooperación de Patentes). Resumen de patente/invención. Número de Solicitud: PCT/US2007/076034.
Solicitante: THE UNIVERSITY OF MONTANA.
Nacionalidad solicitante: Estados Unidos de América.
Dirección: UNIVERSITY HALL 116 MISSOULA, MT 59812-4104 ESTADOS UNIDOS DE AMERICA.
Inventor/es: POULSEN,DAVID J, RAU,THOMAS FREDERICK.
Fecha de Publicación: .
Clasificación Internacional de Patentes:
- A61K31/445 NECESIDADES CORRIENTES DE LA VIDA. › A61 CIENCIAS MEDICAS O VETERINARIAS; HIGIENE. › A61K PREPARACIONES DE USO MEDICO, DENTAL O PARA EL ASEO (dispositivos o métodos especialmente concebidos para conferir a los productos farmacéuticos una forma física o de administración particular A61J 3/00; aspectos químicos o utilización de substancias químicas para, la desodorización del aire, la desinfección o la esterilización, vendas, apósitos, almohadillas absorbentes o de los artículos para su realización A61L; composiciones a base de jabón C11D). › A61K 31/00 Preparaciones medicinales que contienen ingredientes orgánicos activos. › Piperidinas no condensadas, p. ej. piperocaína.
PDF original: ES-2452341_T3.pdf
Fragmento de la descripción:
Procedimiento de reducción de daño a células neuronales Campo de la técnica La presente invención está dirigida a usos para la reducción de la aparición de daño en las células neuronales, incluyendo la muerte celular, causada por la hipoxia transitoria cerebral y / o isquemia, que comprende las etapas de: diagnóstico de un sujeto que tiene una afección hipóxica y/o isquémica cerebral transitoria y en las 16 horas posteriores al inicio de la afección, la administración al sujeto de una cantidad neuroprotectora de un metanfetamina. En el presente documento también se divulgan, pero no reivindican, usos que implican un agente farmacéutico seleccionado del grupo que consiste en: un estimulante del sistema nervioso central (ESNC) , un neurotransmisor de monoamina, inhibidor de la monoaminooxidasa (IMAO) , antidepresivos tricíclicos (TCA) , o una combinación de los mismos, tales como anfetaminas, metilfenidato, metilendioximetanfetamina, o una combinación de los mismos.
Antecedentes de la invención Los accidentes cerebrovasculares son la principal causa de discapacidad entre los adultos, de los que más del 80% implica de lesión isquémica. Hasta la fecha, ninguna terapia preventiva o neuroprotectora ha demostrado ser eficaz en seres humanos. Las anfetaminas son uno de los grupos más ampliamente estudiados y prometedor de los medicamentos utilizados para facilitar la recuperación del accidente cerebrovascular después de haberse producido daños en las células neuronales (véase (Martinsson y Eksborg 2004) ) . En ratas, una dosis única de anfetaminas (por ejemplo, dexanfetamina) administrada 24 horas después de la ablación de la corteza sensitivomotora estimula la recuperación hemipléjica (Feeney et al. 1982) . Este efecto beneficioso se ha confirmado en una variedad de diferentes modelos de lesión focales y especies (Sutton et al. 1989; Hovda y Fenney 1984; Hovda y Feeney 1985; Schmanke et al. 1996; Dietrich et al. 1990; Stroemer et al. 1998) . En cada uno de estos estudios, la lesión isquémica de modeló mediante por la ligadura / embolia permanente de un componente vascular, o ablación cortical.
Un tipo diferente de lesión isquémica implica la interrupción transitoria y reperfusión del flujo sanguíneo al cerebro. El hipocampo es extremadamente sensible a este tipo de agresión isquémica. En los seres humanos y modelos experimentales con roedores, los episodios de isquemia breves pueden tener como resultado la muerte selectiva y retardada de neuronas localizadas en el hipocampo, en especial de las células piramidales del sector CAI (Kirino 1982) . Este tipo de lesión afecta al rendimiento de las tareas cognitivas que involucran la memoria espacial (Zola-Morgan et al. 1986, Squire y Zola-Morgan 1991) . Aunque la administración de anfetamina se asocia con una mejora de la recuperación del comportamiento en modelos de isquemia focal o ablación cortical, en la técnica anterior se notificó que el tratamiento con anfetaminas no reduce el volumen del infarto y por lo tanto, no es un protector preventivo o neuronal. La técnica anterior también sugiere que las anfetaminas facilitan la recuperación conductual después de una lesión cortical al influir en la plasticidad del cerebro (Gold et al. 1984) así como la resolución de la diasquisis ( (Hovda et al. 1987; Sutton et al. 2000) . No obstante, la técnica anterior, enseña, además, que las anfetaminas no mejoran la recuperación después de ciertos tipos de lesiones, incluidas las lesiones en la sustancia negra (Mintz y Tomer 1986) . La técnica anterior también enseña que la administración de anfetaminas (por ejemplo, metanfetamina; MA) antes de la isquemia focal en realidad aumenta el volumen del infarto en regiones corticales y del cuerpo estriado (Wang et al. 2001) .
Todavía existe la necesidad de un tratamiento que prevenga el daño neuronal antes de que ocurra y, de hecho proporciona protección neuronal después de la aparición de una afección hipóxica y / isquémica cerebral transitoria para minimizar o prevenir el daño. Tal procedimiento preventivo se describe en el presente documento, que proporciona un procedimiento para prevenir o reducir el daño a las células neuronales cerebrales antes de que ocurra en lugar de intentar tratar el daño después de su aparición y estimular la recuperación.
Sumario de la invención La presente invención se define en las reivindicaciones adjuntas y se refiere a usos para la reducción de la aparición de daño celular neuronal causado por hipoxia y / o isquemia cerebral transitoria, que comprende las etapas de: el diagnóstico de un sujeto que tiene una afección hipóxica y / o isquémica cerebral transitoria; y en un plazo de 16 horas después del inicio de la afección, la administración al sujeto de una cantidad neuroprotectora de una metanfetamina. En el presente documento también se divulga, pero no se reivindican, usos que impliquen un agente farmacéutico seleccionado del grupo que consiste en: un estimulante del sistema nervioso central (ESNC) , neurotransmisor de monoamina, inhibidor de la monoaminooxidasa (IMAO) , antidepresivos tricíclicos (TCA) , o una combinación de los mismos, tales como anfetaminas, metilfenidato, metilendioximetanfetamina, o una combinación de los mismos.
En una forma de realización específica, el agente farmacéutico es metanfetamina administrada al sujeto en cantidades de dosis unitarias de inferiores a 5 mg / kg.
En otras formas de realización específicas, el agente farmacéutico es una combinación de metanfetamina, metilfenidato, metilendioximetanfetamina, o una combinación de los mismos y al menos un agente adicional seleccionado del grupo que consiste en: un neurotransmisor de monoamina, un IMAO o un TCA. El agente adicional
también puede incluir un neurotransmisor de monoamina, preferentemente seleccionado del grupo que consiste en: dopamina, norepinefrina o serotonina.
La presente invención reduce la aparición de daño celular neuronal cerebral, que incluye la muerte celular, y más preferentemente, reduce la aparición de daño celular neuronal a las células neuronales. En una realización preferida, la presente invención reduce la aparición de daño celular neuronal a las células neuronales del hipocampo.
Típicamente, la afección hipóxica y/o isquémica cerebral transitoria hipoxia se debe una pérdida de sangre, un ataque al corazón, estrangulación, cirugía (por ejemplo, cirugía cardíaca) , un accidente cerebrovascular, bloqueo de las vías respiratorias, neuropatía óptica isquémica, lesiones medulares, lesiones cerebrales traumáticas lesión, o hipotensión. La afección sin embargo, puede estar causada por muchas condiciones, condiciones que causan daño celular neuronal debido a la falta de oxígeno y / o de glucosa en las células neuronales durante un período de tiempo temporal.
En ciertas realizaciones preferidas, el agente farmacéutico se administra en un plazo de 14, 12, 10, 8, 6, 4, o 2 horas desde la aparición de la afección. El agente se administra preferentemente por vía parenteral u oral, pero se contemplan otras vías y se pueden utilizar dependiendo de la afección.
En una forma de realización, el agente farmacéutico se administra en una composición farmacéutica que comprende un vehículo farmacéuticamente aceptable. La composición farmacéutica puede ser una formulación de liberación inmediata o extendida dependiendo de la afección y la probabilidad de recurrencia.
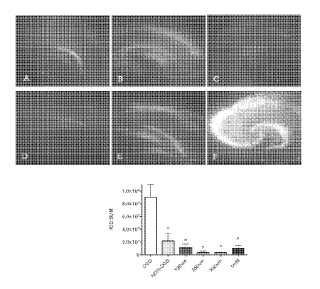
Breve descripción de los dibujos Figura 1: muestra una respuesta a la dosis neuroprotectora de MA tras privación de oxígeno-glucosa (POG) . Se muestran imágenes representativas de cultivos de cortes de hipocampo de rata teñidos con yoduro de propidio tomadas 48 horas después de la POG. Los cultivos se trataron con las siguientes dosis de MA: (a) control sin POG, (B) 125 μm de MA añadidos 5 minutos después de la POG, (C) 250 μm añadidos 5 minutos después de la POG, (D) 500 μm de MA añadidos 5 minutos después de la POG; (E) MA 1mMμm añadida 5 minutos después de la POG, (F) sólo PGD. El panal (G) muestra el análisis estadístico de la tinción con PI indicado como la intensidad de la fluorescencia relativa (IOD) . ** = P < 0, 01, ANOVA de una vía, análisis post hoc de Dunnet (POG) , barras de error = media y SEM, (POG) n = 10, (Sin POG) n = 13, (1 mM de MA) n = 10 , (500 μM de MA) n = 11, (250μM deMA) n = 9, (125μM DE MA) n = 7. Figura 2: muestra un análisis temporal de la neuroprotección mediada por MA tras POG. Se muestran imágenes representativas de cultivos de cortes de hipocampo de rata teñidos con yoduro de propidio tomadas 48 horas después de la POG. Una dosis de 250 μM de MA se administró después del accidente cerebrovascular en los puntos... [Seguir leyendo]
Reivindicaciones:
1. Uso de una metanfetamina en la fabricación de un medicamento para reducir la aparición de daño o muerte celular cerebral causada por una afección hipóxica y/o isquémica cerebral transitoria en un sujeto, por un procedimiento que comprende las etapas de: identificar un sujeto que tiene una afección hipóxica y/o isquémica cerebral transitoria, y en las 16 horas posteriores a la aparición de la afección, la administración al sujeto de una cantidad terapéuticamente eficaz de un metanfetamina.
2. Un medicamento que comprende metanfetamina para su uso en la reducción de la aparición de daño o muerte celular cerebral causada por la afección hipóxica y/o isquémica cerebral transitoria en un sujeto, por un procedimiento que comprende las etapas de: identificar a un sujeto que tiene que tiene una afección hipóxica y/o isquémica cerebral transitoria, y en las 16 horas posteriores a la aparición de la afección, la administración al sujeto de una cantidad terapéuticamente eficaz de una metanfetamina.
3. El uso de la reivindicación 1 o el medicamento para su uso de acuerdo con la reivindicación 2, en el que la metanfetamina administrada al sujeto en cantidades de dosificación unitaria es de menos de 5 mg / kg.
4. El uso de la reivindicación 1 o el medicamento para su uso de acuerdo con la reivindicación 2, en el que el tratamiento reduce la aparición de daño celular neuronal en las células cerebrales del hipocampo.
5. El uso de la reivindicación 1 o el medicamento para su uso de acuerdo con la reivindicación 2, en el que la afección está causada por hipotensión, pérdida de sangre, un ataque al corazón, lesión cerebral traumática, estrangulación, cirugía, un accidente cerebrovascular, neuropatía óptica isquémica u obstrucción de las vías respiratorias.
6. El uso o medicamento para su uso de acuerdo con la reivindicación 5, en el que la afección está causada por cirugía cardíaca.
7. El uso o medicamento para su uso de acuerdo con la reivindicación 5, en el que la afección está causada por una lesión cerebral traumática.
8. El uso de la reivindicación 1 o el medicamento para su uso de acuerdo con la reivindicación 2, en el que la administración se produce en las 14 horas posteriores al inicio de la afección y sólo se administra una dosis única de la metanfetamina.
9. El uso de la reivindicación 1 o el medicamento para su uso de acuerdo con la reivindicación 2, en el que la administración es mediante inyección en bolo.
10. El uso o medicamento para su uso de acuerdo con la reivindicación 9, en el que la metanfetamina es en una composición farmacéutica que comprende un vehículo farmacéuticamente aceptable.
11. El uso o medicamento para su uso de acuerdo con la reivindicación 10, en el que la composición farmacéutica es una formulación de liberación prolongada.
12. El uso de la reivindicación 1 o el medicamento para su uso de acuerdo con la reivindicación 2, en el que el medicamento consiste en metanfetamina y un vehículo farmacéuticamente aceptable.
13. El uso de la reivindicación 1 o el medicamento para su uso de acuerdo con la reivindicación 2, en el que el sujeto es un ser humano que necesita dicho tratamiento.
14. El uso o medicamento para su uso de acuerdo con la reivindicación 13, en el que la afección está causada por un accidente cerebrovascular isquémico, cirugía cardíaca o neuropatía óptica isquémica.
15. El uso o medicamento para su uso de acuerdo con la reivindicación 13, en el que la metanfetamina se administra en las 12 horas posteriores a la cirugía.
16. El uso o medicamento para su uso de acuerdo con la reivindicación 13, en el que la metanfetamina se administra en las 2 horas posteriores a la cirugía.
17. Uso de un metanfetamina en la fabricación de un medicamento para reducir la aparición de daño o muerte celular cerebral causada por una lesión cerebral traumática en un sujeto, por un procedimiento que comprende las etapas de: identificar un sujeto que tiene una lesión cerebral traumática y en las 16 horas posteriores a la aparición de la lesión, la administración al sujeto de una cantidad eficaz terapéutica de un metanfetamina.
18. Un medicamento que comprende metanfetamina para su uso en la reducción de la aparición de daño o muerte celular cerebral causada por una lesión cerebral traumática en un sujeto, por un procedimiento que comprende las etapas de: identificar un sujeto que tiene una lesión cerebral traumática y en las 16 horas posteriores a la aparición de la lesión, administrar al sujeto una cantidad terapéuticamente eficaz de un metanfetamina.
19. El uso de la reivindicación 17 o el medicamento para su uso de acuerdo con la reivindicación 18, en el que el medicamento consiste en metanfetamina y un vehículo farmacéuticamente aceptable.
Patentes similares o relacionadas:
Compuestos y procedimientos de uso, del 29 de Julio de 2020, de Medivation Technologies LLC: Un compuesto de fórmula (Aa-1): **(Ver fórmula)** o una sal farmacéuticamente aceptable del mismo, en la que: A representa H, halógeno, amino, […]
Triple combinación de antagonistas del receptor 5-HT6 puros, inhibidores de la acetilcolinesterasa y antagonista del receptor NMDA, del 15 de Julio de 2020, de SUVEN LIFE SCIENCES LIMITED: Una combinación que comprende un antagonista del receptor 5-HT6 puro, un inhibidor de la acetilcolinesterasa y un antagonista del receptor NMDA, en el que el antagonista […]
Combinación de agonistas inversos del receptor de histamina-3 con inhibidores de acetilcolinesterasa, del 24 de Junio de 2020, de SUVEN LIFE SCIENCES LIMITED: Una combinación que comprende un agonista inverso del receptor de histamina-3 y un inhibidor de acetilcolinesterasa; en donde el agonista inverso del receptor de histamina-3 […]
Compuestos inhibidores de la acetilcolinesterasa y agonistas de los receptores serotoninérgicos 5HT4, con efecto paramnesiante, sus procedimientos de preparación y composiciones farmacéuticas que los contienen, del 10 de Junio de 2020, de Université de Caen: Compuesto de fórmula general (I): **(Ver fórmula)** en la que: X representa un átomo de hidrógeno, o un átomo de halógeno […]
Nuevos derivados de piperazina y piperidina, síntesis y uso de los mismos en la inhibición de la oligomerización de VDAC, la apoptosis y la disfunción mitocondrial, del 3 de Junio de 2020, de The National Institute for Biotechnology in the Negev Ltd: Compuesto de Fórmula general (Id): **(Ver fórmula)** en la que L2 es un grupo de enlace seleccionado del grupo que consiste en un alquilamidileno […]
Nuevas composiciones para prevenir y/o tratar trastornos degenerativos del sistema nervioso central, del 27 de Mayo de 2020, de AMICUS THERAPEUTICS, INC: Un compuesto de Fórmula III: **(Ver fórmula)** en donde: R1 es C(R2)(R3)(R4); R2 es hidrógeno, -OH o halógeno; R3 es hidrógeno, -OH, halógeno o -CH3; […]
Compuestos de benzaldehído sustituidos y métodos para su uso en el aumento de la oxigenación tisular, del 27 de Mayo de 2020, de Global Blood Therapeutics, Inc: Un compuesto de Fórmula (I): **(Ver fórmula)** o un tautómero o una sal farmacéuticamente aceptable del mismo, para su uso en el tratamiento […]
Composición farmacéutica en comprimido que comprende bilastina, del 27 de Mayo de 2020, de Alfred E. Tiefenbacher (GmbH & Co. KG): Una composición farmacéutica en forma de comprimido, que comprende a) una forma cristalina de bilastina, en donde la forma cristalina tiene picos característicos a 6,53, […]