Micro-ARN asociado a exosoma como marcador de diagnóstico.
Un procedimiento para diagnosticar, caracterizar o evaluar la eficacia de tratamiento y/o progresión de un cánceren un sujeto,
que comprende:
a. aislar exosomas que comprenden microARN (miARN) de una muestra biológica o cada una de una serie demuestras biológicas obtenidas del sujeto;
b. determinar una cantidad de uno o más de los miARN en los exosomas aislados; y
c. comparar la cantidad del o los miARN con uno o más niveles de control de miARN, en el que una diferenciaen la cantidad del o los miARN de los exosomas en comparación con el o los niveles de control de miARN seusa para determinar el diagnóstico, la caracterización o la evaluación.
Tipo: Patente Internacional (Tratado de Cooperación de Patentes). Resumen de patente/invención. Número de Solicitud: PCT/US2008/071235.
Solicitante: UNIVERSITY OF LOUISVILLE RESEARCH FOUNDATION, INC..
Nacionalidad solicitante: Estados Unidos de América.
Dirección: Office Of Technology Transfer Med Center Three 201 E. Jefferson Street Suite 215 Louisville, KY 40202 ESTADOS UNIDOS DE AMERICA.
Inventor/es: TAYLOR,Douglas D, GERCEL-TAYLOR,Cicek.
Fecha de Publicación: .
Clasificación Internacional de Patentes:
- G01N33/53 FISICA. › G01 METROLOGIA; ENSAYOS. › G01N INVESTIGACION O ANALISIS DE MATERIALES POR DETERMINACION DE SUS PROPIEDADES QUIMICAS O FISICAS (procedimientos de medida, de investigación o de análisis diferentes de los ensayos inmunológicos, en los que intervienen enzimas o microorganismos C12M, C12Q). › G01N 33/00 Investigación o análisis de materiales por métodos específicos no cubiertos por los grupos G01N 1/00 - G01N 31/00. › Ensayos inmunológicos; Ensayos en los que interviene la formación de uniones bioespecíficas; Materiales a este efecto.
PDF original: ES-2420973_T3.pdf
Fragmento de la descripción:
Micro-ARN asociado a exosoma como marcador de diagnóstico Solicitudes relacionadas La presente solicitud reivindica el beneficio de prioridad de las Solicitudes Provisionales de Estados Unidos Nº de Serie 60/951.812 presentada el 25 de julio 2007 y 61/050.438 presentada el 5 de mayo de 2008, las divulgaciones completas de las cuales se incorporan en el presente documento por esta referencia.
Campo técnico
La materia objeto desvelada en el presente documento se refiere a procedimientos para diagnóstico y pronóstico de cáncer y resultados de embarazo adversos. En particular, la materia objeto desvelada en el presente documento se refiere a procedimientos de diagnóstico y pronóstico basados en la determinación de cantidades de uno o más micro-ARN derivados de exosomas correlacionados con cáncer o resultados de embarazo adversos en una muestra biológica de un sujeto.
Antecedentes
La identificación de biomarcadores de cáncer adecuados para la detección y diagnóstico temprano de cáncer es muy prometedora para mejorar los resultados clínicos de sujetos. Es especialmente importante para sujetos que presenten síntomas imprecisos o no los presenten o con tumores que sean relativamente inaccesibles al examen físico. A pesar de esfuerzos considerables dirigidos a la detección temprana, se han desarrollado pocos ensayos de exploración fiables y rentables que puedan diagnosticar cáncer en un estadio temprano.
Por ejemplo, el cáncer ovárico sigue siendo el sexto cáncer más común en mujeres en todo el mundo, provocando aproximadamente 125.000 muertes anualmente (Sankaranarayanan y Ferlay, 2006) . La mayoría de las mujeres con cáncer ovárico se diagnostican en un estadio avanzado, diagnosticándose al 75 % enfermedad extra-ovárica (Berek y col, 2003) . En comparación con otros cánceres asociados con mujeres, el 73 % de cánceres de endometrio, 55 % de cánceres de mama y 50 % de cánceres cervicales se diagnostican con enfermedad en estadio I (Menon y Jacobs, 2000) . Mientras que la supervivencia a los 5 años de pacientes con cáncer ovárico de estadio I excede el 90 %, solamente el 21 % de los pacientes con cáncer ovárico de estadio avanzado sobreviven 5 años después del diagnóstico inicial (Berek y col, 2003) . Puesto que la supervivencia a largo plazo no ha cambiado significativamente en las últimas décadas, las mejores perspectivas para mejora adicional de la supervivencia de cáncer ovárico residen en el diagnóstico temprano (Menon y Jacobs, 2000) .
El único biomarcador actualmente aprobado para la detección de cáncer ovárico es CA125 y su cuantificación por ELISA ha sido el “patrón oro” para la detección de cáncer ovárico desde su introducción en 1983. La evaluación de CA125 se usa normalmente en el tratamiento de enfermedades, tanto para detección de enfermedad así como para supervisión de reaparición de enfermedad; sin embargo, el uso de CA125 está limitado con respecto a detección de cáncer de estadio temprano (sensibilidad del 50 al 60 %) . La cuantificación de CA125 sólo está aprobada para y demostrada uniformemente para supervisión de remisión. CA125 no es sensible ni específico para detección de cáncer ovárico de novo, puesto que está elevado en > 50 % de mujeres con enfermedad de estadio I, aunque está elevado en más del 80 % de pacientes con cáncer ovárico de estadio avanzado. CA125 tiene escasa especificidad, lo que se muestra por su elevación en asociación con enfermedad de colon y mama benigna y maligna, irritantes peritoneales y enfermedades ginecológicas benignas, entre otros.
Se han introducido nuevas estrategias que facilitan el análisis proteómico simplificando drásticamente la separación de muestras pre-analítica y acoplamiento con espectrometría de masas (EM) para investigación de descubrimiento de biomarcadores. La espectrometría de masas de desorción/ionización por láser-tiempo de vuelo potenciada en superficie (SELDI-TOF-MS) ha recibido mucha atención para su uso en la resolución de proteínas en muestras de ensayo biológicas uniendo a matrices de microplacas de proteínas bioquímicamente definidas. En una tecnología, se examinan cuatro proteínas del suero por ELISA, mientras que otra tecnología usa espectrometría de masas de siete componentes del suero específicos o patrones peptídicos generales en suero del paciente para definir la presencia de cáncer. La realización de perfil de SELDI-TOF-MS se ha usado exitosamente para diferenciar el cáncer ovárico, de mama, de próstata y de hígado de los controles.
Se ha demostrado que la realización de perfil de SELDI-TOF-MS del suero es significativamente mejor que el biomarcador de suero convencional actual CA125 para distinguir pacientes con cáncer ovárico de los que tienen enfermedad ovárica benigna y de controles sanos. Los estudios han demostrado que la selección de una combinación de múltiples proteínas resueltas por SELDI-TOF-MS puede tener potencial como un enfoque de diagnóstico. Un ensayo de exploración eficaz para cáncer ovárico necesita conseguir una alta sensibilidad y especificidad, y actualmente, diferentes tecnologías proteómicas así como las herramientas analíticas computacionales usadas para diferenciar picos generan diferentes hallazgos. Estos estudios iniciales sobre informaciones de perfiles SELDI-TOF-MS son prometedores, y el concepto es reproducible en una serie de fondos diferentes; sin embargo, la traducción de este enfoque a un ensayo de diagnóstico rutinario sigue siendo difícil.
Se ha calculado que, para ser un ensayo de exploración eficaz, un ensayo necesita alcanzar un mínimo de un 99, 6 % de especificidad. Para conseguir este nivel de especificidad, se necesitan incorporar múltiples componentes de las características del tumor en nuevos ensayos de diagnóstico para la detección eficaz debido a la naturaleza multifactorial de los cánceres ováricos, así como otros. Una desventaja de las técnicas de espectrometría de masas es que algunas muestras de importancia pueden enmascararse por proteínas más abundantes en la EM así como en el análisis del resultado espectrométrico. La pre-purificación por varias técnicas tales como cromatografía líquida de alto rendimiento y selección positiva o negativa mediante unión de afinidad pueden retirar grupos particulares de proteínas. El mayor reto en la mayoría de los enfoques de espectrometría de masas actuales es el intervalo dinámico más que la sensibilidad. Aunque la retirada de proteínas o péptidos prevalentes puede aumentar en gran medida el contenido de información que pueda adquirirse de muestras particulares, proteínas prevalentes tales como albúmina pueden actuar como vehículos de subconjuntos de proteínas de importancia diagnóstica. Son necesarios estudios adicionales con tamaños de muestras mayores y unión cuidadosa de los conjuntos de validación independientes antes de que deban tenerse en cuenta consideraciones de aplicación de esta plataforma para exploración con respecto al cáncer ovárico o cualquier otra indicación.
Por lo tanto, sigue existiendo la necesidad de desarrollar biomarcadores mejorados en casi todos los cánceres y otros trastornos, incluyendo el riesgo aumentado de resultados de embarazo adversos. Los ensayos basados en sangre siguen siendo un objetivo atractivo debido a la disponibilidad y facilidad de la recogida de muestras. El diagnóstico definitivo más temprano de cáncer y riesgo aumentado para resultados de embarazo adversos facilitaría tratamiento más temprano y potencialmente más eficaz de los pacientes. Como tal, existe una necesidad no satisfecha de nuevos biomarcadores que individualmente, o en combinación con otros biomarcadores o modalidades de diagnóstico, proporcionen la sensibilidad y especificidad requeridas para detección y pronóstico temprano de cáncer y resultados de embarazo adversos. En particular, se necesitan ensayos sencillos con respecto a biomarcadores de cáncer y resultados de embarazo adversos realizados en líquidos biológicos fácilmente accesibles.
En Iorio M.V. y col. “MicroRNA gene expression deregulation in human breast cancer”, Cancer Research, volumen 65, nº. 16, 2005, páginas 7065-70, los autores describen que los miARN se expresan de forma aberrante en tumores de cáncer de mama frente a tejido de mama normal.
En Valadi H. y col, “Exosome-mediated transfer of mRNAs and microRNAs is a novel mechanism of genetic exchange between cells”, Nature Cell Biology, volumen 9, nº 6, 2007, páginas 654-59, los autores describen que los exosomas contienen ARNm y microARN, que puede transportarse entre células mediante los exosomas, y puede ser funcional en la nueva localización.
En Taylor D.D. y col.: “Pregnancy-associated... [Seguir leyendo]
Reivindicaciones:
1. Un procedimiento para diagnosticar, caracterizar o evaluar la eficacia de tratamiento y/o progresión de un cáncer en un sujeto, que comprende:
a. aislar exosomas que comprenden microARN (miARN) de una muestra biológica o cada una de una serie de muestras biológicas obtenidas del sujeto;
b. determinar una cantidad de uno o más de los miARN en los exosomas aislados; y
c. comparar la cantidad del o los miARN con uno o más niveles de control de miARN, en el que una diferencia en la cantidad del o los miARN de los exosomas en comparación con el o los niveles de control de miARN se usa para determinar el diagnóstico, la caracterización o la evaluación.
2. Un procedimiento para diagnosticar, predecir o evaluar el riesgo de un resultado de embarazo adverso en un sujeto, que comprende:
a. aislar exosomas que comprenden microARN (miARN) de una muestra biológica o cada una de una serie de muestras biológicas obtenidas del sujeto;
b. determinar una cantidad de uno o más de los miARN en los exosomas aislados; y
c. comparar la cantidad del o los miARN con uno o más niveles de control de miARN, en el que una diferencia en la cantidad del o los miARN de los exosomas en comparación con el o los niveles de control de miARN se usa para determinar el diagnóstico, la caracterización o la evaluación.
3. El procedimiento de la reivindicación 1, en el que el cáncer es un cáncer seleccionado del grupo que consiste en cáncer ovárico, cáncer cervical, cáncer de mama, cáncer endometrial, cáncer de colon, cáncer de próstata, cáncer de pulmón, melanoma y cáncer pancreático.
4. El procedimiento de la reivindicación 1 o 2, en el que el sujeto es humano.
5. El procedimiento de la reivindicación 1 o 2, en el que la muestra biológica o cada una de la serie de muestras biológicas comprende leche, sangre, suero, plasma, líquido ascítico, líquido quístico, líquido pleural, líquido peritoneal, líquido cefalorraquídeo, lágrimas, orina, saliva, esputo o combinaciones de los mismos.
6. El procedimiento de la reivindicación 1 o 2, en el que aislar los exosomas comprende usar cromatografía de exclusión por tamaño para aislar los exosomas, comprendiendo además opcionalmente centrifugar una fracción de cromatografía que comprende los exosomas, en el que la fracción de cromatografía comprende opcionalmente una fracción de volumen hueco.
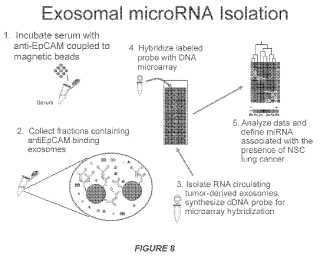
7. El procedimiento de la reivindicación 6 cuando depende de la reivindicación 1, en el que los exosomas son exosomas derivados de cáncer y los exosomas derivados de cáncer se separan de exosomas no derivados de cáncer por captura inmunoabsorbente usando un anticuerpo anti-antígeno de cáncer, opcionalmente en el que el anticuerpo anti-antígeno de cáncer es un anticuerpo anti-molécula de adhesión de células epiteliales (anti-EpCAM) .
8. El procedimiento de la reivindicación 1 o 2, en el que determinar la cantidad del o los miARN comprende marcar el
o los miARN, capturar el o los miARN con una o más sondas polinucleotídicas que se unen selectivamente cada una al o los miARN, usar una reacción en cadena de la polimerasa en tiempo real para cuantificar la cantidad del o los miARN, o determinar una cantidad total del miARN en los exosomas.
9. El procedimiento de la reivindicación 1 o 2, en el que el procedimiento se usa para diagnosticar, caracterizar o evaluar la eficacia del tratamiento y/o la progresión de un cáncer y el o los miARN se exponen en la Tabla 1 o la Tabla 2, o se seleccionan del grupo que consiste en miR-2I, miR-I4I, miR-200a, miR-200b, miR-200c, miR-203, miR205 y miR-214; o en el que el procedimiento se usa para diagnosticar, caracterizar, evaluar el riesgo de, o evaluar la eficacia de tratamiento y/o la progresión de un resultado de embarazo adverso y el o los miARN se exponen en la Tabla 3.
10. El procedimiento de la reivindicación 1 o 2, que comprende además seleccionar un tratamiento, modificar un tratamiento, evaluar la eficacia del tratamiento o evaluar la progresión para el cáncer o el resultado de embarazo adverso basándose en la cantidad del o los miARN determinados.
11. El procedimiento de la reivindicación 1, en el que la serie de muestras biológicas comprende una primera muestra biológica recogida antes del inicio del tratamiento para el cáncer y/o de la aparición del cáncer y una segunda muestra biológica recogida después del inicio del tratamiento o de la aparición.
12. El procedimiento de la reivindicación 1, en el que caracterizar el cáncer comprende determinar un tipo, un grado y/o un estadio del cáncer.
13. El procedimiento de la reivindicación 2, en el que el resultado de embarazo adverso es un trastorno seleccionado del grupo que consiste en ruptura prematura de membranas, preeclampsia, nacimiento prematuro, restricción del crecimiento intrauterino y pérdida de embarazo recurrente.
14. El procedimiento de la reivindicación 1 o 2, en el que el control se selecciona del grupo que consiste en
a. el nivel de al menos un producto génico de miARN de un sujeto que no tiene el trastorno, y
b. el nivel del al menos un producto génico de miARN de una muestra del sujeto que no presenta tal trastorno.
15. El procedimiento de la reivindicación 1 o 2, que comprende además identificar una correlación entre la expresión 5 de miARN y el cáncer o el resultado de embarazo adverso, que comprende:
a. marcar el miR aislado de una muestra de un sujeto que tiene o se sospecha que tiene el cáncer o el resultado de embarazo adverso;
b. hibridar el miARN con una matriz de miARN;
c. determinar la hibridación de miARN con la matriz; y
d. identificar miARN diferencialmente expresado en una muestra representativa del cáncer o del resultado de embarazo adverso en comparación con una referencia, en el que identificar miARN expresado diferencialmente comprende opcionalmente generar un perfil de miARN para la muestra y evaluar el perfil de miARN para determinar si miARN en la muestra se expresa diferencialmente en comparación con una muestra normal.
Patentes similares o relacionadas:
Dispositivos modulares para puntos de atención y usos de los mismos, del 29 de Julio de 2020, de Labrador Diagnostics LLC: Un sistema para la detección automatizada de un analito a partir de una muestra de fluido corporal, que comprende: un dispositivo de fluidos que comprende: […]
Anticuerpos del OPGL, del 15 de Julio de 2020, de AMGEN FREMONT INC.: Un anticuerpo, que comprende una cadena pesada y una cadena ligera, donde: a) la cadena pesada comprende: 1) una secuencia de aminoácidos recogida […]
Detección de interacciones proteína a proteína, del 15 de Julio de 2020, de THE GOVERNING COUNCIL OF THE UNIVERSITY OF TORONTO: Un método para medir cuantitativamente la fuerza y la afinidad de una interacción entre una primera proteína de membrana o parte de la misma y una […]
ANTICUERPO MONOCLONAL O UNA PORCIÓN DE UNIÓN A ANTÍGENO DEL MISMO QUE SE UNE A LA PROTEÍNA L DEL VIRUS PARAINFLUENZA HUMANO (PIV); MÉTODO Y KIT PARA DETECTAR AL VIRUS PIV, del 2 de Julio de 2020, de PONTIFICIA UNIVERSIDAD CATÓLICA DE CHILE: La invención presenta la generación de anticuerpos monoclonales, o fragmentos de los mismos, que reconocen la proteína L del virus parainfluenza humano (PIV), donde dichos […]
ANTICUERPOS MONOCLONALES ESPECÍFICOS PARA EL ANTÍGENO PB2 DEL VIRUS DE LA INFLUENZA HUMANA (FLU), SECUENCIAS NUCLEOTÍDICAS; MÉTODO Y KIT DE DIAGNÓSTICO DE INFECCIÓN PRODUCIDA POR FLU, del 2 de Julio de 2020, de PONTIFICIA UNIVERSIDAD CATÓLICA DE CHILE: La invención presenta la generación de anticuerpos monoclonales, o fragmentos de los mismos, que reconocen la proteína PB2 del virus de la influenza humana (Flu), […]
Dispositivo para la detección de analitos, del 1 de Julio de 2020, de TECHLAB, INC.: Un dispositivo para detectar por lo menos una sustancia de interés en una muestra líquida, comprendiendo el dispositivo: (a) una unidad que […]
Un ensayo de la respuesta inmunológica mediada por células, del 17 de Junio de 2020, de Cellestis Limited: Un método para medir una actividad de respuesta inmunológica mediada por células, comprendiendo dicho método: (a) proporcionar una composición de incubación […]
Método de deducción de un valor de positividad de biomarcador en porcentaje para células seleccionadas presentes en un campo de visión, del 10 de Junio de 2020, de NOVARTIS AG: Método de deducción de un valor para el % de positividad de biomarcador (PBP) para todas las células u, opcionalmente, uno o más subconjuntos de las […]